白细胞介素-1受体2型与c-Fos相互作用促进结肠癌细胞增殖、侵袭和血管新生
2022-06-02李雷张晨嵩潘成武杜军陈玉忠马家驰
李雷,张晨嵩,潘成武,杜军,陈玉忠,马家驰
(蚌埠医学院第一附属医院肿瘤外科综合病区,安徽 蚌埠 233004)
结肠癌为世界上第四大最常见的癌症[1],其中炎症参与了结肠癌进展的整个过程[2]。白细胞介素1(IL-1)信号传导是炎症性疾病调控的关键因素,并且是肿瘤生长、侵袭、血管生成和肿瘤与宿主相互作用的关键途径[3]。IL-1 受体包括IL1R1 和IL1R2。IL1R1 参与外源IL-1 的 信号 转导;而IL1R2 是诱饵受体,缺乏胞质信号传导域并阻断IL-1信号传导[4]。因此,IL1R2与IL-1受体拮抗剂相似,可作为IL-1 信号的负调节剂[5]。血管生成是许多生理和病理过程所需的基本过程,其受促血管生成因子和抗血管生成因子之间的平衡调节[6]。血管生成是肿瘤生长、侵袭和转移的关键步骤,原发肿瘤的扩展和转移到其他器官的转移都显著依赖[7]。许多因素在血管生成中起着重要作用,例如血管内皮生长因子(vascular endothelial growth factor,VEGF)、VEGF 受 体2 (VEGF receptor 2,VEGFR2)、缺氧诱导因子-1α(hypoxiainducible factor-1α,HIF-1α)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)[8]。研究表明c-Myb 通过c-fos 诱导的上皮间质转化促进结肠癌细胞的恶性进展[9]。本研究旨在明确IL1R2 与c-Fos 相互作用后如何进一步影响结肠癌细胞的增殖、侵袭和血管新生。
1 材料与方法
1.1 组织样本和细胞来源 选择2018年1月至2019年12月在我院行手术治疗的60例结肠癌患者为研究对象,患者年龄35~82岁,平均(67.31±7.62)岁;男39例,女21例;部位:右半结肠26例,横结肠6例,左半结肠18例,乙状结肠10例;肿瘤最大径:≤5 cm 39例,>5 cm 21例;浸润深度:T1 28例,T2 16例,T3 11例,T4 5例;分 化 程度:高分化26例,中分化24例,低分化10例;临床分期:Ⅰ期25例,Ⅱ期21例,Ⅲ期14例;淋巴结转移:无21例,有39例。本研究经蚌埠医学院第一附属医院机构审查委员会批准,同时60例被采集样本组织的患者签署了知情同意书。人结肠癌细胞株SW620 购自中国科学院典型细胞培养物保藏中心。
1.2 Western blot 法检测结肠癌组织及癌旁组织IL1R2 和c-Fos 的表达 收集结肠癌组织及癌旁组织的细胞裂解物,并使用放射免疫沉淀缓冲液提取蛋白质,转移至聚偏二氟乙烯膜(美国Thermo Fisher 科技公司)之前,使用10%或15% SDSPAGE分离总蛋白(50µg)。在室温(25 ℃)下用脱脂牛奶将膜封闭1 h。随后将膜与IL1R2 一抗(1∶500) 或c-Fos 一抗(1∶500)(美国Santa Cruz 公司)分别在25 ℃孵育2 h,与二抗(1∶2 000,美国Santa Cruz 公司)在37 ℃孵育1 h,随后用带有Tween 20 的Tris 缓冲盐水洗涤3 次。使用增强的化学发光进行可视化,并使用Quantum One软件版本4.62,通过光密度法对信号进行定量。β-actin作为内参照。该实验独立重复3次。
1.3 细胞培养 将人结肠癌细胞株SW620在含有10%胎牛血清(FBS,美国Gibco 公司)、100 μg/ml 青霉素(德国Sigma-Aldrich 公司)的RPMI 1640 培养基中单层培养。IL1R2 模拟物(IL1R2 mimic)和抑制剂(IL1R2 inhibitor)由上海吉玛制药技术有限公司合成。孵育20 h 后,根据说明书,使用LipofectamineTM 2000 (美国Thermo Fisher 科技公司),用IL1R2 mimic和inhibitor转染结肠癌SW620 细胞,制备完成的细胞株供后续实验使用。
1.4 双重荧光素酶测定IL1R2 与c-Fos 的3′-UTR间的靶向关系 将SW620 细胞接种在96 孔板中。温育24 h后,将细胞与c-Fos-WT或c-Fos-MUT 和IL1R2 mimic 或阴性对照模拟物共转染。转染后48 h,根据说明书使用双重荧光素酶测定系统测定细胞。独立重复3次。
1.5 实时定量聚合酶链反应(RT-PCR)法检测IL1R2 不 同 转 染 组IL1R2 和c-Fos的mRNA 表达 RT-PCR 热循环是在20 μl 反应溶液中进行的,其中包含2.5 μl cDNA,200 nm 每个引物和6.5 μl SYBR GreenⅠ主混合物,使用Roche Light Cycler 480 序列检测系统。IL1R2、c-Fos、3-磷酸甘油醛脱氢酶(GAPDH)引物序列由生工生物工程(上海公司提供),IL1R2 上游引物:5′-GCAGCTTGTGTGTGTGACTG-3′,下游引物:5′-CAGTCACACACACAAGCTGC-3′;c-Fos上游引物:5′-AGCATGGGCTCCCCTGTCA-3′,下游引物:5′-GAGACCAGAGTGGGCTGCA-3′;GAPDH上游引物:5′-CCTCGTCTCATAGACAAGATGGT-3′,下游引物:5′-GGGTAGAGTCATACTGGAACATG-3′。目的基因的表达水平相对于内参照GAPDH进行了标准化。
1.6 CCK8 法测定细胞增殖 使用CCK8 试剂盒(美国Dojindo Molecular Technologies,Inc.)检测人结肠癌SW620 细胞的增殖作用。收获处于对数生长期的人结肠癌SW620细胞,并在96孔板中以100 µl的体积进行培养。用对照、IL1R2 mimic和IL1R2 inhibitor 处理细胞,并在37 ℃孵育0、12、24 和48 h。使用Multiskan EX酶标仪(Thermo Fisher Scientific,Inc.)测量450 nm 波长处的光密度。
1.7 酶联免疫吸附(ELISA)法测定人结肠癌SW620细胞培养上清液中VEGF、VEGFR2、HIF-1α和bFGF的表达水平 ELISA试剂盒购自南京道斯夫生物科技有限公司。将人结肠癌SW620 细胞(5×105个细胞/孔)接种到6 孔板中,用10% FBS培养24 h,在低血清培养基(0.5%,v/v)中再培养12 h。将100 μl 样品添加到涂有抗体的96 孔板的每个孔中,在室温下孵育2 h。将100 μl 的工作检测器溶液加载到每个孔中,并将板在室温下再孵育1 h,添加100 μl 的底物溶液。通过添加50 μl 终止溶液来终止反应。在450 nm 波长下读取光密度。
1.8 Transwell 法检测细胞侵袭 将用对照、IL1R2 mimic 和IL1R2 inhibitor 处理的3 组细胞重悬于无血清RPMI 1640 培养基中,将各组细胞悬浮液(100 μl包含1×104个细胞/孔)接种到24孔培养箱的过滤器中;将明胶(10 μg/ml)添加到Transwell 板的每个孔(美国Corning-Costar 产品,孔径为8 μm)中,将膜在37 ℃下干燥1 h。此后,将悬浮在100 μl 无FBS 培养基中的5×103细胞接种到Transwell 板的上室中。下腔室充满含5% FBS 的培养基。温育8 h 后,用棉签除去Transwell 上膜顶部的细胞。用甲醇固定在膜底侧的细胞,并用4′,6-二脒基-2-苯基吲哚溶液(10 μg/ml,美国Invitrogen公司)染色20 min。在荧光显微镜下计数来自每个膜的8 个不同视野的细胞数目。
1.9 统计学方法 采用GraphPad Prism 5 软件进行统计学分析。计量资料采用均数±标准差表示,2 组比较采用t检验;多组比较采用单因素方差分析,其中两两比较采用LSD-t检验;重复测量资料比较采用重复测量资料的方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 IL1R2 和c-Fos 在结肠癌组织中的表达升高 Western blot 结果显示,IL1R2和c-Fos在结肠癌组织中的表达水平分别为1.93±0.25、1.88±0.20,明显高于癌旁组织(1.05±0.13和1.12±0.12)(t=6.318、4.255,P<0.05),见图1。

图1 Western blot法检测IL1R2和c-Fos在结肠癌组织及癌旁组织中的表达
2.2 荧光素酶测定IL1R2和c-Fos靶向作用 荧光素酶测定结果显示,IL1R2 mimic组c-Fos-WT荧光素酶活性为0.39±0.08,明显低于对照组(1.01±0.15)(t=6.823,P<0.05),而2组c-Fos-MUT荧光素酶活性分别为0.97±0.10和1.02±0.14,差异无统计学意义(t=7.819,P>0.05)。
2.3 RT-PCR 法检测IL1R2 不同转染组IL1R2 和c-Fos的mRNA 表达 RT-PCR 结果显示,与对照组比较,IL1R2 mimic 组IL1R2 和c-FosmRNA 表达升高(P<0.01),而IL1R2 inhibitor 组IL1R2 和c-FosmRNA表达降低(P<0.05),见表1。
表1 IL1R2不同转染组中IL1R2和c-Fos mRNA的表达水平(±s)

表1 IL1R2不同转染组中IL1R2和c-Fos mRNA的表达水平(±s)
注:与对照组比较,1)P<0.01,2)P<0.05
组别对照组IL1R2 mimic组IL1R2 inhibitor组F P IL1R2 mRNA 1.81±0.22 3.81±0.341)1.09±0.112)15.271 0.021 c-Fos mRNA 1.91±0.27 5.37±0.311)1.09±0.182)16.588 0.007
2.4 CCK8 法检测细胞增殖 CCK8 检测结果显示,经重复测量资料方差分析,组别(F=15.680,P<0.05)、时间(F=232.750,P<0.05)、组别与时间的交互作用(F=8.216,P<0.05)差异均有统计学意义。与对照组比较,IL1R2 mimic组12 h、24 h和48 h的细胞增殖升高(P<0.05),而IL1R2 inhibitor组12 h、24 h 和48 h 的细胞增殖降低(P<0.05)。见表2。
表2 CCK8法检测细胞增殖(±s)
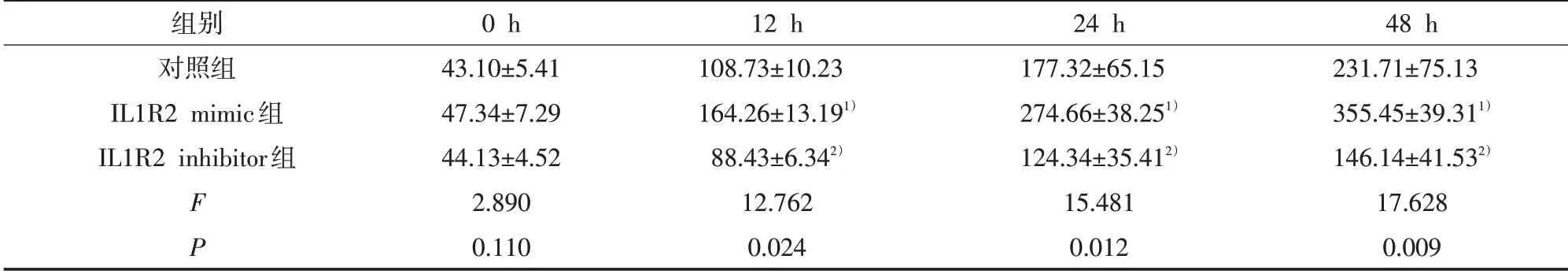
表2 CCK8法检测细胞增殖(±s)
注:与对照组比较,1)P<0.05,2)P<0.05
组别对照组IL1R2 mimic组IL1R2 inhibitor组F P 0 h 43.10±5.41 47.34±7.29 44.13±4.52 2.890 0.110 12 h 108.73±10.23 164.26±13.191)88.43±6.342)12.762 0.024 24 h 177.32±65.15 274.66±38.251)124.34±35.412)15.481 0.012 48 h 231.71±75.13 355.45±39.311)146.14±41.532)17.628 0.009
2.5 Transwell 侵袭分析 Transwell 结果显示,3组比较差异有统计学意义(F=5.134,P=0.020),与对照组(137.82±26.14)比较,IL1R2 mimic 组细胞侵袭数量(354.23±12.12)增加(P<0.01),而IL1R2 inhibitor 组细胞侵袭数量(93.26±21.44)降低(P<0.05),见图2。

图2 Transwell侵袭实验检测不同组别穿透滤过膜的细胞数量(4′,6-二脒基-2-苯基吲哚染色×200)
2.6 ELISA 检测血管生成因子的水平 ELISA 检测结果显示,与对照组比较,IL1R2 mimic组VEGF、VEGFR2、HIF-1α和bFGF表达水平升高(P<0.05),而IL1R2 inhibitor 组VEGF、VEGFR2、HIF-1α 和bFGF表达水平降低(P<0.05),见表3。
表3 ELISA检测血管生成因子的表达水平(±s,pg/ml)

表3 ELISA检测血管生成因子的表达水平(±s,pg/ml)
注:与对照组比较,1)P<0.05,2)P<0.05
组别对照组IL1R2 mimic组IL1R2 inhibitor组F P VEGF 64.73±12.56 92.39±11.491)38.08±8.422)15.334 0.009 VEGFR2 62.32±18.01 85.37±6.021)40.29±12.012)16.352 0.023 HIF-1α 54.37±14.30 76.83±4.241)32.03±10.892)11.341 0.012 bFGF 42.52±9.89 68.49±3.141)20.45±6.392)14.263 0.019
3 讨论
结肠癌病理生理过程涉及多种因素,其中炎症在肿瘤血管生成中起着重要的作用。IL1R2表达在用IFN-γ或佛波醇12-肉豆蔻酸酯13-乙酸酯处理的角质形成细胞中得到增强,表明IL1R2 起到促炎因子的作用[10]。最近的研究表明,细胞内IL1R2 的过表达增强了IL-6 的表达,因此,IL1R2在IL-1 信号传导的调节中具有明显的双重作用,即IL1R2抑制外源IL-1信号传导,而细胞内IL1R2刺激炎性细胞因子的表达[11]。IL1R2 的促炎活性不仅限于结肠癌细胞,还可以在致瘤性人类角质形成细胞中发现[12]。因为已在多种肿瘤中观察到IL1R2表达增强,所以我们可以推断IL1R2在驱动肿瘤进展中发挥重要功能。
c-Fos 能够调控肿瘤增殖、侵袭、血管生成、分化和凋亡等多个方面。其中,在细胞增殖方面,c-Fos 的外源表达能够使cyclinD 和cyclinE 的表达失调,加速凋亡S 期的进入[13]。不同功能的发挥和c-Fos不同下游基因的调控有密切关系。相关文献报道了与c-Fos 相互作用的蛋白。例如,c-Fos 与CBFA1 相互作用以激活胶原酶3 启动子,而HBXIP(乙型肝炎X 相互作用蛋白)的核输入依赖于HBXIP和c-Fos之间的相互作用以及这两者的磷酸化乳腺癌细胞中的蛋白质[13]。PRDM1过表达通过抑制c-Fos的表达减弱膀胱癌的进程[14]。本研究结果表明,比较结肠癌与癌旁正常组织后发现,结肠癌组织中IL1R2 与c-Fos 蛋白表达水平较癌旁正常组织明显升高,结合双重荧光素酶测定结果,进一步说明IL1R2 和c-Fos 之间存在相互作用关系。
VEGF 被认为是介导血管生成的最重要因素,其水平可以反映血管生成的状态[15]。因此,在过去的十年中,已经通过抑制VEGF 的表达来抑制血管新生。VEGFR2作为VEGF的受体,通过结合VEGF而发挥功能[16]。HIF-1在促进恶性细胞化疗耐药、肿瘤转移、血管生成、免疫抑制和细胞间相互作用中发挥重要作用,其可以调节血管生成相关因子的表达,从而介导血管生成过程[17]。bFGF是另一种与VEGF 相互作用的血管生成诱导剂[18]。本研究通过ELISA 检测结果显示,抑制IL1R2 表达后下调了VEGF、VEGFR2、HIF-1α 和bFGF这些促血管生成因子的表达。
综上所述,本研究明确了IL1R2 和c-Fos 在结肠癌组织中的表达水平明显高于癌旁组织。通过调控IL1R2 的表达直接作用于c-Fos,进而影响结肠癌细胞的增殖、侵袭和血管新生,影响结肠癌细胞的发生和进展。由于结肠癌SW620 细胞并不能完全代表其他类型的结肠癌细胞系,体外细胞实验亦不能够完全模拟体内生理生化环境,因此该实验也存在一定的局限性。
