铜绿假单胞菌QS系统调控基因和毒力基因的携带、表达及与耐药的相关性
2022-06-02时翠销宋国滨徐元宏
周 凯,时翠销,宋国滨,黄 颖,徐元宏
铜绿假单胞菌(Pseudomonasaeruginosa,PA)因产绿脓素而旧称绿脓杆菌,是一种无孢子、专性需氧、运动和氧化酶阳性的革兰阴性杆菌,被认为是最重要的机会致病菌之一,极易在免疫功能低下患者体内滋生[1]。研究[2]表明,PA可以分泌外毒素、弹性蛋白酶、胞外酶等多种毒力因子,在感染中起重要作用,同时对不同抗生素产生抵抗性也是毒力因子的一个属性。而群体感应(quorum sensing,QS)系统是PA通过产生小的可扩散分子来增加其毒力的机制,可以调节毒力和营养获取相关的一系列基因[3],也会影响抗菌药物的敏感性。且伴随着当前PA耐药情况的加剧,新型药物如毒力因子抑制剂、群体感应系统抑制剂的研发已成为治疗PA的新方向。该研究着重分析了PA对11种临床常用抗菌药物的耐药性,对PA常见的QS系统调控基因和毒力基因的携带、表达情况进行检测,分析两者与耐药的相关性,并验证了QS系统与毒力基因之间的调控关系,为临床更有效地治疗PA感染提供思路与依据。
1 材料与方法
1.1 菌株来源收集安徽医科大学第一附属医院检验科2020年6月—12月PA97株,其中呼吸系统来源的46株(痰液39株、纤支镜灌洗液7株),其他系统来源的51株(创面9株、分泌物15株、尿液15株、血液6株、导管3株、引流液2株、组织1株),同一患者相同部位分离株已剔除。对照菌株为本实验室保存的PA标准菌株;质控菌株为大肠埃希菌ATCC8739、PAATCC27853,均来自本科室。
1.2 仪器和试剂哥伦比亚血平板 (合肥天达诊断试剂有限公司);VITEK-MS质谱仪、Vitek2-Compact微生物鉴定仪(法国生物梅里埃公司);药敏纸片 (英国Oxoid公司);Tap PCR Master Mix、扩增引物、琼脂糖、DNA分子量标准、TRIzol试剂、逆转录试剂盒、qPCR Master mix(上海生工生物工程股份有限公司);LifeECO基因扩增仪(杭州博日科技有限公司);凝胶成像系统(美国BIO-RAD公司);实时荧光定量PCR(qRT-PCR)仪cobas z 480(罗氏分子有限公司)。
1.3 菌株鉴定及药物敏感性实验选取菌株后在血平板上分区划线接种培养,待长出菌落后用质谱仪进行重新鉴定。鉴定明确后应用Vitek2-Compact仪进行药敏试验,缺少的抗菌药物用纸片扩散(K-B)法补全,以2020年美国临床和实验室标准化协会(CLSI)文件为参照进行药敏结果判读及统计。
1.4 QS系统调控基因及毒力基因检测
1.4.1DNA模板的制备 将鉴定后的菌株再次进行接种、孵育培养留取菌落,采用煮沸法获取基因扩增所需DNA模板,整个过程防止污染,避免影响后续操作及结果。
1.4.2基因扩增及电泳 基因种类及PCR引物序列(表1)根据文献[4-5]获得,并委托上海生工生物工程股份有限公司合成,目的基因扩增总体系为25 μl, 热循环参数:初始变性95 ℃、5 min;95 ℃、30 s,53~69 ℃退火30 s,72 ℃、60 s,循环35个周期;最终72 ℃延伸10 min,产物置于4 ℃待电泳。每株各取10 μl PCR产物经1%琼脂糖凝胶电泳,用凝胶成像系统观察电泳结果并留存图像。

表1 QS系统调控基因及毒力基因引物序列
1.4.3核苷酸序列测定与分析 将扩增的阳性PCR产物委托上海生工生物工程股份有限公司进行测序。将所测序列与NCBI数据库收录的基因序列作比对。
1.5 调控基因及毒力基因表达水平检测根据电泳及测序结果筛选出基因型相同的28株PA(其中14株为多重耐药PA(multidrug resistantPseudomonasaeruginosa,MDR-PA))于温箱摇菌过夜,运用TRIzol法提取RNA,检测其浓度、纯度后进行逆转录。并对其中两种调控基因(LasI、rh1R),两种毒力基因(exoS、PCN)进行qRT-PCR检测,qRT-PCR引物序列见表2。过程中以16S rRNA作为内参基因,PA标准菌株作为对照组。荧光定量完成后采用相对定量法2-ΔΔCt计算各菌株基因的表达水平。

表2 qRT-PCR调控基因及毒力基因引物
1.6 统计学处理使用SPSS 20.0软件进行分析,对调控基因及毒力基因与耐药性的相关性分别应用t检验、χ2检验进行分析,利用线性相关系数分析调控基因LasI、rh1R与毒力基因exoS、PCN的关系,以P<0.05为差异有统计学意义。
2 结果
2.1PA对11种常见抗菌药物的耐药率及分析97株PA对11种常见抗菌药物的耐药率最高的为亚胺培南25.77%,其次为氨曲南24.74%,最低为阿米卡星2.06%,见表3。其中43株为MDR-PA且多数对四种及以上抗菌药物耐药。根据标本来源不同分为呼吸系统(痰、纤支镜)来源和其他部位来源两大类,呼吸系统来源的菌株对抗菌药物的耐药率相对更高,且对氨曲南、头孢他啶、哌拉西林/他唑巴坦耐药率的差异有统计学意义(P<0.05),见表4。
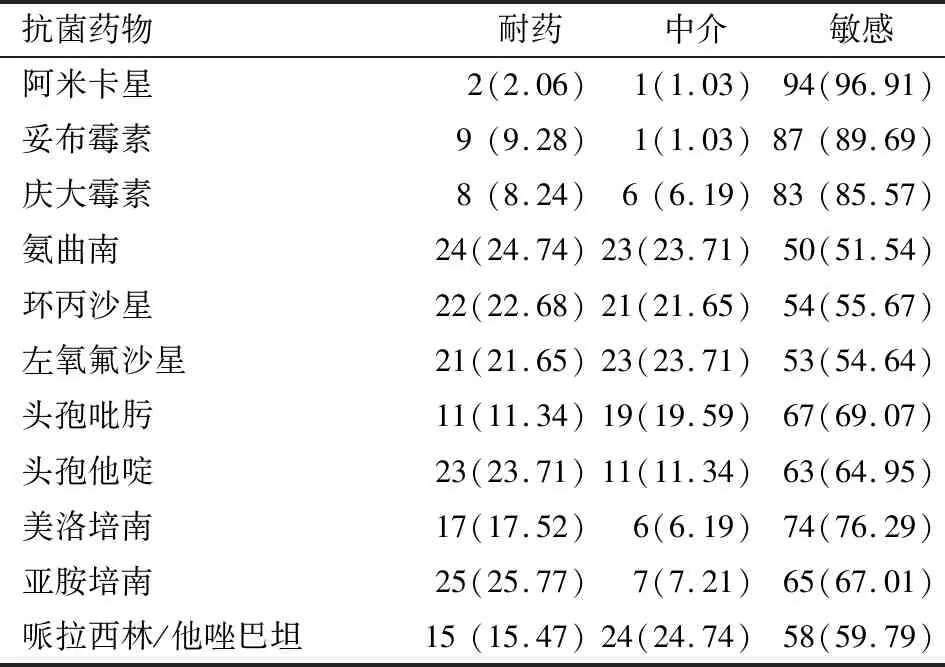
表3 97株PA对11种抗菌药物的药敏结果[n(%)]
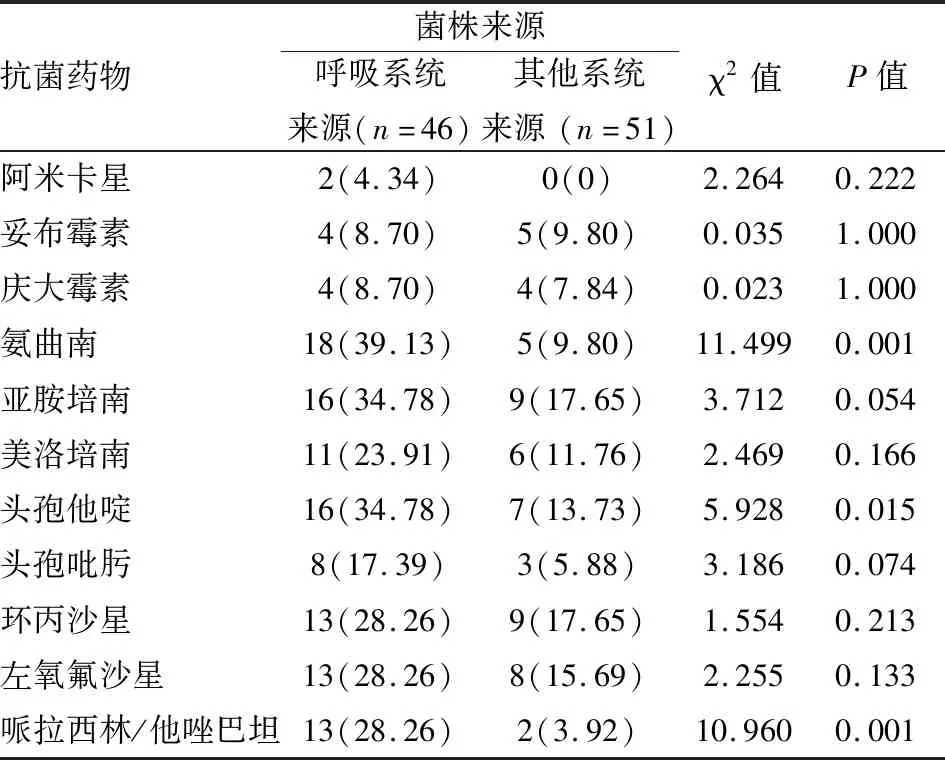
表4 不同来源PA对11种抗菌药物耐药性分析[n(%)]
2.2 QS系统调控基因及毒力基因检测结果QS系统调控基因LasI、LasR、Rh1I、Rh1R均检出且检出率为100%;7种毒力基因也均被检出,检出率由高到低依次为exoT 98.97%(96/97),exoY 97.94%(95/97),ToxA 97.94%(95/97),LasB 96.91%(94/97),exoS 86.60%(84/97),PCN 43.30% (42/97),exoU 13.40%(13/97),PCR阳性条带见图1。

图1 QS系统调控基因、毒力基因阳性条带图M:marker;1~11:LasR、LasI、rh1I、rh1R、exoS、exoT、exoY、exoU、lasB、PCN、ToxA基因阳性条带
2.3 QS系统调控基因及毒力基因测序分析测得的基因序列与NCBI基因库比对,一致率在98%以上。部分基因测序结果,见图2~4。
图2 LasR基因测序图
图3 exoU基因测序图
图4 PCN基因测序图
2.4 毒力基因与耐药性的关系携带不同毒力基因菌株的耐药性有所不同,其中未携带毒力基因的菌株对头孢他啶等6种抗菌药物耐药,携带有7种毒力基因的菌株对头孢他啶耐药;PCN、exoS、exoU阳性菌株中,非多重耐药PA(non-multidrug resistantPseudomonasaeruginosa,NMDR-PA)所占比例更高;与PCN-菌株之相比,PCN+菌株对头孢他啶、哌拉西林/他唑巴坦等药物的耐药率相对较高,且对哌拉西林/他唑巴坦的差异有统计学意义(P<0.05);exoS+/exoU- 菌株对阿米卡星等大部分药物较exoS-/exoU+菌株耐药率相对更高,其中对头孢他啶、妥布霉素、庆大霉素的差异有统计学意义(P<0.05);PCN-/exoS+/exoU-与PCN+/exoS+/exoU-之间的耐药率也有所差异,其中PCN+/exoS+/exoU-对抗菌药物的耐药率更高,且对哌拉西林/他唑巴坦、头孢他啶、头孢吡肟、美洛培南耐药率的差异有统计学意义(P<0.05),见表5。

表5 携带不同毒力基因的PA耐药性分析[n(%)]
2.5 调控基因和毒力基因表达水平及分析调控基因LasI、rh1R在28株PA菌株中均有表达,表达水平见图5,其中,与14株MDR-PA相比,NMDR-PA
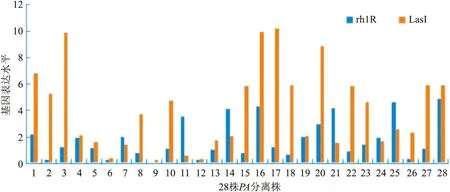
图5 28株PA调控基因rh1R、LasI表达水平
调控基因rh1R、LasI的相对表达量更高,且LasI的差异有统计学意义(P<0.05)。 毒力基因exoS均有表达,而PCN表达不完全,随机挑选15株四种基因全部表达的菌株,分别分析两种调控基因与两种毒力基因相对表达量的关系,调控基因rh1R与毒力基因exoS之间的表达呈正向线性关系(P<0.05),相关系数r=0.685 ;调控基因LasI与毒力基因PCN之间的表达呈正向线性关系(P<0.05),相关系数r=0.692。见图6。

图6 15株PA调控基因rh1R、LasI及毒力基因exoS、PCN的表达水平
3 讨论
PA是院内感染中最常见的病原菌之一,而且致病及耐药机制复杂,对其防治是医务工作中的巨大挑战,因此对临床标本分离PA的研究具有重要价值。本文较国内其他相关分析报道,扩大了毒力因子范围并加入了对QS系统调控基因及PA耐药情况的监测。本研究中97株PA的耐药率与李国强[6]监测的PA临床重点药物敏感率有所不同,其中对碳青霉烯类药物(亚胺培南、美洛培南)耐药率较头孢类药物(头孢他啶、头孢吡肟)高,考虑可能是不同地区对PA的耐药性产生影响。其中近1/2为MDR-PA,且多数对四种及以上抗菌药物耐药,因此,重视药敏结果,选择有效的药物联合来抑制或杀灭MDR-PA是临床治疗其感染的有效方案[7]。同时,该研究提示呼吸系统来源菌株的耐药性相对更高,与全国细菌耐药检测网的结果[8]一致。
本研究选取了Lasl、LasR、Rhll、RhIR四种调控基因进行检测,且检出率均为100%,说明调控基因在PA中是稳定存在的,一般不会发生缺失。挑选两种调控基因LasI、RhIR进行表达量的检测,结果显示两者在NMDR-PA中表达量相对更高,且LasI的差异有统计学意义。同时结果显示调控基因能正向调控毒力基因的表达,由此可以看出QS系统在PA耐药及其毒力表达方面具有重要作用。目前已有研究[9]提出抑制QS系统作为治疗PA的靶点,如近来Abbas et al[10]研究表明西格列汀作为一种新型的抗群体感应药物,可用于由PA造成感染的糖尿病或非糖尿病患者的预防和治疗,所以在治疗过程中应注意必要时抗群体感应药物的使用。
该研究根据毒力基因检出率及组合分析,未检测到毒力基因的菌株对头孢他啶等6种抗菌药物耐药,而含有7种毒力基因的菌株仅对头孢他啶耐药;前者耐药性明显高于后者,同时在PCN、exoS、exoU阳性菌株中,NMDR-PA所占比例更高,这与调控基因Rh1R、LasI在NMDR-PA中相对表达量更高较一致;因此推测PA可能存在高毒力低耐药的现象。ToxA检出率为97.94%,与相关报道[4]类似。lasB检出率为96.91%,明显高于内蒙古地区[11]检出率,这可能与菌株选择或地区分布有关;因此应重视对LasB的研究,探讨本地区有高检出率的原因,或许有利于对PA的监测与治疗。PCN检出率为43.30%,其中PCN+菌株对哌拉西林/他唑巴坦耐药率更高且差异有统计学意义。而Dietrich et al[12]已研究表明绿脓菌素可以上调外排泵mexGHI-opmD基因的表达,而外排泵系统是PA重要的耐药机制之一,同时有哌拉西林/他唑巴坦能够对PA外排泵系统MexAB-OprM、MexXY-OprM影响的报道[13],因此进行PCN阳性菌株对哌拉西林/他唑巴坦耐药性研究有一定的价值。
同时有研究[14]表明PA致病的毒力因子主要来自Ⅲ型分泌系统(T3SS),分泌exoT、exoY、exoS和exoU四种细胞毒素,exoY、exoT在大多数菌株中都会表达,且毒性相对较弱;PA一般只表达exoS或exoU其中的一种,且绝大多数以exoS+/exoU-的形式存在[15],本研究结果与之也较为一致。且本研究表明exoS+/exoU-相比于exoS-/exoU+对多数抗菌药物的耐药性更强,与张秀彩 等[16]的研究结果不同,推测可能由两种毒力因子效应不同引起;exoU毒性是exoS的100倍,因此exoS+/exoU-可以让宿主细胞维持更长的存活时间,让其获得更多接触抗菌药物的时间与机会,从而产生较强的耐药性。这也与前文推测的高毒力低耐药现象相吻合。同时,本研究将PCN联合exoS、exoU进行分析,与单独分析两者时的结果相比,PA耐药率发生改变且有统计学意义的药物数量增加;说明各系统间不是彼此独立的,而是一个相互影响的整体,这也提示对PA的探索研究应努力做到全面细致。
