1 株高产油脂长孢被孢霉MD-3菌株的诱变育种
2022-06-02陈崇艺朱露露柴春月
程 晗,陈崇艺,朱露露,柴春月
(南阳师范学院生命科学与农业工程学院,河南 南阳 473061)
微生物油脂又称为单细胞油脂,主要是指霉菌、酵母菌、细菌以及藻类等微生物在适当的条件下利用碳水化合物、碳氢化合物等作为碳、氮源,辅以无机盐在细胞中产生并贮存在细胞内的甘油酯。微生物油脂的脂肪酸成分较为丰富,许多丝状真菌能合成具有高附加值的不饱和脂肪酸,如花生四烯酸(arachidonic acid,ARA)、二十碳五烯酸(eicosapentaenoic acid,EPA)、-亚麻酸(-linolenic acid,GLA)等。部分功能性脂肪酸在高等真核生物中具有重要的生物学效应,如ARA是人体必需的脂肪酸,具有卓越的药用价值和营养保健功能,EPA可防治心血管病、风湿性关节炎和气管炎,预防心律失常和心脏性猝死等,富含GLA的油脂是一类保健性油脂,它可预防糖尿病、癌症、肥胖症,同时具有降血压、提高机体免疫力等作用,也可以添加进化妆品提高保湿以及抗衰老效果。因此这类功能性不饱和脂肪酸对人类健康具有重要意义。
目前研究比较多的产油脂微生物主要以丝状真菌、酵母菌和藻类为主,在这3 类微生物中,丝状真菌以其脂肪酸成分丰富而凸显优势。多数研究结果表明,野生型丝状真菌菌株的油脂含量相对较低,难以满足工业化生产的条件,因此开展以丝状真菌为研究对象,进行高产油脂菌株的人工选育十分必要。常见的人工育种方法包括杂交育种、诱变育种、基因工程育种和原生质体融合,其中,诱变育种不需要探究菌株复杂的遗传背景,过程相对简单,主要包括物理因子诱变、化学因子诱变以及复合诱变育种技术。刘红霞对粘红酵母()进行低能离子注入诱变、紫外诱变和微波诱变等方法处理,获得油脂产量为3.10 g/L的突变菌株,比出发菌株提高了33.05%。罗国聪等通过紫外线-氯化锂复合诱变方法处理1 株桔青霉(),最终得到1 株油脂产量为7.10 g/L的突变菌株,较出发菌株油脂产量提升了84.42%。姚青蔚对1 株被孢霉属(sp.)TSM-3菌株进行常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变,最终获得的突变菌株平均脂质积累量为5.07 g/L,ARA产量为1.54 g/L,较出发菌株分别提高了47.8%和84.5%。由此可见通过诱变育种的方法,能高效地提高产油微生物的油脂产量。
本研究以产油植物及其根围土壤为样品,采用苏丹黑染色法,从中筛选出高产油脂的丝状真菌,以筛选出的菌株为出发菌,通过ARTP诱变技术处理,获得突变菌株,并比较其油脂含量和产量的变化。通过比较原始菌株和突变菌株在发酵过程中菌丝形态、菌丝密度、菌丝长短等形态变化,探究其油脂含量和产量提高的影响因素。结合实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)技术进一步检测脂肪酸合成通路中两个关键基因的表达量变化情况。旨在为高产油脂的丝状真菌的人工选育提供有应用价值的菌源。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
于2019年在河南南阳国家农业科技园,分别采集玉米、花生、大豆、油菜植株及其根系土样品,在南阳市镇平县油用牡丹基地采集油用牡丹植株及其根系土样品,将样品装入无菌牛皮纸袋内,标记采集时间及地点,封装后4 ℃保存备用。
1.1.2 试剂
葡萄糖、番红染液、苏丹黑B、酵母提取物、琼脂粉北京索莱宝科技有限公司;真菌基因组DNA提取试剂盒无锡百泰克生物技术有限公司;2×SanPCR Mix生工生物工程(上海)股份有限公司;Fungal RNA Kit总RNA提取试剂盒 美国Omega公司;PrimeScriptRT reagent Kit with gDNA Eraser 宝日医生物技术(北京)有限公司;FastStart Universal SYBR Green Master 上海罗氏制药有限公司;其他化学试剂均为分析纯。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基 北京索莱宝科技有限公司;Broth种子培养基:葡萄糖20 g/L,酵母提取物5 g/L,磷酸二氢钾1 g/L,七水合硫酸镁0.25 g/L,硝酸钾10 g/L,pH值自然;基础发酵培养基:葡萄糖50 g/L,酵母提取物5 g/L,磷酸二氢钾2.4 g/L,七水合硫酸镁0.5 g/L,硝酸钾1 g/L,二水合氯化钙0.1 g/L,六水合三氯化铁0.015 g/L,七水合硫酸锌0.007 5 g/L,五水合硫酸铜0.000 5 g/L,pH值调至5.5。上述培养基均在115 ℃灭菌30 min。
1.2 仪器与设备
HNY-2102C型智能恒温培养振荡器 天津欧诺仪器股份有限公司;SPX-160H型智能生化培养箱 宁波扬辉仪器有限公司;ARTP诱变育种系统 无锡源清天木生物科技有限公司;FA2104型电子天平 上海舜宇恒平科学仪器有限公司;JW-2019H型台式高速离心机安徽嘉文仪器装备有限公司;SGD-IV型还原糖测定仪山东省科学院生物研究所;7500型实时荧光定量PCR仪美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 菌株分离纯化
参考陈娟等方法,采用植物组织块分离法对产油植物中内生真菌进行分离纯化。参考马治灿方法,从根系土壤样品中分离产油真菌。
1.3.2 苏丹黑染色
A液:称取苏丹黑B 0.3 g溶于100 mL无水乙醇中,室温放置1 周,期间经常振荡使其完全溶解;B液:称取16 g苯酚溶于30 mL无水乙醇,再与100 mL 0.3%十二水合磷酸氢二钠溶液混合。取A液60 mL与B液40 mL混合,过滤后即为苏丹黑染液。挑取少许菌丝于载玻片上,滴加苏丹黑染液染色20~30 min,二甲苯冲洗多余染色液,自然风干,番红染液复染1~2 min,无菌水冲洗,自然干燥后镜检观察。
1.3.3 菌株鉴定
1.3.3.1 形态鉴定
将复筛到的菌株转接于PDA平板上,28 ℃恒温培养2~7 d,观察记录菌株的生长速度、菌落特征等。采用载玻片湿室培养法(图1)观察菌丝显微结构。
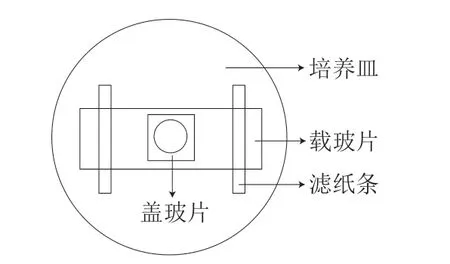
图1 载玻片湿室培养示意图Fig.1 Schematic diagram of slide culture in moist chamber
1.3.3.2 分子鉴定
采用真菌基因组DNA提取试剂盒进行菌株基因组DNA的提取。以通用引物ITS1/4扩增转录间隔区(internal transcribed spacer,ITS)序列,以通用引物NL1/4扩增目核糖体大亚基(ribosomal large subunit,LSU)序列,引物如表1所示。PCR总体系为25 μL,包含上下游引物各1 μL,2×SanPCR Mix 12.5 μL,gDNA 1 μL,ddHO 9.5 μL。PCR程序:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,循环30 次;72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶检测后送生工生物工程(上海)股份有限公司测序,测序结果在NCBI在线数据库(http://www.ncbi.nlm.nih.gov/blast)中进行BLAST比对,挑选出相关序列后用Clustal X软件进行多序列比对,用MEGA 7.0软件构建基于ITS+LSU序列的NJ(Neighbor-Joining)系统发育树,并进行Bootstrap分析,重复次数为1 000 次。
1.3.4 产油菌ARTP诱变育种
1.3.4.1 孢子悬液的制备
将出发菌株接种到PDA平板上28 ℃培养5~8 d,用15%的无菌甘油溶液冲洗,并收集冲洗液,经4 层无菌擦镜纸过滤,收集孢子悬液,用无菌水调整孢子浓度至10CFU/mL,备用。
1.3.4.2 致死率曲线的制作
将10 µL孢子悬液均匀涂布到ARTP载片上,设置电源功率110 W,气流量10 slpm,处理距离2 mm,分别处理0、20、40、60、80、100、120、140、160、180 s。将处理后的载片分别放入装有1 mL无菌水的离心管中充分振荡混匀,适当稀释后涂布平板,每个处理设置3 个重复,28 ℃培养2~5 d,统计每个平板上的菌落数,以0 s处理样品为对照,计算致死率。
选择致死率为70%~80%的处理时间多次进行ARTP诱变,将处理过的孢子悬液涂布在含有浅蓝菌素的PDA平板上,28 ℃培养2 d。挑选菌落较大的菌株进行纯化培养,纯化后接种到基础发酵培养基中测定菌株的油脂产量,挑选出油脂产量较高的菌株进行斜面保存,备用。
1.3.4.3 遗传稳定性分析
将筛选得到的高产油脂突变菌株依次连续传代培养7 次,测定各菌株每个时代油脂产量,挑选出油脂产量稳定的菌株,斜面保存,备用。
1.3.5 指标测定
1.3.5.1 生物量的测定
取50 mL发酵液中的湿菌体于质量的玻璃培养皿中,置于100 ℃的烘箱内烘至质量恒定,取出自然冷却,称量培养皿和干菌体总质量。菌体生物量计算如式(1)所示:
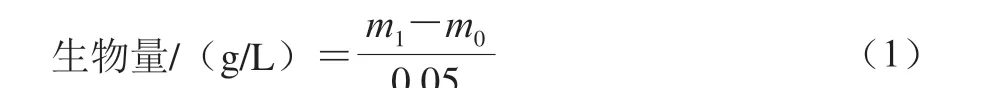
1.3.5.2 油脂产量的测定
采用酸热法提取微生物油脂并测定其含量:抽滤发酵液收集菌丝体,取0.1 g湿菌丝体加入600 µL的4 mol/L HCl溶液,涡旋振荡1 min后静置15 min,重复涡旋5 次。沸水浴30 min,期间涡旋振荡1 次,冰浴30 min,加入1.2 mL氯仿-甲醇(1∶1,/)溶液,混匀后8 000 r/min离心5 min,吸取氯仿层(最下层)转入2 mL离心管内,加入等体积的0.1%氯化钠溶液,振荡10 s,5 000 r/min离心2 min,吸取氯仿层转入一支已知质量的2 mL离心管中,在通风橱中挥发氯仿,收集油脂。油脂质量分数及油脂产量计算方法分别如式(2)、(3)所示。

1.3.5.3 发酵液残糖测定
采用SGD-IV型还原糖测定仪测定。
1.3.5.4 原始菌株与突变菌株菌丝球形态比较
将菌株接种于PDA平板28 ℃培养5~8 d,刮取孢子接种于种子培养液中,180 r/min、28 ℃振荡培养24 h即为发酵种子液,将种子液按10%的接种量接种在发酵培养基中,180 r/min、28 ℃振荡培养8 d,观察菌丝球形态特征。
1.3.5.5 原始菌株与突变菌株摇瓶发酵过程比较
采用与1.3.5.4节相同的发酵方法摇瓶培养12 d,从2 d开始每天取样测定菌株油脂质量分数、生物量以及油脂产量。
1.3.5.6 脂肪酸合成通路相关基因表达量检测
以培养3~7 d菌丝为材料,用Fungal RNA Kit总RNA提取试剂盒进行RNA提取,用PrimeScriptRT reagent Kit with gDNA Eraser试剂盒进行反转录实验。使用FastStart Universal SYBR Green Master进行real-time PCR。real-time PCR所用的引物见表1,选用18S RNA作为内参基因。使用Ct法(2)计算不同基因的相对表达量。

表1 本研究所用引物Table 1 Primers used in this study
1.4 数据处理
数据分析及图形绘制使用Origin 2019b软件处理。
2 结果与分析
2.1 产油脂菌株的筛选
2.1.1 初筛结果
从产油植物及其根系土壤样品中共分离、纯化到140 株真菌,经苏丹黑染色显微观察结果显示,有39 株菌的菌丝胞内呈现黑色油脂滴,推测这些菌株为产油菌,统计结果如表2所示。
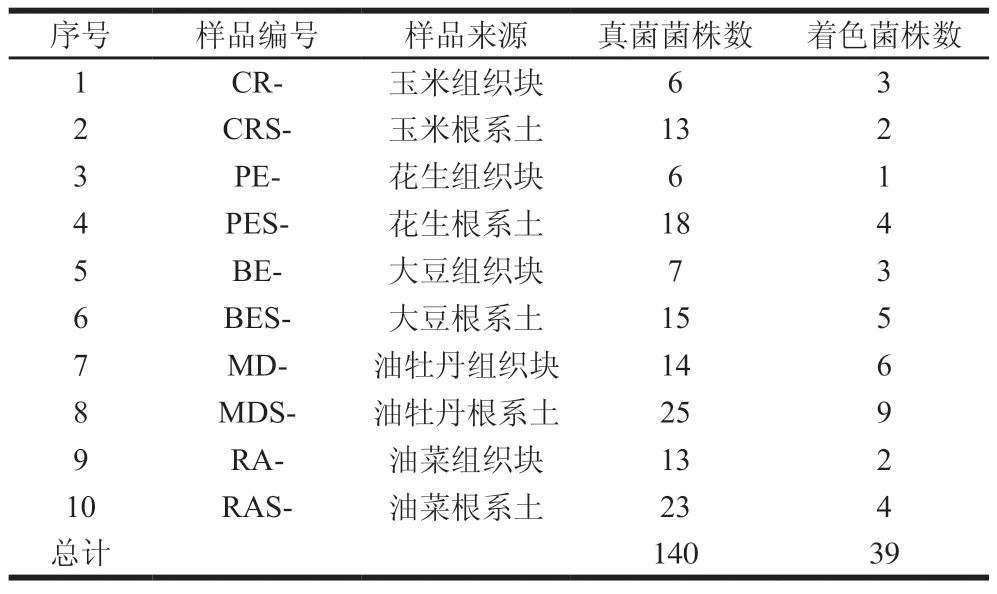
表2 平板初筛结果Table 2 Results of plate preliminary screening
2.1.2 复筛结果
将初步筛选获得的39 株产油菌,利用基础发酵培养基,依次进行摇瓶发酵复筛,分别检测发酵液残糖、生物量、油脂质量分数以及油脂产量,结果显示,有15 株菌的油脂产量大于1 g/L(表3),其中菌株PES-2、MD-3、MDS-1、BES-5的葡萄糖利用率较高,发酵液残糖量都在10%以下;菌株PES-2、MD-3、MDS-1、MDS-7、BES-2、RAS-1的生物量较高,均大于14 g/L;菌株PES-1、MD-3、MDS-1、MDS-8、BES-2的油脂质量分数均在20%以上;菌株MD-3、MDS-1、BES-2的油脂产量均在3 g/L以上。综合以上指标,MD-3菌株的发酵液残糖最低,生物量大于14 g/L,油脂质量分数及油脂产量最高,分别为29.36%和4.35 g/L,因此选择该菌株作为后续诱变育种的出发菌株。

表3 部分复筛结果Table 3 Results of partial secondary screening
2.1.3 MD-3的发酵产油曲线
为了探究菌株MD-3的最佳发酵产油培养时间,将该菌株接种于基础发酵培养基中,28 ℃振荡培养12 d,从2 d开始每天取样测定相关数据,结果如图2所示,菌株MD-3在第3天进入对数生长期,6~8 d是稳定期,之后进入细胞衰亡期。胞内油脂质量分数和产量均从第3天开始积累,之后逐步增加。第8天的菌株MD-3的油脂质量分数和油脂产量达到最大值,分别30.15%和4.67 g/L。

图2 菌株MD-3发酵曲线Fig.2 Fermentation curves of strain MD-3
2.2 菌种鉴定
2.2.1 形态学观察
将菌株MD-3接种于PDA平板上,28 ℃恒温培养5 d,菌落形态及显微形态如图3所示。菌落呈白色花瓣状,气生菌丝较短,有特殊腥味。初期产生无隔菌丝,菌丝内有油脂滴,后期产生有隔菌丝。孢囊梗大多从气生菌丝长出,囊领小或不明显,孢子囊为球形,直径9~13 μm,表面较为光滑,内含多个孢囊孢子。孢子呈椭圆形或圆形,大小为2~4 μm,生长后期孢子内形成油滴。苏丹黑-番红染色可以明显观察到红色菌丝内部的黑色油脂滴。
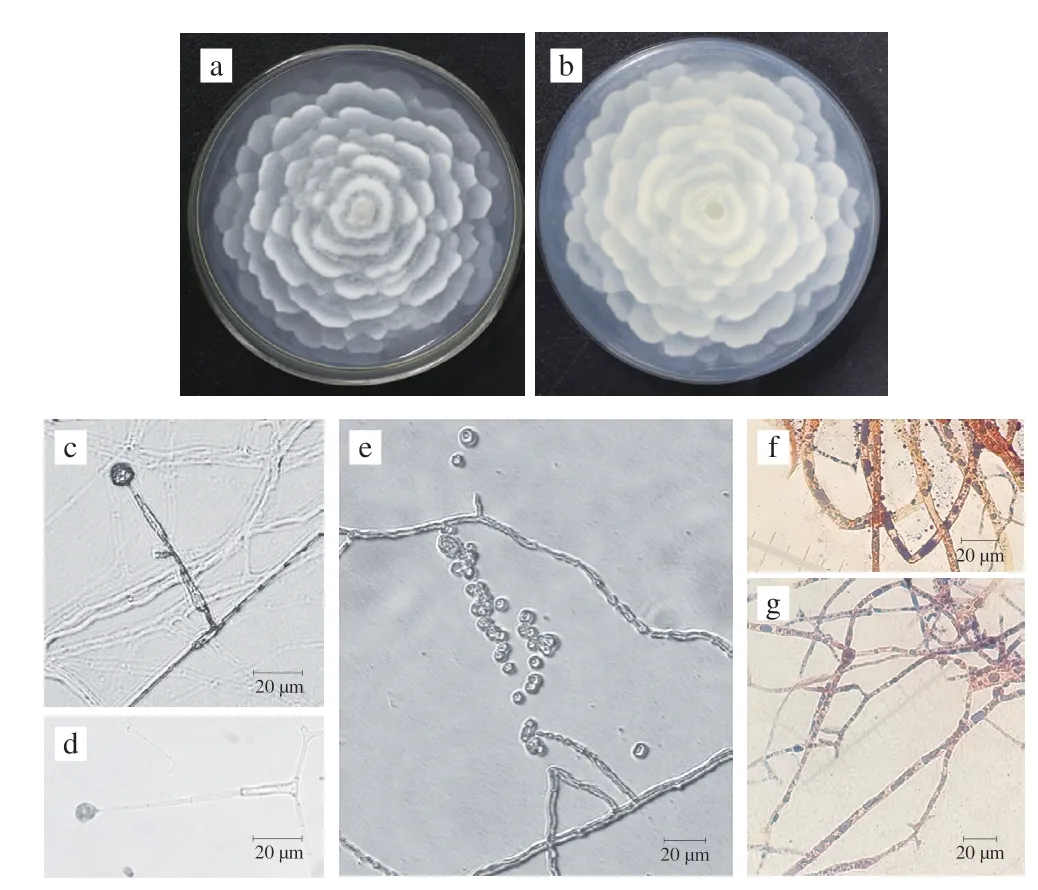
图3 菌株MD-3在PDA平板上的菌落形态及显微形态Fig.3 Colony morphology and micromorphology of strain MD-3 on PDA plate
2.2.2 分子鉴定
以MD-3菌株的gDNA为模板,分别扩增其ITS序列和LSU基因,获得了长度为586 bp的ITS序列(MZ150514)和728 bp的LSU(MZ150555)序列,经BLAST比对,该菌株的ITS序列与已报道的长孢被孢霉()对应序列(MT366027)相似性达100%,LSU序列(MH047197)相似性达99.73%。结合该菌株的形态学观察结果,推定该菌株为被孢霉属的长孢被孢霉。根据刘泽报道,挑选相关菌株的ITS和LSU序列,见表4。
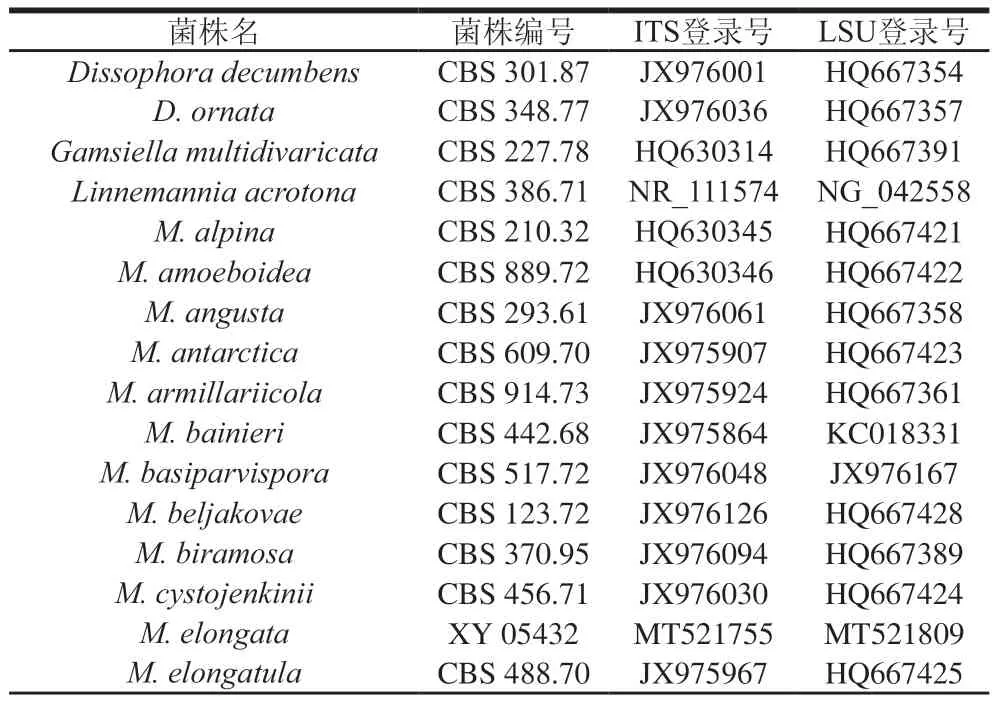
表4 构建进化树所用菌株ITS及LSU序列GenBank编号Table 4 GenBank number of ITS and LSU strains used to construct phylogenetic tree
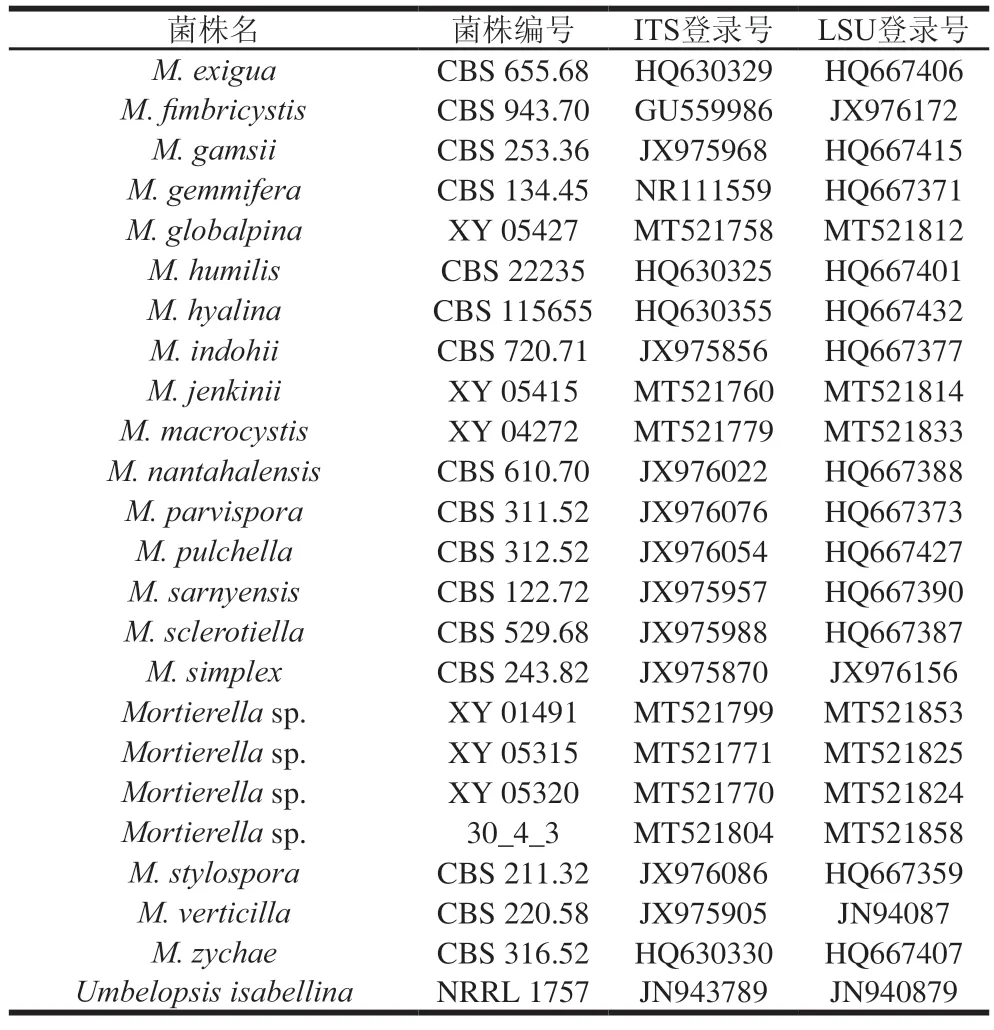
续表4
使用MEGA7.0软件以为外群构建基于ITS+LSU的系统发育树(图4),MD-3菌株与聚在同一分枝,经1 000 次Bootstrap检验同源性为100%。

图4 菌株MD-3基于ITSLSU序列的系统发育树Fig.4 Phylogenetic tree based on ITS and LSU sequences of strain MD-3
2.3 ARTP诱变结果
2.3.1 诱变处理时间的确定
为探究不同ARTP处理时间对菌株活性影响,分别设计不同处理时间梯度对MD-3菌株进行诱变处理,结果表明(图5),随着处理时间的延长,菌株MD-3的致死率逐步增高,60 s达到78%,100 s达100%。有研究表明,诱变致死率为70%~80%时,菌株正突变率较高。因此本研究选择诱变时间为60 s。
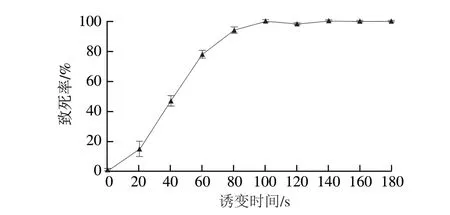
图5 长孢被孢霉ARTP诱变致死率曲线Fig.5 Death rate of M.elongata caused by ARTP
2.3.2 浅蓝菌素浓度的确定
浅蓝菌素是一种蓝色头孢霉()的代谢产物,它可以特异性地与FAS中的特定部位共价结合,形成羟基内酰胺环使该酶失活,而FAS在脂肪酸合成过程中有着关键作用,因此浅蓝菌素可以抑制生物体内脂肪酸的合成,从而抑制细胞的生长代谢。目前已有不少研究证明浅蓝菌素筛选高产油脂菌株可行。把诱变后的菌株接种到含有一定浓度浅蓝菌素平板上,只有FAS活性相对较高的菌株可以存活,且培养基上菌落越大表示菌株的FAS活性越强。将长孢被孢霉孢子悬液适当稀释后涂布于含有浅蓝菌素浓度分别为0、0.9、1.8、2.7 μmol/L的PDA培养皿上,28 ℃培养48 h,结果显示随着浅蓝菌素浓度的增加,菌株的生长速度逐渐减慢,且菌落数量明显减少,当浅蓝菌素浓度为1.8 μmol/L时,菌株的生长速度明显受到抑制,但菌落数目没有明显减少(图6c),有利于筛选工作的进行,因此本研究确定使用含有1.8 μmol/L浅蓝菌素培养基进行后续高产油菌的菌落筛选实验。
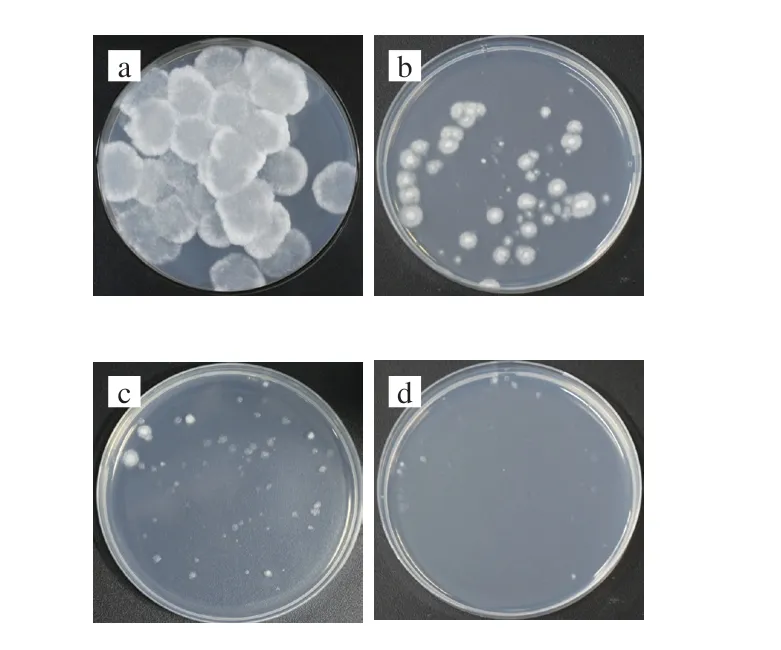
图6 长孢被孢霉在不同浓度浅蓝菌素平板上生长情况Fig.6 Growth of M.elongata on plates containing cerulenin at different concentrations
2.3.3 ARTP诱变结果
2.3.3.1 浅蓝菌素筛选结果
将ARTP处理后的突变菌株涂布在浓度为1.8 μmol/L浅蓝菌素平板上,28 ℃培养48 h,平板上长出大小不一的菌落(图7),挑选出50 株生长速度较快、菌落较大的菌株纯化培养,分别测定其油脂产量(图8),通过浅蓝菌素筛选性培养基,筛选到的菌株其油脂产量较原始菌株都有不同程度的提高。
图7 突变菌株在浅蓝菌素平板上的生长情况Fig.7 Growth of mutant strain on plate containing cerulenin
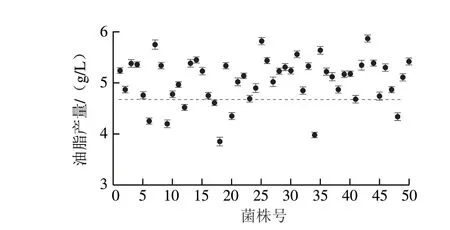
图8 浅蓝菌素筛选突变菌株的油脂产量Fig.8 Oil production of the mutant strain selected by cerulenin
2.3.3.2 多轮ARTP诱变结果
经过多轮ARTP诱变处理,共挑选出320 株突变菌株,经基础培养基摇瓶发酵培养,测定其生物量,挑选出生物量较高的株菌,进一步测定其油脂质量分数和油脂产量。经以上处理和筛选,初步获得10 株油脂质量分数和油脂产量较高的菌株,如图9所示。其中菌株MD-3-2、MD-3-5、MD-3-7、MD-3-9的油脂质量分数依次为41.40%、41.13%、41.69%、43.42%,其油脂产量依次为6.57、6.68、6.62、6.89 g/L。因此挑选上述4 株菌,以油脂产量为评价标准,考察其遗传稳定性。如图10所示,菌株MD-3-9虽然初始油脂产量最高,但是后续传代发酵培养过程中油脂产量下降明显,传代培养过程中偶有生长停滞现象发生,说明突变极大影响了该菌株正常的生理代谢,导致菌株生长极不稳定。同时发现菌株MD-3-2和MD-3-5的油脂产量也出现不同程度的下降,说明突变也影响了这两株菌的正常生理代谢。菌株MD-3-7始终维持较高的、稳定的油脂产量水平,生长没有受到突变处理的影响,呈现遗传稳定的特性,因此选择MD-3-7菌株进行后续研究。

图9 部分ARTP突变菌株油脂质量分数及油脂产量比较Fig.9 Comparison of oil contents and yields of some ARTP-induced mutant strains
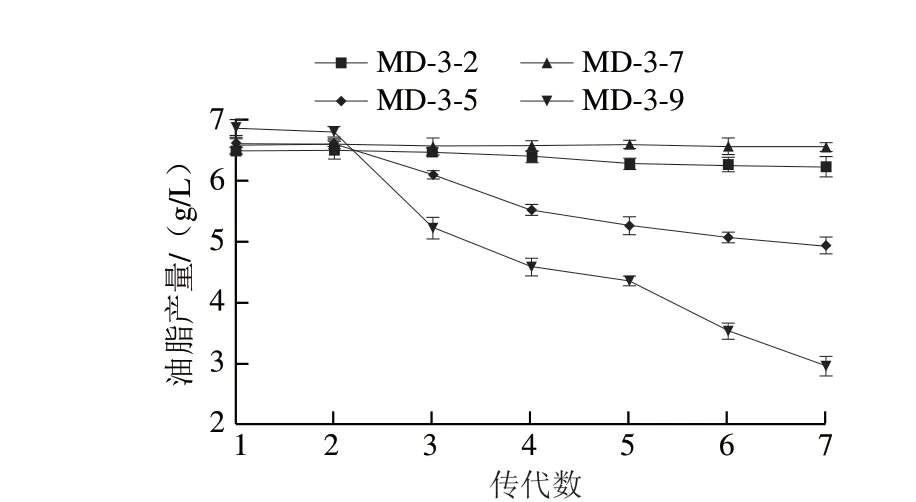
图10 突变菌株遗传稳定性比较Fig.10 Comparison of genetic stability of mutant strains
2.4 突变菌株生理特性比较
2.4.1 形态学观察
突变菌株与原始菌株菌落形态及显微形态差异如图11所示。将突变菌株和原始菌株分别接种于PDA平板上28 ℃培养5 d,可以观察到菌落都呈花瓣状展开,突变菌株的气生菌丝更为茂盛,突变菌株生长速度稍快于出发菌株,显微结构总体差异不大,可见突变菌株部分菌丝膨大程度高于出发菌株(图11e、f)。该菌株的孢子囊大多从气生菌丝上生长出来,因此突变菌株的产孢能力强于原始菌株。
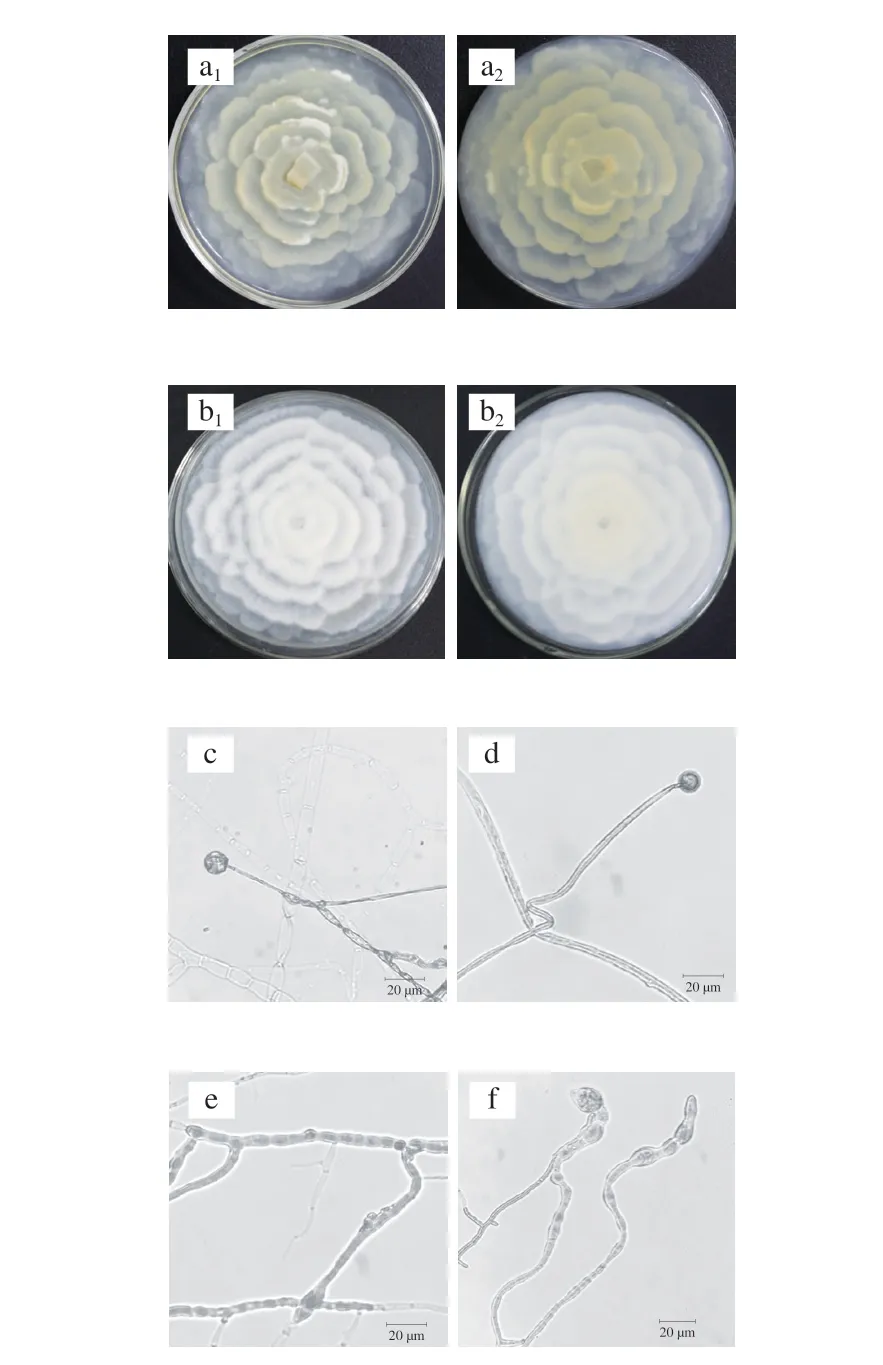
图11 突变菌株与原始菌株菌落形态及显微形态差异Fig.11 Differences in colony morphology and micromorphology between mutant and original strains
2.4.2 发酵菌丝球差异
据文献报道,真菌菌丝球的形态变化会影响其发酵过程中的传质效果,使营养物质和氧气等底物的吸收发生变化,导致菌株代谢途径发生改变,从而对发酵产物的积累产生较大的影响。将种子液接种到发酵培养基中,28 ℃、180 r/min恒温振荡培养8 d,可观察到突变菌株与原始菌株的菌丝球形态发生了改变,出发菌株的菌丝球直径约1.3 cm,菌丝为白色,呈粗纤维丝状,菌丝较长,如图12a所示;相较于出发菌株,突变菌株的菌丝球直径维持在1.1 cm左右,菌丝颜色变深,大多呈现绒毛状,菌丝较短较为粗壮,菌丝密度增加,如图12b所示。绒毛状菌丝能更好地传递营养物质,有利于菌丝中油脂的积累,因此推测菌丝球形态的改变与产油能力提高正相关。
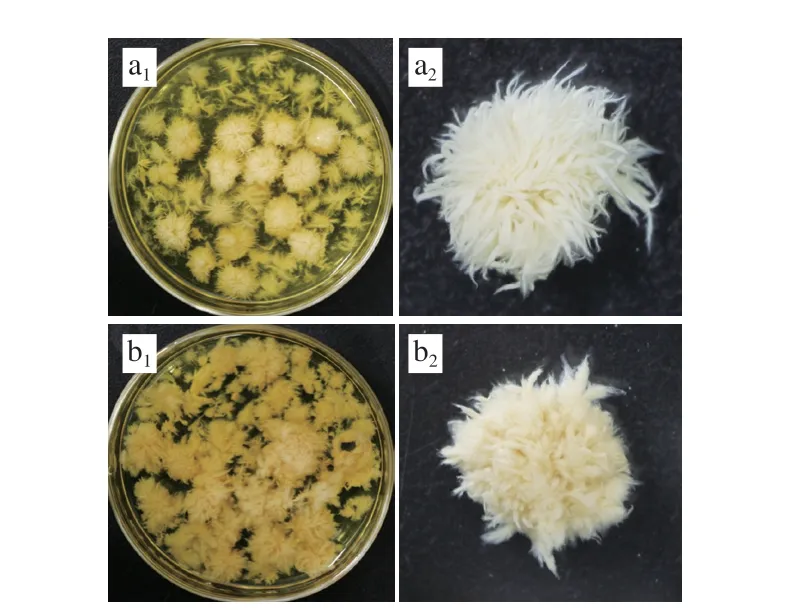
图12 原始菌株(a)与突变菌株(b)发酵过程中菌丝球形态Fig.12 Morphological differences in mycelial pellets between original strain (a) and mutant strains (b) during fermentation
2.4.3 摇瓶发酵过程比较
将出发菌株与突变菌株进行摇瓶发酵,检测其油脂产量的变化,发现两种菌油脂产量的走势基本相同,在3~6 d菌株油脂产量增长迅速,到第8天达到最大值,此后逐步衰减,在这个过程中,突变菌株油脂产量始终高于原始菌株(图13)。比较两株菌的生物量动态变化结果显示,两株菌生物量变化差异不明显,3~4 d增长最为迅速,符合对数生长期的生长特点,到第8天左右达到最大值,此后进入衰亡期菌丝逐步自行溶解。突变菌株的油脂质量分数一直高于原始菌株,说明诱变改变了菌株的油脂合成能力,致使其油脂产量提高。
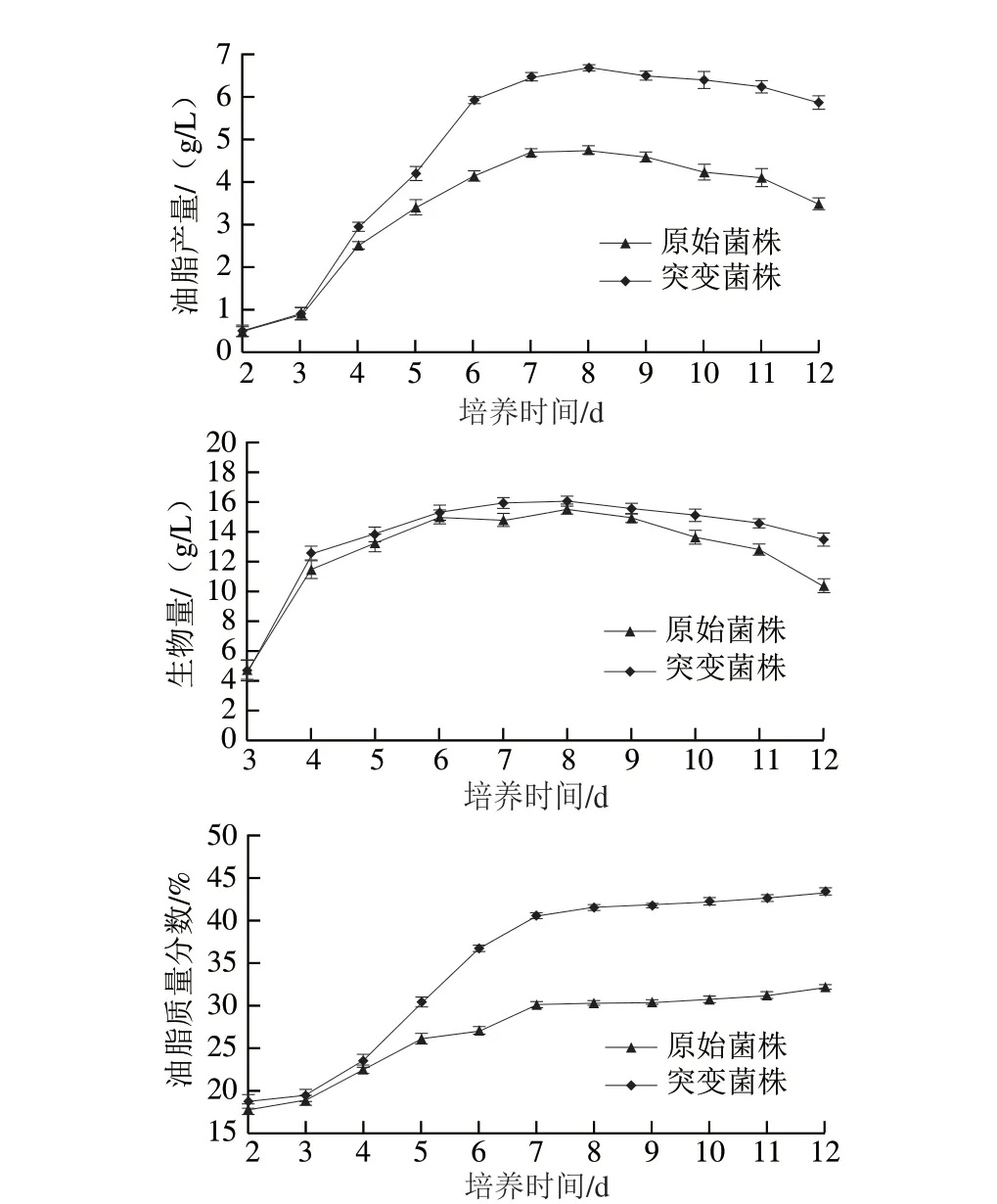
图13 原始菌株与突变菌株摇瓶发酵过程比较Fig.13 Comparison of shake flask fermentation process between original and mutant strains
2.4.4 脂肪酸合成通路关键基因表达量检测
ACC是一种具生物素酶I类型的催化酶,在脂肪酸合成反应中参与第1步反应,主要作用是催化乙酰辅酶A生成丙二酰辅酶A,是脂肪酸合成过程中的限速酶。FAS是脂肪酸合成反应中的关键酶。有研究表明过表达ACC等相关脂肪酸合成通路基因可以提高油脂产量。为探究突变菌株中相关基因表达量的变化,本研究根据文献报道高山被孢霉中和基因研究结果,采用同源比对法,结合长孢被孢霉全基因组数据库(GCA_001651415.1),获得和编码基因序列,设计real-time PCR引物,进行表达量的检测,如图14所示,在突变菌株中基因表达量上调到9.25 倍,基因表达量上调到4.37 倍。因此推测突变菌株中脂肪酸合成通路相关基因的上调表达,与其油脂质量分数和产量的提高正相关。
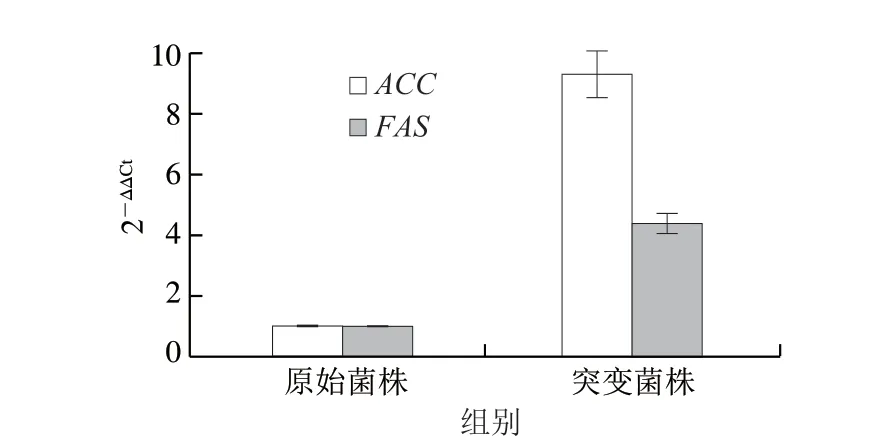
图14 野生型和突变型菌株ACC和FAS的相对基因表达水平Fig.14 Relative gene expression levels of acetyl CoA carboxylase and fatty acid synthase in wild-type and mutant strains
3 讨论
当前运用于工业化生产微生物油脂的菌株种类较为单一,因此选育出更多生长状况良好的高产油脂菌株具有重要的应用意义。本研究从产油植物上分离得到1 株产油脂丝状真菌,经分子鉴定和形态观察,确定为长孢被孢霉,初步检测其油脂产量为4.67 g/L。为进一步提高菌株油脂产量,本研究运用ARTP诱变技术,基于浅蓝菌素抗性筛选法,快速筛选到1 株遗传性能稳定的突变菌株,经自然摇瓶发酵测得其油脂产量为6.62 g/L,菌株油脂质量分数为41.69%,相较于出发菌株分别提升了41.76%、38.27%。张鹏等分离鉴定了1 株可直接利用预处理后的稻草秸秆进行发酵生产油脂长孢被孢霉PFY菌株,在适宜条件下发酵后油脂得率为8.15%。赖睛等进一步采用限氮补料发酵的方法,将该菌株的油脂的产量提高了521.74 mg/L。Nisha等研究了发酵条件对高山被孢霉()CBS 528.72产油能力的影响,在最优条件下,菌株的油脂质量分数为41.6%,油脂产量为2.83 g/L。张可可等报道了1 株产油脂的近玫色锁掷孢酵母(),其油脂产量为3.3 g/L。本实验选育的高产油脂突变菌株较同类菌株具有油脂产量高的特点。突变菌株的油脂质量分数提升从而使其总体油脂产量提升,进一步探究菌株油脂质量分数提升原因,发现突变菌株ACC和FAS的表达水平明显高于原始菌株,因此初步推测ACC和FAS的表达水平对该菌株油脂质量分数和产量正相关。本研究主要运用基础发酵培养基进行产油脂的发酵培养,后续还需要通过优化培养基成分以及发酵培养条件进一步提升油脂产量。
