应用拉曼光谱对比分析德式乳杆菌保加利亚亚种ND02及其VBNC态细胞成分
2022-06-02包秋华马学波王丽娜张雨虹代利霞
包秋华,马学波,任 艳,王丽娜,张雨虹,代利霞
(1.内蒙古农业大学 乳品生物技术与工程教育部重点实验室,农业农村部奶制品加工重点实验室,内蒙古 呼和浩特 010018;2.内蒙古科技大学生命科学与技术学院,内蒙古 包头 014016)
一些细菌在不利生长环境下可以进入活的但不可培养(viable but non-culturable,VBNC)态,这是细菌处于不良环境下的一种生存策略,处于该状态下的细菌不能在常规培养基上生长,因此利用常规平板计数方法检测容易造成假阴性结果。VBNC态的概念首次由徐怀恕于1982年提出,发现在河口和海洋环境中的大肠杆菌()和霍乱弧菌()存在VBNC态。VBNC态细菌虽然不能在普通培养基中生长,但依然可以保持基本的代谢活性和基因表达。迄今为止,已有超过100 种细菌和真菌被证实可进入VBNC态,其中细菌包括短乳杆菌()、大肠杆菌、副溶血弧菌()、单核细胞性李斯特菌()、德氏乳杆菌保加利亚亚种(subsp)ND02和粪肠球菌()等,真菌有酿酒酵母()、星状假丝酵母()等。导致细菌进入VBNC态的环境包括低pH值、渗透压、辐射、低温、寡营养和海水等。
自然界中99%以上的微生物因各种环境胁迫的驱使而处于VBNC状态,导致它们不能被充分研究和利用,对细菌进入VBNC态机理的研究被广泛关注。VBNC态细胞和活的可培养细胞之间存在生理和分子水平的差异,包括细胞壁和细胞膜组成、基因表达、细胞形态、毒力因子、代谢特性、黏附特性以及物理和化学抗性等。例如,大肠杆菌VBNC态细胞与正常细胞相比尺寸会减小。VBNC态细胞仍具有ATP消耗和低水平的代谢活动。到目前为止,已发现一些调节因子与VBNC态细胞的诱导和复苏有关,如过氧化氢酶KatG、LysR型转录调节因子OxyR、应激调节因子RpoS、烷基氢过氧化物还原酶亚基C(ahpC1和ahpC2)和复苏促进因子Rpfs等;此外,外膜蛋白EnvZ/OmpR也被发现与VBNC态的形成有关。
工业化生产的乳酸菌也被证明存在VBNC态。乳酸菌是生产发酵乳、饲料等常用菌种,其中德氏乳杆菌保加利亚亚种是生产发酵乳常用的商业发酵菌种之一。菌株在生产、运输、贮存及应用过程中会经历低温、低pH值、真空、冷冻、干燥等不良生长环境,这些不利条件不但影响菌株活性,还影响其发酵乳制品的优良特性,进而影响产品的风味、质地以及稳定性。
细胞是细菌活动和生物体形态结构的基本单位,环境压力导致的细胞异质性表示不同生理状态的细胞共存。单细胞拉曼光谱(single-cell Raman spectrometry,SCRS)是近年来出现的单细胞检测技术之一,是以激光作激发光源激发单色光在分子键上形成非弹性散射,根据细胞中特征性化学键的振动频率提供全面固有分子谱的检测技术。将拉曼散射效应与傅里叶变换等技术手段结合获取分子的拉曼光谱信息,再通过比对拉曼谱线的数目、位移大小、光谱强度等信息能够了解待测组分的分子构象及其所处环境。SCRS具有长带宽、窄峰宽和高分辨率的特点,已被用于细菌治疗中监测群体水平或单细胞水平上细菌表型的变化,其中大部分是细胞内大分子物质含量的变化。它富含生物分子的结构信息,能有效区分不同分子活性物质,包括核酸、蛋白质、碳水化合物和脂质等大分子生物键,从而识别不同细胞类型和生理状态。
鉴于目前对VBNC菌的研究大多集中在诱导条件、检测方法、复苏环境等方面,缺乏对该状态下细菌活性特征的深入分析。本实验以实验室筛选的一株具有优良发酵特性的酸乳发酵剂——德氏乳杆菌保加利亚亚种ND02为研究对象,将其在低温、低pH值下进行VBNC态诱导,采用单细胞拉曼光谱检测技术分析德氏乳杆菌保加利亚亚种ND02 VBNC态与正常细胞内部大分子化合物变化。
1 材料与方法
1.1 材料与试剂
德氏乳杆菌保加利亚亚种ND02由内蒙古农业大学乳品生物技术与工程教育部重点实验室乳酸菌菌种库保藏和提供;MRS液体、固体培养基 英国Oxoid公司;LIVE/DEADBacLight™ Bacterial Viability Kit(L7102)美国Molecular Probes公司。
1.2 仪器与设备
DM4000B正置荧光显微镜 德国Lecia公司;5810R高速低温离心机 德国Eppendorf公司;拉曼共聚焦显微镜系统 英国Horiba公司;SU8010冷场扫描电子显微镜 日本日立公司。
1.3 方法
1.3.1 乳酸菌VBNC态的诱导和形态观察
将德氏乳杆菌保加利亚亚种ND02接种于MRS液体培养基中,在37 ℃恒温静置活化培养,传代培养至第3代,镜检为纯的菌株后,将处于对数生长期的ND02按王亚利等的方法于4 ℃在MRS液体培养基中进行VBNC态诱导。诱导过程中定期通过平板计数法和荧光显微镜(使用LIVE/DEADBacLight™ Bacterial Viability Kit做染色处理)检测细胞活性,当平板计数结果为零而荧光显微镜下仍有显绿色荧光的活细胞(显红色荧光的细胞为死亡态)存在时,则认定此时的菌株ND02已完全进入VBNC态。采用扫描电子显微镜观察表观形态并拍照。
1.3.2 德氏乳杆菌保加利亚亚种ND02的拉曼信号采集
取正常、VBNC态德氏乳杆菌保加利亚亚种ND02各3 个平行样本,室温5 200 r/min离心3 min收集菌体,然后用ddHO轻轻吹打,洗涤3 次后将其适当稀释,使细胞均匀分散于视野中,以便进行SCRS的采集。然后吸取1.5 µL细胞稀释悬液于CaF平板上,风干后,立即采用100 mW×532 nm激光的拉曼系统进行信号采集,照射于细胞上的激光光强控制为约25 mW,每个图谱采集10 s,每个平行样本取20 个细胞进行图谱采集。
1.3.3 拉曼图谱数据预处理
采用LabSpec 5软件进行拉曼数据预处理,采用(二次函数)Polynom拟合Baseline的方法,参数设为0和1,尽量选择低阶参数以保证拉曼图谱的原始形状基本不改变,且尽量不引入更多的人为因素。由于测量过程中,激光点与细胞距离的差异会导致细胞信号的差异,直接影响信号的收集,使两个细胞拉曼信号的异同难以明确,因此,假定一定大小激光点内测得的总物质量一定、且激光点小于细胞大小,在此前提下对经Baseline处理后的数据进行面积归一化处理。经过初步处理的拉曼图谱采用均值标准偏差(standard deviation of the means,SDM)进行质量检测,SDM=mean(SD)/SD(mean),SDM值越小表明数据越可靠。同时,选取600~1 800 cm范围生化指纹峰用于后续统计分析,滤去噪声,提取拉曼频带包含的有用信息。
1.4 数据处理
将预处理的数据与主成分分析(principle component analysis,PCA)法结合,PCA中PC个数的选择以能够解释数据大于70%的变异为标准。
2 结果与分析
2.1 德氏乳杆菌保加利亚亚种ND02正常与VBNC态细胞形态比较
由图1可知,德氏乳杆菌保加利亚亚种ND02 VBNC态和正常细胞形态差异明显,VBNC态细胞表面褶皱,长度缩短,但细胞结构仍然完整。该结果与已报道的大肠杆菌VBNC态细胞表现出细胞矮化或尺寸减小的现象类似。
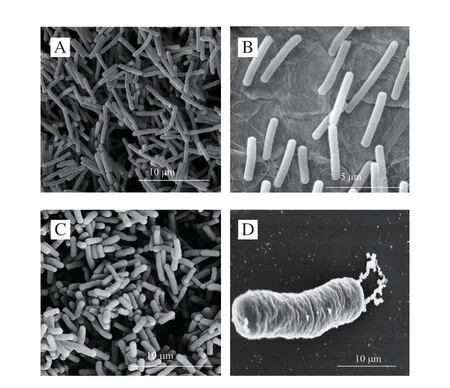
图1 德氏乳杆菌保加利亚亚种ND02的正常和VBNC态表面形态Fig.1 Surface morphology of the normal and VBNC cells of L.delbrueckii subsp.bulgaricus ND02
2.2 德氏乳杆菌保加利亚亚种ND02拉曼谱图分析
如图2所示,两种状态细胞的拉曼峰强度明显不同,表明在不同状态下细胞内各物质间差异较大。
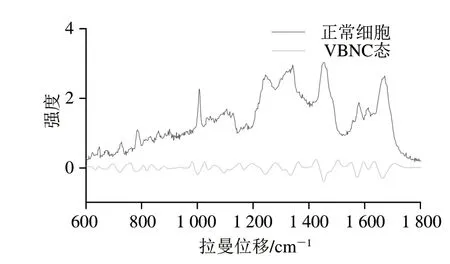
图2 不同状态下德氏乳杆菌保加利亚亚种ND02平均拉曼光谱图Fig.2 Mean Raman spectra of L.delbrueckii subsp.bulgaricuss ND02 under different conditions
进一步对拉曼光谱进行PCA,由图3可知,德氏乳杆菌保加利亚亚种ND02正常细胞和VBNC态细胞之间几乎无重叠,表明两种状态下细菌细胞可以被明显区分。PC1和PC2的贡献率分别为72.12%与16.32%,PC1与PC2可解释约88%的变异信息。两群体分离差表明,在不同生长阶段异质细胞群体差异显著,通过SCRS可以很好地识别和区分正常和VBNC态细胞。
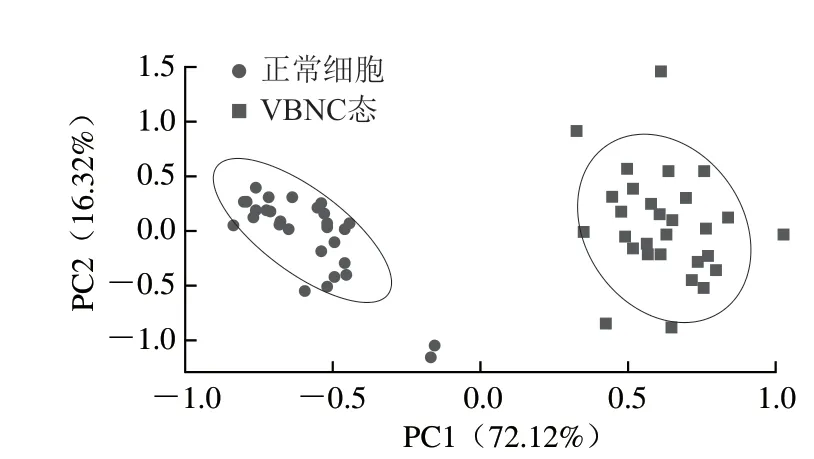
图3 不同状态下德氏乳杆菌保加利亚亚种ND02的拉曼光谱PCAFig.3 PCA plot of Raman spectra of L.delbrueckii subsp.bulgaricus ND02 under different conditions
载荷值是PC分值与原始变量间的相关系数,可以权衡不同变量在PC可变性中所占权重。如图4所示,PC1载荷绝对值大于0.05所对应的峰具有主要贡献,表明拉曼峰具有随时间变化的最大绝对方差,并且对PCA中因子的分离贡献重大。PC1占数据差异的70%以上,通过对PC1载荷值与相关特征峰强度(特征峰强度反映细胞内某些物质的变化)进行相关性分析,可以得到不同状态下ND02细胞内相关生物大分子的合成特点。由图4可知,影响PC1贡献率的拉曼峰主要为1 673、1 650、1 459、1 030、1 005 cm等处的12 个峰。这些峰可作为区分ND02细胞VBNC态和正常态代谢状态的参数。
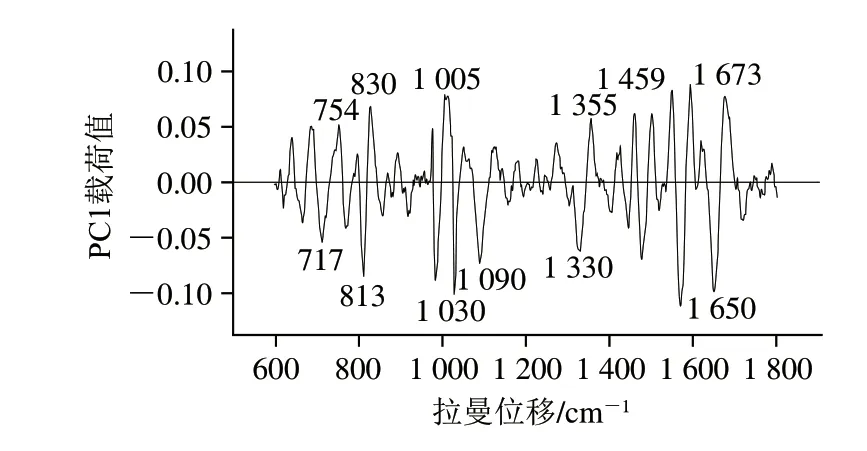
图4 PC1载荷值Fig.4 PC1 Loading values
2.3 德氏乳杆菌保加利亚亚种ND02 VBNC态与正常SCRS信号峰归属对比
SCRS为所有拉曼光谱成分提供了更详细的光谱和细胞状态信息,包括细胞生长过程中核酸、蛋白质和脂质变化,是一种综合分析的方法。参考文献[31]得到德氏乳杆菌保加利亚亚种ND02 VBNC态与正常细胞的主要SCRS信号峰归属。如表1所示,12 个特征峰中,830、1 355、1 459、717、813、1 090、1 330 cm处的峰与核酸和脂类相关,754、1 005、1 673、1 030、1 650 cm处的峰与蛋白相关。结合表1与图4的PC1载荷值,对比发现ND02 VBNC态和正常细胞间6 个峰强度升高、6 个峰强度下降。其中蛋白类1 005 cm峰强度升高,蛋白质类1 030 cm和1 650 cm峰强度下降;核酸类1 355 cm特征峰强度升高;核酸类813 cm和1 330 cm特征峰强度下降;构成细胞膜重要组分磷脂及类脂的相关物质(717、1 330 cm)含量显著下降;维持细胞内结构蛋白合成的酰胺类物质(酰胺I)含量有上升(1 673 cm)也有下降(1 030、1 650 cm)。这些均是德氏乳杆菌保加利亚亚种ND02在4 ℃、低pH值环境压力下应激反应的结果。

表1 德氏乳杆菌保加利亚亚种ND02 VBNC态与正常细胞的主要SCRS信号峰归属Table 1 Assignment of major SCRS signal peaks of L.delbrueckii subsp.bulgaricus ND02 in VBNC and normal states
王亚利通过气相色谱对比分析该菌在4 ℃、低pH值下subsp.ND02 VBNC态和正常细胞的膜脂肪酸含量,结果发现VBNC态细胞与正常细胞相比,不饱和脂肪酸含量由(37.97±0.42)%增加到(53.68±0.15)%。推测subsp.ND02细胞可能通过改变膜脂肪酸的成分和含量、增加不饱和脂肪酸/饱和脂肪酸比值改变细胞膜流动性,从而更好地适应低温、低pH值环境,这与本实验拉曼光谱的脂类分析结果一致。细菌在逆境条件下发生复杂的代谢活动,包括转录、翻译、能量依赖性和酶活性等。低温会降低细胞内蛋白质尤其是酶的活性,如降低某些蛋白的分泌、部分蛋白质折叠缓慢或效率降低、降低酶进行转录或翻译的活性。低温环境使细胞RNA聚合酶活性降低,还可影响核酸的结构和功能;冷胁迫还会促进核糖核酸和脱氧核糖核酸二级结构的稳定,导致核糖核酸翻译和转录效率降低。本实验拉曼光谱的结果也与王亚利等研究中VBNC态菌株细胞通过减少生命活动,降低能量代谢以及减少营养物质运输、大分子合成以及呼吸速率的结论一致。本研究结果证实了拉曼光谱可以检测细菌细胞中各物质水平的变化,提供特定的脱氧核酸、核糖核酸、蛋白质标志,这些物质在细菌细胞中的水平高度依赖细胞的代谢状态,同时也能够反映细胞的实时状态。
3 结论
通过SCRS技术在单细胞水平对德氏乳杆菌保加利亚亚种ND02 VBNC态和正常细胞内成分进行检测,并结合PCA多元统计方法进行数据分析,结果表明ND02 VBNC态和正常细胞的拉曼光谱存在明显差异,主要集中在1 673、1 650、1 459、1 030、1 005 cm等处的12 个峰,这些峰主要归属于核酸、脂类和蛋白质类。通过扫描电子显微镜观察细菌表征形态变化发现,德氏乳杆菌保加利亚亚种ND02的VBNC态与正常细胞相比变短、变粗,且细胞表面发生褶皱。因此推论细菌在由正常细胞进入VBNC态的过程中可能通过调整遗传物质、脂类和蛋白质适应不利条件的影响。目前在单细胞水平研究细胞的应激反应方法非常有限,细胞VBNC的机理研究需要多方面技术支持,本研究所用SCRS是一种非标记、不依赖于群体细胞的方法。研究结果证明了SCRS检测技术应用于乳酸菌VBNC态细胞成分的分析是可行的,该技术在细菌应激、菌株鉴定、确定菌种来源以及选育优良菌株等理论研究及实践应用中具有广阔的应用前景。
猜你喜欢
——和田盘羊
