何首乌治疗雄激素性脱发的分子机制:基于生物信息学和分子对接方法
2022-06-01陈东宇杨晓雨王红心樊文龙何玉清
陈东宇, 杨晓雨, 王红心, 樊文龙, 何玉清
1.广东医科大学公共卫生学院流行病与卫生统计学系,广东 东莞 523808;2.东莞市寮步医院皮肤科,广东 东莞 523400
2019年国家卫生健康委员会数据显示中国脱发患者患病率为19.9%,其中男性约1.63亿,女性约8 800万,并且呈现出年轻化趋势[1]。雄激素性脱发是临床上最常见的脱发类型,特征表现是头发密度的弥散性减少和毛囊进行性微型化[2]。脱发患者常患有心理焦虑和社交恐惧症,尤其是女性和发病年龄较低的患者,其抑郁或焦虑等精神障碍的发生率显著增加[3-4]。非那雄胺和米诺地尔已被美国食品和药物管理局批准为治疗脱发的主要药物[5]。然而,在临床实际使用中并未显示出令人满意的结果。此外,富血小板血浆和低能量激光治疗效果似乎只是局部和暂时有效,还存在着未能从根本上纠正毛囊微型化以及患者总体满意度不高等问题[6-7]。
中医对于脱发的认识和诊治已有悠久的历史,因其安全性较高、疗效确切和不良反应少等优势,一直被广泛接受和临床应用。一项系统检索中、英、韩三国数据库对治疗脱发的中药组合、中草药的使用频率和特点的分析研究表明,在使用的312种内用中草药中,以何首乌的使用次数最多[8]。在国家药品监督管理局公布的国产中药育发类化妆品中,中药涉及154种,其中何首乌的使用频次(257次)仅次于侧柏叶[9]。何首乌为蓼科植物何首乌的块根,因具有乌发、镇静、滋养血液、增强肌肉和骨骼、滋补肝肾的功效而倍受关注[10]。动物实验表明何首乌可以抑制5α还原酶活性,其抑制作用随着用量增加而增强[11]。何首乌的毛发生长促进作用很可能是通过介导成纤维细胞生长因子7、音猬因子(sonic hedgehog,Shh)、胰岛素样生长因子、肝细胞生长因子和β-连环蛋白(β-catenin)等因子的表达来实现。局部应用何首乌可通过上调β-catenin和Shh表达,使毛囊数量、大小增加,诱导毛囊的生长期促进毛发生长[12-13]。何首乌作为最常用于治疗脱发的中草药,其促发作用的研究还只停留在动物实验阶段,关于其在雄激素性脱发发生发展中作用机制的研究很少。因此,本研究利用生物信息学、网络药理学和分子对接等手段,鉴定何首乌中与雄激素性脱发作用相关的有效成分,并探讨生发过程的关键靶点。
1 资料与方法
1.1 有效成分-靶点互作网络的构建
通过中医药分子机制生物信息学数据库(BATMAN-TCM,http://bionet.ncpsb.org/batman-tcm/)得到何首乌有效成分及对应的作用靶基因(分数阈值≥20)。同时在GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)、GeneCards数据库(https://www.genecards.org/)、OMIM数据库(https://omim.org/)、DrugBank数据库(https://www.drugbank.ca/)和TTD数据库(http://db.idrblab.net/ttd/)检索雄激素性脱发相关基因。检索词为“androgenetic alopecia”。然后将有效成分对应的靶基因与疾病相关基因取交集,用获得的交集基因构建何首乌有效成分-靶点互作网络。
1.2 蛋白互作网络及其核心子网络的筛选
将交集基因导入STRING在线数据库,设定最低相互作用阈值为0.900(最高置信度)并去除游离蛋白,并通过Cytoscape 3.8.2中的CytoNCA工具计算节点度中心性(degree centrality,DC)、中介中心性(betweenness centrality,BC)、接近中心性(closeness centrality,CC)、特征向量中心性(eigenvector centrality,EC)、基于局部平均连接度方法(local average connectivity-based method,LAC)和网络中心性(network centrality,NC)等网络的拓扑学参数;以大于等于上述各参数中位值为标准依次进行过滤。使用过滤后的基因构建次级子网络,再次进行过滤以获取最终的核心子网络。此外,我们利用CytoHubba插件基于最大团中心性(MCC)分析该核心子网络,选取连接度最高的前10个基因进行后续分子对接分析。
1.3 富集分析
利用R软件中的clusterprofile包对核心子网络中的基因进行基因本体论(GO)和京都基因与基因组百科全书(KEGG)通路分析。通过CytoscapeMCODE算法对核心子网络进行蛋白质紧密度识别和模块划分并进行功能富集,分析每个模块显著的富集项。
1.4 分子对接分析
对核心子网络中最重要的10个基因进行分子对接分析。在Uniprot数据库(https://www.uniprot.org/)中搜索所选基因编码的受体蛋白,以及在PDB数据库(https://www.rcsb.org/pdb/)中下载蛋白质的3D结构。从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载分子配体的2D结构。ChemBio 3D软件用于通过最小化能量来计算和输出3D结构。采用PyMOL 2.5软件对受体蛋白进行脱水,采用AutoDock Tools软件进行蛋白质的氢化。受体蛋白对接位点的参数设置为包括小分子配体结合的活性口袋位点。最后,Autodock Vina用于将受体蛋白与小分子配体对接。将结合能<-9 kcal/mol的对接结果进行可视化。
2 结果
2.1 有效成分和潜在靶点的筛选
使用BATMAN-TCM数据库,得到何首乌的7个关键有效成分:扁蓄苷、大黄酚、奎硫醇、大黄素甲醚、单甲醚、大黄酸和大黄素。共获得16 452个药物靶基因。此外,分别从Genecards、OMIM、TTD和DrugBank数据库中获得了1 103、11、14和11个与雄激素性脱发相关的基因。对从GEO检索到的GSE84839数据集进行标准化,按照|Log2FoldChange|≥2和校正后P值<0.05的条件筛选,共得到884个差异表达基因,并绘制热图(图1A)和火山图(图1B)进行可视化。去除重复并对上述数据库取并集,总共获得1 969个疾病基因(图1C)。最后,将药物靶基因和疾病相关基因取交集,最终获得1 357个共同靶基因(图1D)。

图1 何首乌有效成分和疾病潜在靶点的筛选 1A:GSE84839热图;1B:GSE84839火山图;1C:通过结合来自5个数据库的所有结果来识别雄激素性脱发的相关基因;1D:药物靶基因和疾病相关基因的交集Figure 1 Screening of effective ingredients of polygonum multiflorum and underlying disease targets. 1A: Heat map of GSE84839 dataset; 1B: Volcano plot of GSE84839 dataset; 1C: Venn plot of disease targets among Genecards, OMIM, TTD, DrugBank and GSE84839 dataset; 1D: Venn plot of effective ingredients of polygonum multiflorum and underlying disease targets of androgenic alopecia.
2.2 蛋白互作网络及其核心子网络的筛选
将共同的靶点基因提交到STRING平台,按照设定参数生成蛋白互作网络。将结果导入到Cytoscape获得初级蛋白互作网络;经CytoNCA插件计算其拓扑学参数并第一次过滤得到一个包括294个节点和5 810条边的次级子网络,其BC、CC、DC、EC、LAC和NC的中位值分别为281.91743515、0.024403565、11、0.008760369、5.6和7;经再次过滤得到一个包括67个节点和1 761条边的核心子网络,其BC、CC、DC、EC、LAC和NC的中位值分别为114.47539055、0.453560372、25、0.03552299、11.68825911和13.888418445。利用CytoHubba插件得到连接度最高的10个基因:SOS1、PIK3CA、PIK3R1、HRAS、PIK3CB、KRAS、NRAS、LCK、RHOA和EGFR(图2)。

图2 基于MCC筛选核心子网络连接度最高的前10个基因Figure 2 Screening the top 10 genes with the highest connectivity of core sub-network based on MCC.
2.3 富集分析
对得到的核心子网络进行功能富集分析,其中GO分析共富集到2 209条具有统计学意义的条目(图3A),例如:蛋白丝氨酸/苏氨酸激酶活性的正调控、MAP激酶活性的调节、MAP激酶活性的正调控、细胞粘附的正调控和细胞间粘附的调节等。KEGG富集得到160条具有统计学意义的条目,可视化与雄激素性脱发致病过程最相关的16条结果(图3B):趋化因子信号通路、PI3K-Akt信号通路、JAK-STAT信号通路、Ras信号通路、FoxO信号通路、血管内皮生长因子信号通路、细胞衰老、MAPK信号通路、雌激素信号通路、细胞凋亡、寿命调节途径、自噬-动物、NF-kappaB信号通路、TGF-β信号通路、细胞周期和Wnt信号通路。将MCODE算法运用到核心子网络中,共得到3个MCODE网络。其中,MCODE1共包含31个基因,与药物的肝毒性有关;MCODE21共包含12个基因,与细胞凋亡有关;MCODE31共包含17个基因,与炎症有关。
2.4 分子对接
将核心子网络中连接度最高的10个基因与何首乌7个有效成分进行分子对接,分别得到两两间的分子对接结合自由能。其中EGFR和KRAS不完全与7个有效成分都有交互作用,故排除在外。有效成分与蛋白靶标两两对接的结合能见表1。其中PIK3CA-大黄素、PIK3CA-大黄酚、PIK3CA-扁蓄苷和PIK3CB-大黄素结合能均<-9 kcal/mol(图4A~4D)。

图4 何首乌主要有效成分与核心基因的分子对接 4A:PIK3CA-大黄素;4B:PIK3CA-大黄酚;4C:PIK3CA-扁蓄苷;4D:PIK3CB-大黄素Figure 4 Molecular docking of effective ingredients of polygonum multiflorum and core sub-network. 4A: PIK3CA-Emodin; 4B:PIK3CA-Chrysophanol; 4C: PIK3CA-Guaijaverin; 4D: PIK3CB-Emodin.

表1 何首乌有效成分与蛋白靶标的结合能 (kcal/mol)Table 1 The binding energy between effective ingredients of polygonum multiflorum and protein targets (kcal/mol)
3 讨论
本研究发现,何首乌主要通过调节炎症反应、细胞凋亡、氧化应激、自噬等通路发挥生物学功能。文献报道何首乌具有清除DPPH自由基的能力,并通过调控炎症反应、氧化应激和凋亡等多种信号通路来发挥抗氧化、抗衰老、抗炎等功效的[16-17],本研究结果与此一致。进一步对蛋白互作网络中靶基因基于MCC模式分析得到相互作用关系最强的10个核心目标靶标,并进行分子对接以验证它们和何首乌有效成分之间的相互作用。化合物与受体所形成的构象能量越低,结构越稳定,结合活性较高。一般认为当结合能<0,表明配体分子均能和受体蛋白自发结合,结合能<-5.0 kcal/mol时,表明结合性好,结合能越低,对接结果越佳[18]。本研究发现何首乌中的大黄素与PIK3CA、PIK3CB的结合能最低,均低于-9 kcal/mol。推测何首乌主要通过其有效成分大黄素作用于PIK3CA、PIK3CB来发挥功能,与其他研究结果相一致[16,19]。
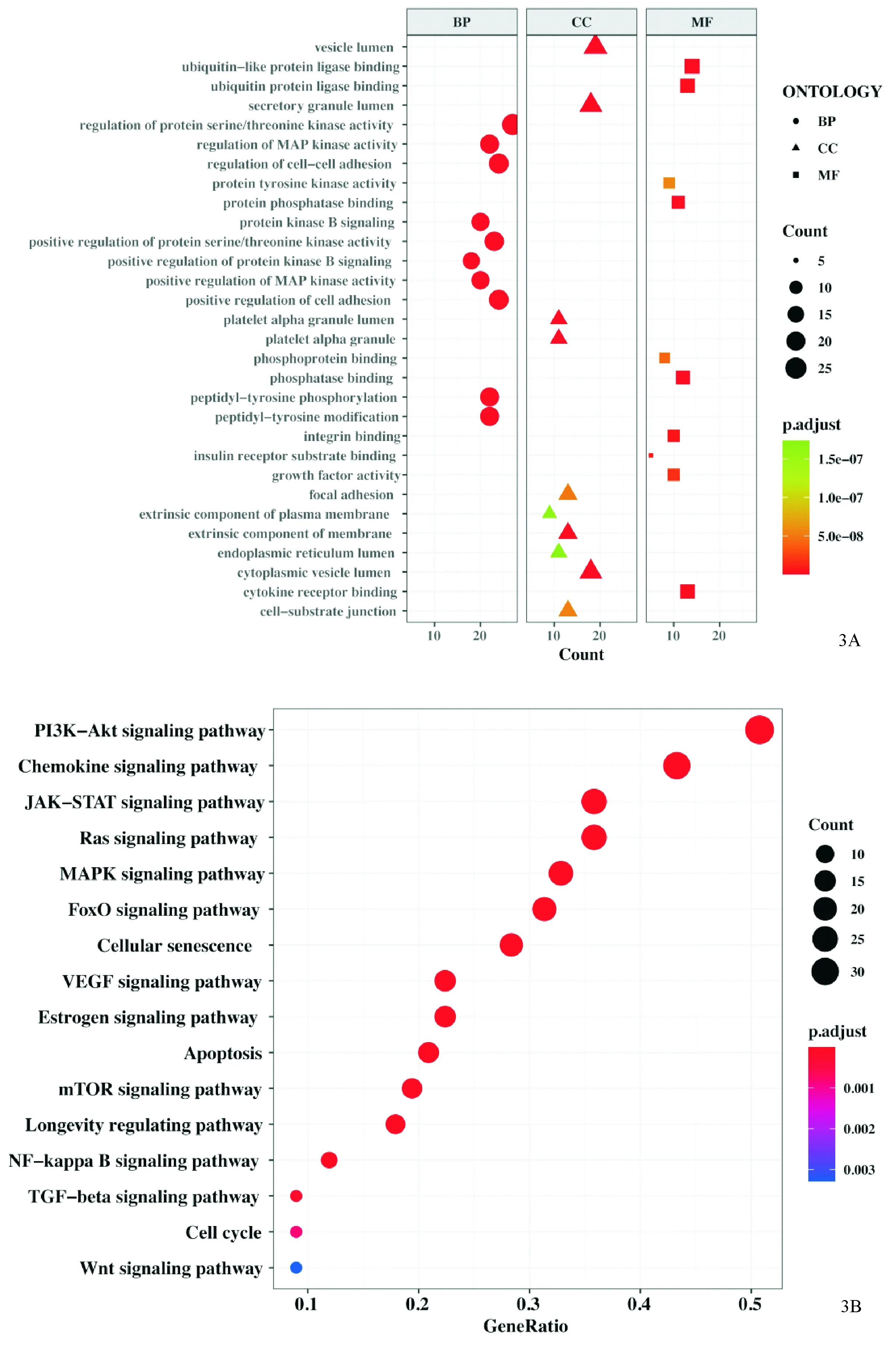
图3 核心子网络基因的GO、KEGG富集分析 3A:GO富集结果;3B:KEGG富集结果
Figure 3 The GO and KEGG enrichment analysis of core sub-network. 3A: GO enrichment analysis; 3B: KEGG pathway enrichment analysis.
何首乌中分离出的蒽醌衍生物大黄素是一种天然化合物,存在于许多植物的根和根茎中。2015年版《中国药典》证实制何首乌总游离蒽醌的主要有效成分为大黄素和大黄素甲醚,而大黄素的含量最多[20]。PI3K/Akt通路已被证实与调控细胞增殖、凋亡和存活的代谢途径等生物学活动密切相关[21]。参与RAS、MAPK和PI3K/Akt信号通路的PIK3CA和PIK3CB在原发性肝癌频繁突变和普遍过表达[22]。虽然PIK3有许多下游靶点,但Akt是PIK3调节影响细胞存活的细胞成分的主要介体[23]。据报道,大黄素通过Akt磷酸化抑制PI3K/Akt信号通路,避免细胞过度增殖和凋亡[24]。因此,大黄素诱导的自噬对细胞凋亡有保护作用。自噬通常被认为是一种通过消除受损的细胞器维持哺乳动物细胞健康的抗凋亡过程。
Bcl-2家族蛋白作为线粒体膜外膜完整性的调节器,在细胞凋亡过程中发挥着重要作用,而促凋亡成员如Baxs则破坏这一功能[25]。大黄素通过ERK-1/2信号通路上调Bcl-2和GLT-1表达,以及下调Cleaved-cas3、Baxs、Cyt-c、AIF和Smac的表达抑制细胞凋亡和活性氧的产生来延缓皮肤衰老[26]。此外,大黄素通过MAPK、PI3K/Akt和NIK-IKK通路发挥NF-κB的抑制作用,抑制促炎介质TNF-α、IL-6、MPO、丙二醛、CINC-1、MIP-2和ICAM-1释放[27]。据报道,何首乌主要通过MAPK、CAMP/PKA、PI3K/Akt以及Wnt信号通路诱导黑色素生成、酪氨酸酶活性和黑色素生成基因的表达,起到乌发的作用[28]。
毛囊周围H2O2的积聚激活ERK导致黑素细胞数量减少。大黄素通过增加SIRT1和FOXO1等蛋白的表达来抑制ERK的激活,并通过激活MITF转录因子增加酪氨酸相关蛋白TRP-1、TRP-2和酪氨酸酶的表达,从而促进黑色素的合成[29]。2,3,5,4-四羟基二苯乙烯-2-O--D-葡萄糖苷(THSG)是何首乌特有的成分,也是目前研究较多的成分。THSG通过调节PI3K/Akt和Bcl-2/ Caspase-3信号通路,促进细胞存活,抑制细胞凋亡[30]。另外,THSG还可以激活Akt/mTOR通路部分修复微血管内皮功能障碍,维持血管的正常功能[31]。
药物流行病学研究发现,每年的特异性药物性肝损伤发病率为23.80/10万,何首乌是我国药物性肝损伤的主要病因之一[32]。与此前报道一致,大黄素和大黄酸是何首乌肝毒性的主要成分,其毒性具有浓度依赖性和时间依赖性[33]。肝损伤表现为血浆ALT、AST活性升高,肝组织汇管区大量炎性细胞浸润和肝细胞凋亡增多[34]。其机制可能与大黄素诱导caspase3依赖途径和线粒体介导的促进细胞凋亡有关。何首乌引起的肝损伤只发生在少数服用该药的个体中,与个体对药物的易感性相关。提示临床应高度重视何首乌使用的安全性。
综上,本研究基于药理学网络研究,探讨何首乌在雄激素性脱发中的潜在治疗机制,结果表明,何首乌主要通过大黄素在抑制细胞凋亡、改善炎症反应、减弱氧化应激和生成黑色素等方面发挥主要的作用。此外,本研究还提供了雄激素性脱发治疗的几个潜在靶点,可能有助于解释其发病机制和为临床治疗提供新的策略。
