ICU与非ICU血培养病原菌组成及耐药特点
2022-05-30陶晓燕闵昌航于婷王海晨李军胡咏梅邹明祥
陶晓燕 闵昌航 于婷 王海晨 李军 胡咏梅 邹明祥

摘要:目的 探討重症监护病房(ICU)与非ICU住院患者血培养病原菌组成及耐药特点,为临床合理使用抗菌药物提供实验依据。方法 对中南大学湘雅医院2015年1月—2019年12月ICU与非ICU血培养检出的病原菌的组成及耐药性进行分析,并对6种关键多重耐药菌(MDRO)的检出情况进行比较。结果 共分离非重复病原菌3301株。其中,革兰阴性菌2066株,占62.59%;革兰阳性菌990株,占29.99%;真菌245株,占7.42%。ICU共分离病原菌734株,鲍曼不动杆菌最多,占19.75%;非ICU分离病原菌2567株,大肠埃希菌最多,占22.59%。在监测的6种主要病原菌中,MDRO占33.46%(631/1886)。其中,鲍曼不动杆菌中CRAB最高,达94.42%,大肠埃希菌中CREC最低,为5.02%。ICU 6种病原菌中MDRO占61.88%(276/446),高于非ICU的24.65%(355/1440)(χ2=212.015,P=0)。ICU与非ICU分离的大肠埃希菌对除头孢唑林和氨曲南外的其他常用抗菌药物的耐药率差异无统计学意义(P>0.05);ICU分离的肺炎克雷伯菌和鲍曼不动杆菌对除复方磺胺甲恶唑外的其他常用抗菌药物的耐药率高于非ICU(P<0.05);铜绿假单胞菌对除阿米卡星外的其他抗菌药物的耐药率高于非ICU(P<0.05);金黄色葡萄球菌、凝固酶阴性葡萄球菌对多种抗菌药物的耐药率高于非ICU,差异有统计学意义(P<0.05)。结论 中南大学湘雅医院血流感染病原菌以革兰阴性菌为主,且耐药十分严重。ICU血培养分离菌株MDRO检出率高,对多种抗菌药物的耐药率高于非ICU。临床应根据相应流行病学数据,制定针对性的经验治疗策略,并及时根据患者病原学检测结果,调整治疗方案。
关键词:血流感染;病原菌;重症监护病房;多重耐药;耐药性
中图分类号:R978.1,R446.5文献标志码:A
Characteristics of composition and antimicrobial resistance of pathogens
in blood culture between ICU and non-ICU
Tao Xiao-yan1,2, Min Chang-hang1, Yu Ting1, Wang Hai-chen1, Li Jun1, Hu Yong-mei1, and Zou Ming-xiang1
(1 Department of Laboratory Medicine, Xiangya Hospital, Central South University, Changsha 410008;2 Department of Laboratory Medicine, Sichuan Provincial People's Hospital, University of Electronic Science and Technology of China, Chengdu 610072)
Abstract Objective To investigate the characteristics of composition and drug resistance feature of pathogens isolated from blood culture between intensive care unit (ICU) and non-ICU and to provide evidence for the rational use of antibiotics. Methods The composition and drug resistance of the pathogens, isolated in blood culture of ICU and non-ICU patients in a large tertiary hospital from January 2015 to December 2019, were analyzed. The characteristics of 6 critical multidrug-resistant organisms (MDRO) isolated from ICU and non-ICU patients were compared. Results A total of 3301 non duplicate strains of pathogens were isolated. Among them, 2066 isolates were Gram-negative bacteria (accounting for 62.59%), 990 isolates were Gram-positive bacteria (accounting for 29.99%) and 245 isolates were fungi (accounting for 7.42%). Totally 734 strains of pathogens were isolated from ICU, of which Acinetobacter baumannii was the most common (19.75%), while 2,567 strains of pathogens were isolated from non-ICU and Escherichia coli was the most common (22.59%). Among the 6 pathogens monitored in this study, 631 MDRO isolates were detected, with a total detection rate of 33.46%(631/1886). The isolation rate of CRAB in Acinetobacter baumannii was the highest (94.42%) and the detection rate of CREC in Escherichia coli was the lowest (5.02%). The detection rate of the 6 major MDRO in ICU was 61.88% (276/446) and which was significantly higher than 24.65% (355/1,440) of non-ICU (χ2=212.015,P=0). There were no significant differences in the resistance rates of Escherichia coli to common antibiotics between ICU and non-ICU isolates except cefazolin and aztreonam(P>0.05). In ICU, resistance rates of Klebsiella pneumoniae and Acinetobacter baumannii to commonly used antibiotics were higher than those in non-ICU except trimethoprim-sulfamethoxazole (P<0.05). Pseudomonas aeruginosa was more resistant to common antibiotics except amikacin than in non-ICU (P<0.05). The resistance rates of Staphylococcus aureus and coagulase-negative staphylococci to various antibiotics were significantly higher than those of non-ICU (P<0.05). Conclusion The pathogens causing bloodstream infection in our hospital were mainly Gram-negative bacteria, which were severely resistant to commonly used antibiotics. The detection rates of MDRO in ICU were higher, and its antibiotic resistance rates to various antibiotics were also higher than that in non-ICU. According to the epidemiological data, a targeted empirical treatment strategy should be formulated and the treatment plan should be adjusted in time according to the patients pathogenic test results.
Key words Bloodstream infection; Pathogens; Intensive care unit; Multidrug resistance; Drug resistance
血流感染(BSIs) 是一种严重的全身感染性疾病,病原种类复杂,死亡率高,日益成为公众健康关注的焦点[1-2]。当机体发生血流感染时,病原微生物侵入血液,繁殖并释放毒素,对脏器造成损害,严重者可导致休克、多脏器衰竭、弥漫性血管内凝血(DIC)甚至死亡。血流感染是导致住院患者死亡的主要原因之一,并与住院时间延长和住院费用增加密切相关[3-5]。ICU患者往往病情危重复杂,接受较多侵入性操作,更易发生血流感染[6-7],且具有更高的死亡风险,研究报道,ICU患者的血流感染死亡率介于40%至60%之间[8]。ICU患者血流感染分离病原菌的组成和耐药性与非ICU患者常存在差异。血培养是明确血流感染的金标准,为临床感染性疾病的诊断和治疗提供了重要的依据。然而,血培养及药敏试验周期较长,无法满足临床第一时间进行针对性治疗的要求。因此,根据流行病学数据进行经验治疗,是目前临床不可或缺的重要手段,尤其在血流感染的早期治疗中发挥了重要作用。目前关于ICU与非ICU血液标本分离的病原菌组成及临床常见多重耐药菌耐药性差异的相关研究较少。因此,为深入了解ICU与非ICU血流感染病原菌的特点,为临床合理选择抗菌药物提供依据,本研究对中南大学湘雅医院2015—2019年ICU与非ICU血流感染病原菌的分布、重要病原菌的MDRO检出及耐药情况进行了分析,报告如下。
1 材料与方法
1.1 菌株来源
3301株病原菌分离自中南大学湘雅医院2015年1月1日—2019年12月31日临床住院患者送检的血液标本,剔除重复以及污染菌株,污染菌的判断参照文献进行[9-10]。
1.2 菌株的分离培养、鉴定与药敏试验
血培养采用美国BD公司BACTEC FX及法国梅里埃公司BacT/ALERT 3D全自动血培养仪;菌株鉴定采用德国布鲁克公司MALDI-TOF MS质谱仪;常规药物敏感性试验采用法国生物梅里埃公司VITEK 2 Compact全自动微生物分析仪,药敏测试板均来自法国生物梅里埃公司;部分补充药敏试验采用K-B法,氨苄西林/舒巴坦、头孢唑林、头孢他啶、头孢哌酮/舒巴坦和美罗培南用于肠杆菌科细菌补充药敏试验,哌拉西林/他唑巴坦、氨曲南、庆大霉素和氨苄西林/舒巴坦用于铜绿假单胞菌补充药敏实验,哌拉西林/他唑巴坦、氨曲南、庆大霉素、氨苄西林/舒巴坦、美罗培南和阿米卡星用于鲍曼不动杆菌补充药敏试验,药敏纸片购于英国Oxoid公司。药敏判断折点按照美国临床实验室标准化协会(CLSI)当年版标准进行,结果分为耐药、中介与敏感,本研究统计学处理过程中将药敏结果为耐药和中介菌株作为耐药菌株进行统计处理。质控菌株大肠埃希菌ATCC25922、金黄色葡萄球菌ATCC25923和ATCC29213、铜绿假单胞菌ATCC27853及阴沟杆菌ATCC700323均由ATCC提供。
1.3 多重耐藥菌的监测
本研究根据《MDR、XDR、PDR多重耐药菌暂行标准定义——国际专家建议》[11],选择目前临床需重点关注的多重耐药菌(multidrug-resistant organism,MDRO)进行分析,包括耐碳青霉烯类大肠埃希菌(CREC)、耐碳青霉烯类肺炎克雷伯菌(CRKP)、耐碳青霉烯类鲍曼不动杆菌(CRAB)、耐碳青霉烯类铜绿假单胞菌(CRPA)、耐甲氧西林金黄色葡萄球菌(MRSA)以及耐甲氧西林凝固酶阴性葡萄球菌(MRCNS)。
1.4 统计学分析
应用Excel和SPSS 22.0软件对资料进行统计分析,率的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 病原菌分布
2015—2019年住院患者送检的血培养标本共分离非重复病原菌3301株,以革兰阴性菌为主,共2066株,占62.59%;革兰阳性菌990株,占29.99%;真菌245株,占7.42%。5年间共分离大肠埃希菌637株(19.30%),分离率居首位,其余分离率前4位的病原菌依次为肺炎克雷伯菌、鲍曼不动杆菌、金黄色葡萄球菌以及凝固酶阴性葡萄球菌。ICU共分离出病原菌734株,前5位依次为鲍曼不动杆菌、肺炎克雷伯菌、大肠埃希菌、凝固酶阴性葡萄球菌以及铜绿假单胞菌。非ICU共分离出病原菌2567株,前5位依次为大肠埃希菌、肺炎克雷伯菌、金黄色葡萄球菌、凝固酶阴性葡萄球菌以及铜绿假单胞菌。ICU共分离真菌83株,非ICU共分离真菌162株。见表1。
2.2 MDRO检出情况
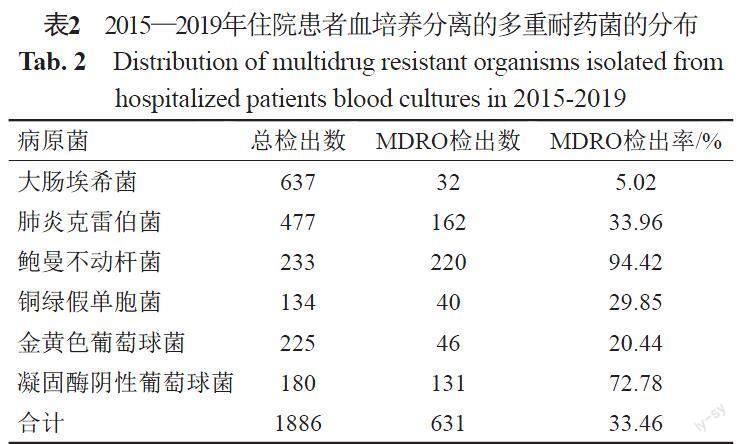
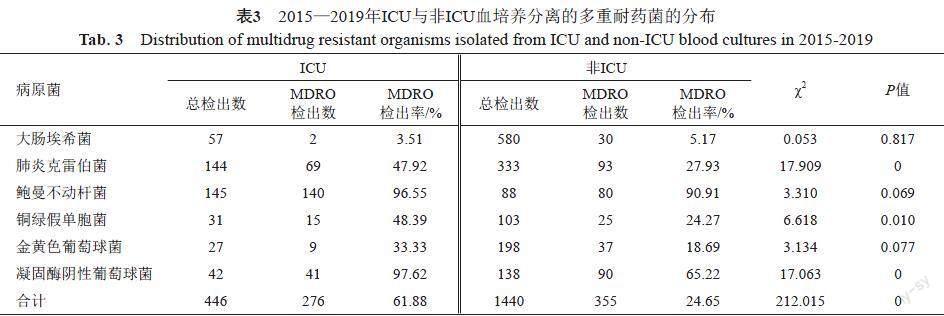
住院患者血培养分离到大肠埃希菌、肺炎克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌、金黄色葡萄球菌以及凝固酶阴性葡萄球菌共1886株,其中检出CREC、CRKP、CRAB、CRPA、MRSA以及MRCNS等6种MDRO共631株,见表2。MDRO中检出率最低的为碳青霉烯类耐药的大肠埃希菌,为5.02%,而鲍曼不动杆菌中CRAB达94.42%。ICU分离的以上6种病原菌中MDRO达61.88%(267/446),高于非ICU的24.65%(355/1440),差异具有统计学意义(P=0)。在监测的6种MDRO中,ICU中CRKP、CRPA和MRCNS检出率均高于非ICU,差异具有统计学意义(P<0.05),见表3。
2.3 ICU和非ICU血培养分离主要病原菌对常用抗菌药物的耐药性
2.3.1 大肠埃希菌和肺炎克雷伯菌的耐药性
ICU和非ICU血培养分离的大肠埃希菌对头孢唑林和氨曲南的耐药率差异有统计学意义(P<0.05)。2019年分离的大肠埃希菌对头孢他啶、头孢曲松、头孢吡肟和氨曲南耐药率相比于2015年有所下降(P<0.05),而对头孢哌酮/舒巴坦和亚胺培南的耐药率相比于2015年有所上升(P<0.05)。除复方磺胺甲恶唑外,ICU检出的肺炎克雷伯菌对其余16种抗菌药物的耐药率高于非ICU,差异有统计学意义(P<0.05)。2019年分离的肺炎克雷伯菌对大部分抗菌药物的耐药率高于2015年,其中头孢哌酮/舒巴坦、喹诺酮类药物和复方磺胺甲恶唑的耐药率差异有统计学意义(P<0.05),见表4~5。
2.3.2 铜绿假单胞菌和鲍曼不动杆菌耐药性
除阿米卡星外,ICU分离的铜绿假单胞菌对其余11种抗菌药物的耐药率均高于非ICU(P<0.05)。与2015年相比,2019年血培养分离的铜绿假单胞菌对大部分常用菌药物的耐药率有所下降,其中氨曲南和阿米卡星耐药率差异有统计学意义(P<0.05)。住院患者血培养分离的鲍曼不动杆菌对常用抗菌药物普遍表现出较高的耐药性,除复方磺胺甲恶唑外,ICU分离的鲍曼不动杆菌对其余12种抗菌药物的耐药率均高于非ICU分离株,差异均具有统计学意义(P<0.05)。2019年分离的鲍曼不动杆菌对12种抗菌药物的耐药率稍高于2015年,其中头孢哌酮/舒巴坦和阿米卡星的耐药率差异有統计学意义(P<0.05),见表6~7。
2.3.3 金黄色葡萄球菌和凝固酶阴性葡萄球菌的耐药性
ICU分离的金黄色葡萄球菌对四环素、庆大霉素、红霉素、克林霉素、利福平以及3种氟喹诺酮类抗菌药物的耐药率均高于非ICU分离株(P<0.05)。2019年分离的金黄色葡萄球菌与2015年相比,对不同抗菌药物的耐药情况各有不同,其中2019年分离株对苯唑西林的耐药率高于2015年(P<0.05)。ICU分离的凝固酶阴性葡萄球菌对苯唑西林、替加环素、庆大霉素以及3种氟喹诺酮类抗菌药物的耐药率高于非ICU(P<0.05)。2019年分离的凝固酶阴性葡萄球菌对苯唑西林、庆大霉素、红霉素、克林霉素、复方磺胺甲恶唑和喹诺酮类药物的耐药率较2015年有所下降(P<0.05),见表8~9。
3 讨论
本研究结果显示,住院患者血流感染以革兰阴性菌为主,占62.59%。其中,大肠埃希菌、肺炎克雷伯菌、鲍曼不动杆菌和铜绿假单胞菌等四种阴性杆菌占所有分离菌的44.87%,与文献报道[12-13]基本一致。而革兰阳性菌中,金黄色葡萄球菌及凝固酶阴性葡萄球菌为主要分离菌,总分离率12.27%。尽管ICU和非ICU血流感染的病原菌均以革兰阴性菌为主,但其菌种构成却各有其特点,ICU中革兰阴性菌占比高于非ICU(P<0.05)。ICU中鲍曼不动杆菌占所有分离病原菌的首位,达19.75%,而在非ICU中,鲍曼不动杆菌仅占3.43%;非ICU中大肠埃希菌占所有分离病原菌的首位,达22.59%,而在ICU中仅占7.77%。一项针对176家医院ICU医院感染的监测发现[14],鲍曼不动杆菌是ICU最常见的病原菌,其次是肺炎克雷伯菌,与本研究结果相似,说明ICU中鲍曼不动杆菌无论是血液还是非血液标本都是分离率最高的病原菌。中南大学湘雅医院ICU患者血培养肺炎克雷伯菌的分离株数仅比鲍曼不动杆菌少1株,而在非ICU分离病原菌中的构成比也达到12.97%,居于第二位。说明中南大学湘雅医院肺炎克雷伯菌的传播流行不仅在ICU需应引起重视,在非ICU同样应引起重视。另外,ICU中真菌的占比要高于非ICU(P<0.05),提示ICU患者往往病情复杂,更应警惕真菌感染的可能。
常见病原菌耐药性分析显示,大肠埃希菌对喹诺酮类药物的耐药率超过50.00%,提示中南大学湘雅医院喹诺酮类药物不宜作为血流感染大肠埃希菌的经验用药,而对哌拉西林/他唑巴坦则有很好的敏感性,无论在ICU还是非ICU,其耐药率均低于10.00%,可考虑用于经验治疗。值得一提的是,本研究中ICU 和非ICU分离的大肠埃希菌,对头孢哌酮/舒巴坦的耐药率分别为16.67%和10.05%,明显高于前期报道的3.87%[15],其耐药性增长较快,应注意持续监测其耐药情况变化,并合理应用。肺炎克雷伯菌耐药形势十分严峻,在ICU尤为突出。17种抗菌药物中,ICU分离的肺炎克雷伯菌对其中15种的耐药率均超过50.00%。肺炎克雷伯菌对亚胺培南和厄他培南的耐药率分别为33.12%和33.76%,也高于前期报道的22.60%和25.80%[15]。
铜绿假单胞菌对多种抗菌药物均存在一定的耐药性,但没有十分突出的特点,且ICU分离株对抗菌药物耐药率相对较高,给经验治疗带来一定的困难。鲍曼不动杆菌不仅是ICU中位居首位的病原菌,且其耐药已十分严重。研究显示,中性粒细胞减少、入住ICU、中枢神经系统原发感染 和既往使用碳青霉烯类药物是鲍曼不动杆菌所致血流感染的独立危险因素[16]。ICU分离的鲍曼不动杆菌耐药率最低为复方磺胺甲恶唑(53.10%),对被监测的13种药物中的10种的耐药率高达89.44%~100.00%。尽管非ICU分离的鲍曼不动杆菌对11种抗菌药物的耐药率低于ICU分离株,但非ICU分离的鲍曼不动杆菌耐药性也较严重,对13种抗菌药物的耐药率介于46.88%~67.95%之间。说明一旦该菌感染,无论是ICU还是非ICU,可供选择的抗菌药物十分有限。
中南大学湘雅医院血流感染分离的革兰阳性菌仍然以金黄色葡萄球菌为主,其次为凝固酶阴性葡萄球菌。所有葡萄球菌对青霉素、红霉素、克林霉素已有较高的耐药率,但对万古霉素、奎奴普丁/达福普汀、利奈唑胺和替加环素仍然保持高度敏感。ICU和非ICU分离的金黄色葡萄球菌对苯唑西林的耐药率分别为33.33%和18.69%。研究显示,中心静脉导管的存在是MRSA血流感染的重要危险因素,且其预后比非MRSA血流感染患者预后更差[17]。ICU和非ICU分离的凝固酶阴性葡萄球菌对苯唑西林的耐药率分别为97.62%和66.18%,说明凝固酶阴性葡萄球菌耐药形势比金黄色葡萄球菌更为严峻。需要注意的是,凝固酶阴性葡萄球菌广泛存在于环境和人体皮肤表面,是血培养的重要污染菌,有文献报道血培养凝固酶阴性葡萄球菌的污染率可达69.71%[18]。同时,凝固酶阴性葡萄球菌又是血流感染的重要病原菌,尤其是导管相关性血流感染最为常见[19]。因此,采集血液时必须进行严格的皮肤消毒,以尽可能减少污染。同时,临床获得该病原菌结果后,应根据患者的临床特征,结合阳性套数、报阳时间和多次药敏结果的一致性等来评价其临床价值。
分析常见病原菌的耐药性变迁发现,2019年分离的大肠埃希菌对部分抗菌药物的耐药率与2015年相比有所下降,如头孢他啶、头孢曲松、头孢吡肟和氨曲南,而对部分抗菌药物的耐药率增高,如2019年分离株中出现了亚胺培南的耐药菌株,占3.91%,提示临床应警惕大肠埃希菌对碳青霉烯类药物耐药性的增加而导致的治疗失败。另外,值得注意的是,2019年分离的鲍曼不动杆菌对常用药物耐药率有所升高,尤其是对头孢哌酮/舒巴坦和阿米卡星的耐药率,都远高于2015年(P<0.05),应引起高度重视。对于金黄色葡萄球菌,2015年MRSA的检出率为8.51%,而2019年则升高至27.08%,差异有统计学意义,提示中南大学湘雅医院血流感染中MRSA的分離率有所上升。
对于革兰阴性杆菌引起的感染,碳青霉烯类抗菌药物是临床治疗的关键药物,一旦耐药,能够选择的抗菌药物十分有限;而对于葡萄球菌引起的感染,一旦该菌株为甲氧西林耐药株,则除头孢洛林之外,几乎所有的β-内酰胺类药物都不能使用,因此,给临床治疗带来极大的困难。故本研究重点关注这两类MDRO。结果发现,CREC、CRKP、CRAB、CRPA、MRSA以及MRCNS等6种MDRO共631株,占这6种主要病原菌的33.46%。特别需要注意的是,ICU 6种病原菌中MDRO的总检出率达61.88%,远高于非ICU的24.65%(P=0)。提示临床经验治疗时,应考虑到ICU与非ICU病原菌耐药性的差异,结合临床实际情况,合理选用抗菌药物。本研究中,CREC的检出率为5.02%,而CRAB的检出率却高达94.42%,与中国细菌耐药监测网(CHINET)2018年水平基本一致[20]。CHINET研究显示,我国临床分离肺炎克雷伯对碳青霉烯类耐药率从2005年的约3.0%,上升至2018年的约26.0%[20]。而本研究中CRKP的检出率33.96%,既高于陈娜等[21]报道的中国西部地区所有类型感染中CRKP的检出率(12.3%),也高于李志荣等[22]报道的河北地区血流感染CRKP的检出率(15.7%)。说明中南大学湘雅医院CRKP检出率上升十分迅速,应引起临床高度关注。多项研究发现,携带其他多重耐药菌、侵入性操作、既往胃导管插入术、使用碳青霉烯类药物、低蛋白血症和高急性生理评分和慢性健康评估(APACHE)Ⅱ评分均可能是CRKP感染的独立危险因素[23-25]。近年来,耐碳青霉烯酶的肺炎克雷伯菌中3种最常见的酶型分别为KPC、NDM及OXA-48,目前国内最常见的碳青霉烯酶类型为KPC[26-27]。本课题组前期研究证实,中南大学湘雅医院肺炎克雷伯菌携带blaKPC、blaIMP和blaNDM基因并存在克隆传播[28-29]。本研究中MRSA的检出率为20.44%,明显低于王晓娟等[30]报道的全国10家医院血流感染监测的38.2%。在被监测的6种MDRO中,CRKP 、CRAB和MRCNS在ICU的检出率均高于非ICU,差异具有统计学意义。以上数据表明,尽管血流感染病原菌多重耐药十分严重,但不同菌种之间、不同病区之间、不同标本类型以及不同地区之间都可能存在差异。
MDRO的出现和快速增长给临床治疗带来困难,感染MDRO患者可用的抗菌药物受到限制,病死率显著上升,严重威胁患者生命安全,同时增加患者的经济负担。因此,对MDRO感染的防控措施至关重要,我国于2021年发布了针对中国自身国情制订的临床重要耐药菌传播防控策略专家共识,提出了多项防控策略,包括病原菌监测、正确执行手卫生、接触预防、患者隔离、主动监测、环境监测、环境的清洁消毒和临床抗生素应用管理等[31]。耐药菌的传播严重威胁人类健康,加强耐药菌感染的预防、控制和诊疗能力建设,是医疗机构防控耐药菌感染传播的重要内容。
综上所述,本研究对5年来 ICU和非ICU血流感染的病原菌分布和耐药情况进行了对比分析,发现ICU与非ICU在病原菌构成、病原菌耐药情况和多重耐药菌分布等方面均存在明显差别,对指导临床合理使用抗菌药物、制定抗菌药物管理和医院感染控制策略提供了重要依据。本研究时间跨度较长,信息量较大,但为单中心研究。同时,部分新近的热点药物或新的抗菌药物,如多黏菌素、头孢他啶/阿维巴坦因无完整实验数据未被纳入,有待后续进一步研究。
参 考 文 献
[1]Deen J, von Seidlein L, Andersen F, et al. Community-acquired bacterial bloodstream infections in developing countries in South and Southeast Asia: A systematic review[J]. Lancet Infect Dis, 2012, 12(6): 480-487.
[2]Laupland K B. Incidence of bloodstream infection: A review of population-based studies[J]. Clin Microbiol Infect, 2013, 19(6): 492-500.
[3] Zhu S C, Kang Y, Wang W, et al. The clinical impacts and risk factors for non-central line-associated bloodstream infection in 5,046 intensive care unit patients: An observational study based on electronic medical records[J]. Crit Care, 2019, 23(1): 52.
[4]刘兆玮, 马科, 胡景玉, 等. 重症监护病房血流感染的危险因素及预后分析[J]. 中华感染与化疗杂志, 2019, 19(1): 12-17.
[5]Pittet D, Tarara D, Wenzel R P. Nosocomial bloodstream infection in criticallyill patients: Excess length of stay, extra costs, and attributable mortality[J]. JAMA, 1994, 271(20): 1598-1601.
[6]温晓星, 李华茵, 周晴, 等. 医院获得性革兰阳性球菌血流感染的危险因素及预后分析[J]. 中华医院感染学杂志, 2014, 24(21): 5301-5303.
[7] Marín M, Gudiol C, Ardanuy C, et al. Factors influencing mortality in neutropenic patients with haematologic malignancies or solid tumours with bloodstream infection[J]. Clin Microbiol Infect, 2015, 21(6): 583-590.
[8]Bassetti M, Righi E, Carnelutti A. Bloodstream infections in the intensive care unit[J]. Virulence, 2016, 7(3): 267-279.
[9]中华人民共和国国家卫生和计划生育委员会. 临床微生物实验室血培养操作规范WS/T503-2017[S]. 2017.
[10]圣朝军, 管希周. 血培养阳性报警时间在成人凝固酶阴性葡萄球菌血流感染诊断中的意义[J]. 解放军医院学报, 2017, 38(12): 1148-1150.
[11]李春辉, 吴安华. MDR、XDR、PDR多重耐药菌暂行标准定义——国际专家建议[J]. 中国感染控制杂志, 2014, 13(1): 62-64.
[12]李春香, 李忠原, 李显彬, 等. 2015-2017年某三甲医院住院患者血培养病原菌分布及耐药性[J]. 中国感染控制杂志, 2018, 17(10): 860-865.
[13]赵梅, 伏慧, 贾伟, 等. 中国西部地区血流感染病原菌分布及耐药性[J]. 中国抗生素杂志, 2018, 43(9): 1095-1100.
[14]Li Y, Cao X, Ge H, et al. Targeted surveillance of nosocomial infection in intensive care units of 176 hospitals in Jiangsu province, China[J]. J Hosp Infect, 2018, 99(1): 36-41.
[15]刘乐平, 刘文恩, 晏群, 等. 2012—2015年某三甲医院血培养常见病原菌及其耐药性变迁[J]. 中国感染控制杂志, 2016, 15(6): 374-379.
[16]Gu Y H, Jiang Y, Zhang W, et al. Risk factors and outcomes of bloodstream infections caused by Acinetobacter baumannii: a case-control study[J]. Diagn Microbiol Infect Dis, 2021, 9(2): 115229.
[17]Yasmin M, El Hage H, Obeid R, et al. Epidemiology of bloodstream infections caused by methicillin-resistant Staphylococcus aureus at a tertiary care hospital in New York[J]. Am J Infect Control, 2016, 44(1): 41-46.
[18]崔博沛, 叶丽艳, 马薇, 等. 血培养阳性报警时间在葡萄球菌菌血症中的临床诊断效能评价[J]. 中华医院感染学杂志, 2018, 28(17): 2567-2571.
[19]Ruiz-Giardin J M, Ochoa Chamorro I, Velázquez Ríos L, et al. Blood stream infections associated with central and peripheral venous catheters[J]. BMC Infect Dis, 2019, 19(1): 841.
[20]Hu F, Guo Y, Yang Y, et al. Resistance reported from China antimicrobial surveillance network (CHINET) in 2018[J]. Eur J Clin Microbiol Infect Dis, 2019, 38(12): 2275-2281.
[21]陳娜, 季萍, 贾伟, 等. 中国西部地区产碳青霉烯酶肠杆菌科细菌的耐药及分布特点[J]. 中国抗生素杂志, 2018, 43(9): 1067-1072.
[22]李志荣, 赵建宏, 杨靖, 等. 2016—2017年河北省三级医院血培养分离细菌分布及耐药性分析[J]. 河北医科大学学报, 2019, 40(11): 1322-1326.
[23]Xiao T, Zhu Y, Zhang S, et al. A retrospective analysis of risk factors and outcomes of carbapenem-resistant Klebsiella pneumoniae bacteremia in nontransplant patients[J]. J Infect Dis, 2020, 221 (Suppl 2): S174-S183.
[24]徐佳丽, 邓德耀, 袁文丽, 等. 重癥监护病房耐碳青霉烯类肺炎克雷伯菌临床特征及危险因素分析[J]. 国际检验医学杂志, 2021, 42(11): 1333-1337.
[25]Ben-David D, Kordevani R, Keller N, et al. Outcome of carbapenem resistant Klebsiella pneumoniae bloodstream infections[J]. Clin Microbiol Infect, 2012, 18(1): 54-60.
[26]Hu L, Zhong Q, Shang Y, et al. The prevalence of carbapenemase genes and plasmid-mediated quinolone resistance determinants in carbapenem-resistant Enterobacteriaceae from five teaching hospitals in central China[J]. Epidemiol Infect, 2014, 142(9): 1972-1977.
[27]Nordmann P, Poirel L. The difficult-to-control spread of carbapenemase producers among Enterobacteriaceae worldwide[J]. Clin Microbiol Infect, 2014, 20(9): 821-830.
[28]李军, 黄紫嫣, 谭媛, 等. 血液分离碳青霉烯类耐药肺炎克雷伯菌耐药机制及同源性研究[J]. 中华医院感染学杂志, 2019, 29(17): 2561-2565.
[29] Li J, Huang Z Y, Yu T, et al. Isolation and characterization of a sequence type 25 carbapenem-resistant hypervirulent Klebsiella pneumoniae from the mid-south region of China [J]. BMC Microbiol, 2019, 19(1): 219.
[30]王晓娟, 赵春江, 李荷楠, 等. 2011年、2013年和2016年医院内获得性血流感染常见病原菌分布及其耐药性分析[J]. 生物工程学报, 2018, 34(8): 1205-1217.
[31]杨启文, 吴安华, 胡必杰, 等.临床重要耐药菌感染传播防控策略专家共识[J]. 中国感染控制杂志, 2021, 20(1): 1-14.
