氟康唑氯化钠注射液的质量评价
2022-05-30周茜刘晨曦吴蔚庞璋帆汪杨赵亚萍
周茜 刘晨曦 吴蔚 庞璋帆 汪杨 赵亚萍

摘要:目的 对国产氟康唑氯化钠注射液的质量状况进行评价。方法 采用法定标准检验结合探索性研究,对检验结果进行统计分析。结果 按法定标准检验158批样品,合格率为100%。探索性研究采用文献报道的有关物质测定方法,对样品进行检测,合格率为95.4%;采用LC/MS对主要杂质进行结构确认,并进行来源分析;氟康唑氧化降解杂质为主要杂质,部分企业的原料和制剂中存在未知的弱极性杂质,优化后的有关物质系统可对其同步控制。结论 国产氟康唑氯化钠注射液的整体质量较好,各企业产品存在不同程度的质量差异。原料工艺控制水平是影响本品质量的关键因素,相关企业应对原料进行优选并提高生产工艺控制水平。现行标准无法有效控制弱极性杂质,pH值及渗透压摩尔浓度的限度范围有待规范,标准亟待修订。
关键词:氟康唑氯化钠注射液;有关物质;质量评价
中图分类号:R978.1文献标志码:A
Quality assessment of fluconazole and sodium chloride injection
Zhou Qian1,2, Liu Chen-xi1,2, Wu Wei1,2, Pang zhang-fan1,2,Wang Yang1,2, and Zhao Ya-ping1,2
(1 Hubei Institute for Food and Drug Control, Wuhan 430075; 2 Hubei Engineering Research Center for Drug Quality Control, Wuhan 430075)
Abstract Objective To evaluate the quality of fluconazole and sodium chloride injection. Methods The statutory standard tests combined with exploratory researches were used to evaluate the quality by statistical analysis of the results. Results According to the statutory standards for the examination of the 158 batches of samples, the qualified rate was 100%. Analysis methods of related substances were developed, and the qualified rate was 95.4% according to the exploratory researches standards. The structures and sources of impurities were confirmed by using LC/MS; fluconazole oxidative degradation impurity was the major impurity. Some unknown nonpolar impurities existed in fluconazole raw materials and preparations, which can be detected and controlled by this method. Conclusion The overall quality of fluconazole and sodium chloride injection was good, but differences in the level of impurities, the pH value, and osmolarity was found between generic products and innovative drugs. The quality of raw materials was the key to the quality of products, the domestic enterprises should optimize the raw materials and production processes to improve the product quality; the current statutory standards should be unified and further improved.
Key words Fluconazole and sodium chloride injection; Related substance; Quality evaluation
氟康唑1980年由Pfizer制藥研发,1988年在英国和法国获准上市,1991年列为世界卫生组织(WHO)抗真菌基本药物,1992年国内开始生产并用于临床[1]。氟康唑属抗真菌药中少数的水溶性药物之一,常用于真菌性疾病特别是白色念珠菌、新型隐球菌等深部真菌性疾病的治疗[2]。不良反应的发生率为10%~16%,主要为消化道反应、过敏反应、肝毒性反应、血细胞变化、神经系统等方面。剂型有片剂(含分散片)、胶囊剂、颗粒剂、滴眼液、注射用冻干制剂和注射剂(注射液和注射用浓溶液);本次国家药品评价性抽验仅针对氟康唑氯化钠注射液一种剂型。
国内氟康唑氯化钠注射液的处方基本一致,个别厂家在处方中添加EDTA作为金属螯合剂。部分企业采取先溶解氯化钠,加活性炭,过滤后,滤液中加氟康唑,后用盐酸或氢氧化钠调节pH值的生产工艺;部分企业采用同时加入氟康唑和氯化钠,用盐酸或氢氧化钠调节pH值,再加入活性炭的工艺。
本次国评共抽取158批样品,涉及生产企业22家(所占比例为21.1%),涉及批准文号22个(所占比例为19.5%)。所涉及的规格为3种,分别为50 mL: 0.1 g、100 mL: 0.2 g和200 mL: 0.4 g(所占比例为75%)。本文依据现行药品质量标准,在完成法定检验的基础上,根据法定检验所发现的问题及品种剂型特点进行相应的探索性研究,对国产氟康唑氯化钠注射液的质量状况进行客观评价并提出建议。
1 仪器及试药
1.1 仪器
Waters e2695高效液相色谱仪(美国Waters公司);Agilent 1260高效液相色谱仪(美国Agilent公司);Thermo LTQ XL液相色谱质谱联用仪(美国赛默飞公司);天大天发GWJ-5微粒分析仪(中国天大天发仪器公司);XS205电子天平(美国Mettler Toledo公司)。
1.2 试药
醋酸钠(分析纯),购自国药集团化学试剂有限公司;乙腈(色谱纯),购自默克股份有限公司,甲醇(色谱纯),购自美国默克股份有限公司;超纯水由Millipore纯水仪制备。氟康唑对照品(批号100543-201602,含量99.9%)购自中国食品药品检定研究院;来自全国22家制剂生产企业的158批次氟康唑氯化钠注射液。
2 试验方法
2.1 法定检验
本次国评执行标准为中国药典2015版和注册标准YBH00232016;原研地产化制剂执行进口注册标准JX20130312。
2.2 探索性研究
针对法定检验中发现的问题,结合品种特点及调研情况等,重点开展有关物质方法优化、杂质谱分析、渗透压、包材相容性及稳定性等项目的探索性研究。
2.2.1 有关物质方法优化
参考相关文献[3]拟定了有关物质测定方法,可有效分离在此次国评中涉及的所有氟康唑已知杂质。色谱条件如下:色谱柱:Agilent ZORBAX Eclipse XDB-C18(4.6 mm×250 mm,5 μm);流动相A:醋酸钠缓冲液(0.01 mol/L,pH 5.0)-甲醇(95:5, V/V);流动相B:乙腈-甲醇(60:40, V/V),按表1线性梯度洗脱。检测波长为261 nm;流速为1.0 mL/min;柱温为40℃;进样体积100 μL。
2.2.2 杂质谱研究
LC/MS测定采用Agilent ZORBAX Eclipse XDB-C18(4.6 mm×250 mm,5 μm)色谱柱,以醋酸铵缓冲液(0.01 mol/L,甲酸調节pH为5.0)-甲醇(95:5)作为流动相A,乙腈-甲醇(60:40)作为流动相B,按表1进行梯度洗脱;柱温为40℃;流速为1.0 mL/min;进样体积100 μL;柱后分流,0.3 mL/min进质谱检测器。一级质谱扫描范围(m/z):100~900;二级质谱扫描范围(m/z):50~900。质谱参数设置如下:采用正离子模式采集;毛细管温度350℃,鞘气流量:5.2 L/min,辅助气流量:3 L/min,毛细管电压:24 V;多级质谱碰撞电压:25~40 eV;其中9.5~10.5 min的洗脱液不进质谱分析以降低主成分峰的污染。
2.2.3 包材相容性研究
本次抽样产品使用了4种包装材料即三层共挤输液用袋、聚丙烯输液瓶、钠钙玻璃输液瓶、中硼硅玻璃输液瓶,为了解不同包装材料对本品质量的影响,对这4种包装材料的产品通过加速试验考察材料中所含金属元素、抗氧剂、塑化剂、硫化剂、多环芳烃类、亚硝胺类等有害物质是否迁移到药品中。将10批玻璃+卤化丁基胶塞的样品倒置加速1个月,通过考察不溶性微粒的变化,探索胶塞对氟康唑氯化钠注射液不溶性微粒的影响。
2.2.4 渗透压摩尔浓度[4]
按照中国药典2015版四部渗透压摩尔浓度测定法(通则0632)的要求,对本次抽验20个厂家54批次的样品进行考察。
2.2.5 无菌保障水平[5]
对企业开展问卷调研,根据企业反馈的资料,结合该品种的抑菌属性,按照中国药典2015年版四部无菌检查法(通则1101)的要求,开展了无菌检查方法学验证。
3 试验结果
3.1 法定标准检验的结果
本次抽验涉及的各标准在检验项目设置、检验方法和限度范围等方面的规定不尽相同,按各自现行质量标准检验,158批样品全部合格,合格率为100%;但发现法定质量标准存在如下问题:①有关物质色谱条件对氟康唑极性大的杂质分离效果不佳,对极性小的杂质洗脱能力不强,中国药典只对杂质总量有要求,未对单个已知杂质和未知杂质进行限定;②缺渗透压摩尔浓度检查;③在各论下未指定无菌检查的冲洗量和阳性对照菌,容易出现假阴性。
3.2 探索性研究结果
根据法定标准检验中存在的问题和制剂本身的剂型特点,本文主要开展了优化有关物质条件,杂质谱分析、基因毒性杂质检测、稳定性研究、渗透压考察、包材相容性等方面研究。
3.2.1 优化有关物质条件
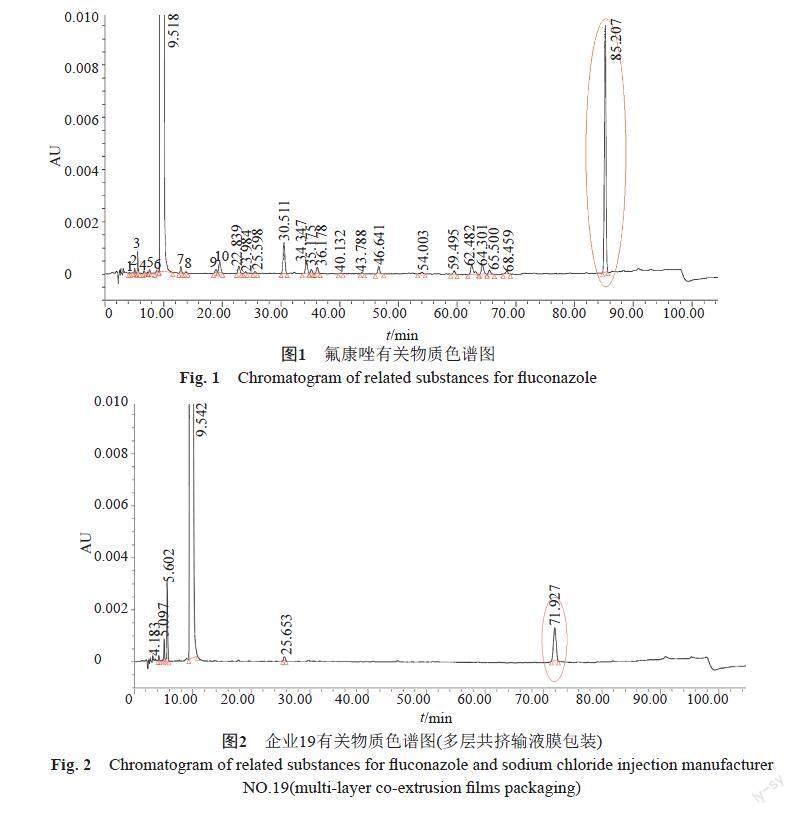
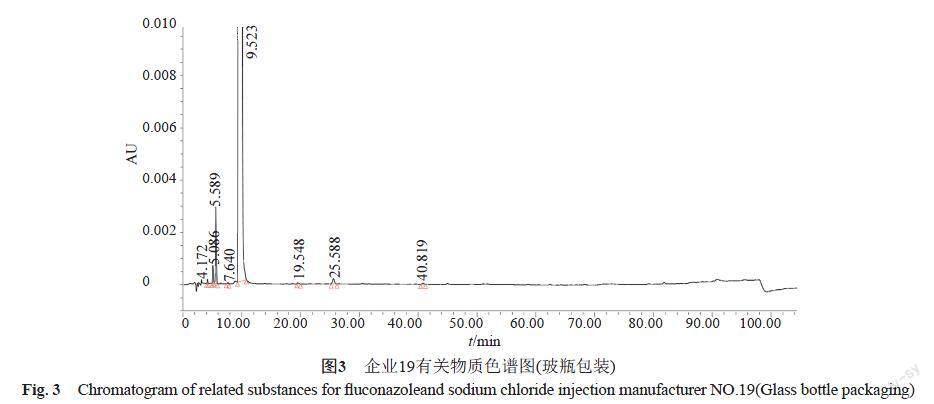
按优化的有关物质方法对60批制剂样品进行检测,检验各企业样品,总杂介于0.08%~0.58%,均值为0.29%,杂质数为7~28个(图1)。其中原研地产化样品(企业22)杂质个数为7~9个,杂质总量为0.37%~0.42%,高于本次抽检国内产品平均水平;国内企业20和企业21使用同一家企业的原料,但企业20的杂质总量显著性高于企业21,经过对比企业20和其提供的相应厂家(原料厂家C)的原料,制剂杂质总量和原料一致,杂质主要为原料带入,提示原料厂家C的生产工艺稳定性有待提高。企业19的7批样品中,4批软袋包装的样品中均检出1个未知杂质,杂质量达到0.17%(图2),而3批玻璃包装的样品未检出该杂质(图3),由于不同包装为不同生产线,已建议该企业进行自查。其他企业杂质控制较好且无明显差异(图4~5)。新建方法的分离效能优于现行方法,还能将更多的弱极性杂质洗脱出来,更能更真实地反映样品杂质情况,结果按现行标准限度再次评价,合格率为95.4%。
经比对,制剂的杂质水平与原料药的杂质情况显著相关。本次抽样涉及的制剂生产企业,其原料源自4家企业。原料企业A和企业B合成路线相同,以环氧氟康唑为起始物料,1H-1,2,4-三氮唑的烷基化得到氟康唑;上述两家企业的原料杂质个数为5~6个,杂质总量为0.10%~0.35%。原料企业C和企业D合成路线较长,以间二氟苯为起始原料,Corey-Chaykovsky反应,得到环氧氟康唑,再次1H-1,2,4-三氮唑的烷基化得到氟康唑;采用該路线得到的原料,杂质个数在10个以上,杂质总量为0.5%~1.0%。其中,企业D生产的4批次原料不同批号的原料,批号为191002和批号为190402的最大未知杂质(保留时间为85.2 min)(图1)均超过0.5%;批号为181102和200101两批次在该位置杂质检出量仅为0.01%和0.003%(表2);该企业的工艺稳定性值得改进。
3.2.2 杂质谱分析
本品中存在共计28个杂质,其中众多未知杂质含量均低于0.01%,属于微量杂质。采用LC/MS共推断出9个主要杂质的结构,并对其来源进行归属,各杂质依次编号为1~9(表3):杂质1和3为工艺杂质;降解杂质中的杂质3为EP中收载的杂质A,该杂质是反映原料工艺、样品储存情况的指针性杂质,其含量在总杂中的占比为30%~80%,也是各企业产品中的共有杂质。原研地产化样品检出最大杂质为杂质3,检出量分布在0.25%~0.33%,在总杂中的占比超过75%,以此推断原研产品使用的原料其合成路线与本次收集的合成路线不相同。
3.2.3 杂质基因毒性确证及测定
对于含有警示结构的杂质8,按照ICH M7的指导原则,采用国际上认可度高的杂质毒性预测软件Sarah软件,进行基因毒性预测;结果分类3,表示该杂质有警示结构,与原料药结构无关,且目前没有诱变性数据。由于该杂质为国内氟康唑原料合成的起始物料或产生的中间体,所以确证其是否有基因毒性有很重要的意义。
采用Ames试验进行确证,结果显示,在有或无代谢活化条件时,其中单次操作中TA1535菌株的5000 μg/皿与阴性对照组相比具有3倍或以上的显著上调,环氧氟康唑Ames试验结果判断为阳性。基于毒理学关注阈(TTC)计算该杂质的可接受摄入量,杂质8的限度应为12.5 ppm。
在此浓度下,HPLC-UV检测器的灵敏度已无法满足检测的需求。开发了液相-三重四极杆质谱仪联用的定量方法进行测定,该方法定量限(LOQ)和检出限(LOD)为2.5 ppm和1 ppm,可用于氟康唑杂质8的测定。经检测,国产氟康唑原料和制剂中均未检出杂质8,企业合成时对该物质的控制水平较好,因此标准中无需额外控制。
3.2.4 包材相容性
各企业的产品经过倒置加速后,包装材料为玻瓶加胶塞的产品发现有不同程度的Si迁移,其他的多环芳烃、亚硝胺、增塑剂、硫化剂和抗氧剂均未检出。且玻瓶加胶塞的样品中小粒径的不溶性微粒有显著增加,不同企业的增加幅度有较大差别(图6)。
3.2.5 渗透压摩尔浓度考察
22家企业的样品检测渗透压摩尔浓度结果分布在280~295 mOsmol/kg,均在等渗范围内(图7)。
3.2.6 无菌方法的验证
在过滤量为600 mg/膜和1000 mg/膜的情况下,与菌液对照管进行比较,在冲洗500 mL/膜时,所有验证用试验菌在供试品管、菌液对照管中均生长良好,说明冲洗500 mL/膜可消除该供试品的抑菌作用,其无菌检查法可依据中国药典2015年版四部通则1101无菌检查法薄膜过滤法进行检验,冲洗量为不少于500 mL/膜,以白色念珠菌为阳性对照菌。
4 结论
本次抽检结果显示,氟康唑氯化钠注射液的整体质量较好,法定检验的合格率为100%。有关物质分析提示氟康唑氯化钠注射液的杂质基本由原料带入,且原料中存在较多的弱极性未知杂质,所以控制原料的质量至关重要。原料企业D的质量稳定性较差,4批次的样品不合格率为50%,企业应该认真分析原因,以防再次出现不合格样品。制剂生产过程中,有厂家在软袋包装的产品出现特定未知杂质,建议企业认真追溯是否出现包材与药品不相容的问题。玻璃瓶+胶塞的样品中均测出有Si元素,应为胶塞上硅油的迁移;不同厂家的胶塞和药液接触不同程度上增加了样品中不溶性微粒风险,建议厂家应重视所使用胶塞的质量。此外,国产样品pH值分布在4.3~5.9之间,平均值为5.3;地产化样品pH值分布在6.1~6.4之间,平均值为6.2;地产化样品的pH值更趋于中性。本次评价结果提示相关企业应进一步加强生产工艺控制水平或优选原料来源,建议生产单位积极开展一致性评价工作,优化处方工艺,提升产品内在质量。
质量标准存在的问题:目前各质量标准存在有关物质标准测定方法不统一,控制的杂质种类及限度宽泛,检测方法灵敏度不够等问题;而国外药典中,美国药典USP采用多个色谱条件对氟康唑注射液(大容量和小针统一命名)的极性杂质和非极性杂质进行分别控制。建议对本品的标准进行统一提高。
氟康唑氯化钠注射液为临床治疗真菌感染一线用药,应用广泛,国内生产厂家超过100家,但从未有对国内临床实际使用产品的整体质量进行评价。本项目首次依据从全国各省市不同环节抽取到的158批次样品,开展标准检验和探索性研究,对全国氟康唑氯化钠注射液总体质量水平以及质量标准进行评价,对企业研发和生产水平提高有重要指导意义。
参考文献
[1]张迪, 李尚颖, 孙苓苓. 氟康唑胶囊的质量分析与评价[J].中南药学, 2019, 17(7): 1119-1123.
[2]万昆, 张奕奕, 周成合, 等. 抗真菌药物氟康唑研究新进展[J]. 中国抗生素杂志, 2012, 37(1): 8-15.
[3]王成刚, 刘照振, 齐麟, 等. 测定氟康唑的有关物质及特征未知杂质的方法: CN, 104764829B[P]. 2016-06-15.
[4]国家药典委员会. 中华人民共和国药典(四部)[S]. 北京: 中国医药科技出版社, 2015: 78-79.
[5]国家药典委员会. 中华人民共和国药典(四部)[S]. 北京: 中国医药科技出版社, 2015: 136-140.
