阿维菌素研究进展与产业综述
2022-05-30缑仲轩和凤李紫萱鲍叶宁张庆程曦
缑仲轩 和凤 李紫萱 鲍叶宁 张庆 程曦

摘要:阿维菌素是阿维链霉菌发酵产生的十六元大环内酯类抗生素,主结构与米尔贝霉素相似,用于农业害虫防治和动物的杀虫杀螨,还具有抗病毒、抗肿瘤、抗菌、消炎和醒酒等功效。它通过抑制RNA复制酶,阻止病毒蛋白进入细胞核以及封闭剌突蛋白等方式,阻止病毒的复制感染和传播。已经产生抗药性的分枝杆菌和金黄色葡球菌也能被阿维菌素抑制。阿维菌素世界上年需求量为5000吨左右,基本由中国企业生产。本文回顾了阿维菌素在菌种技术、发酵技术、提取技术、制剂技术发展和组合生物学手段在本产业中的应用,建议通过菌种筛选技术、胞壁通透性调整、途径工程指导的基因改造、发酵过程的代谢流控制、气升式发酵罐应用及细胞融合育种来提高发酵水平,将阿维链霉菌与米贝霉素链霉菌细胞融合育种。
关键词:阿维菌素;生物活性;产业;综述
中图分类号:R978.1+5文献标志码:A
Research advances and the industry of avermectin
Gou Zhong-xuan1,2, He Feng1, Li Zi-xuan1, Bao Ye-ning1, Zhang Qing2, and Cheng Xi3
(1 Jiangsu Food & Pharmaceutical Science College, Huaian, 223003; 2 Hebei Veyong Biochemical Co., Ltd, Shijiazhuang 050011;
3 Hebei Xingbai Pharmaceutical Group Co. Ltd, Shijiazhuang 051530)
Abstract Avermectin is a kind of 16-member macrolide antibiotics produced by Streptomyces avermectin fermentation, and is widely used in agricultural pest control, animal insecticidal, and acaricidal. Structurally, it is glycosylated milbemycin,and their genes of PKS (polyketide synthase) are highly homologous. Recent studies have found that avermectin also has anti-virus, anti-tumor, antibacterial, anti-inflammatory, sobriety, and other effects. Ivermectin (IVM) is effective against both Mycobacterium and Staphylococcus aureus strains. By means of inhibiting RNA helicase, preventing virus protein from entering nucleus, blocking virus spike protein, it can be used to deal with many kinds of viruses such as HIV, DENV, NDV, and so on. China is a major producer and exporter of avermectin, and the annual output is about 5000 tons. This paper reviews the development and technical progress of avermectin in China, discusses the toxicology, pharmacology, application, and industrial development of avermectin, summarizes the mechanism, application, and progress of various efficacy of avermectin, investigates the present situation of industry, and prospects the future development. It is suggested that improving the fermentation level by the method of strain screening technology, adjustment of cell wall permeability, genetic modification guided by pathway engineering, metabolic flow control in fermentation process, and application of airlift fermenter and so on. The protoplast fusion breeding of Streptomyces avermitilis and Streptomyces milbemycin strains may improve the strain level and produce new antibiotics.
Key words Avermectin; Biological activity; Industry; Review
阿維菌素(avermectin)是一类由阿维链霉菌(Streptomyces avermitilis)发酵产生的大环内酯类抗生素。1974 年日本北里研究所大村智从土壤样品中分离得到一株放线菌,其发酵提取液具有杀灭线虫作用。在Merk公司的努力下,1981年实现了阿维菌素的产业化。因为阿维菌素的发现,日本大村智与威廉·坎贝尔分享了2015年诺贝尔生理学和医学奖奖金的1/2(中国科学家屠呦呦教授因发现抗疟药青蒿素而获得奖金的另1/2)。1984年上海市农药研究所分离出产阿维菌素的菌株,并在海门制药厂产业化。中国农业大学1986 年开始研究阿维菌素的研究,后与齐鲁制药厂合作实现了产业化。现在全球阿维菌素年需求量大约5000T,全部由中国企业生产。笔者自 2006 年起专注于阿维菌素研究,并综述了当时阿维菌素产业概况[1]。十余年来,阿维菌素技术发展迅速,许多新的生物活性也不断地被发现。笔者在多年的研究的基础上通过业内调查与文献调研,对阿维菌素的研究及产业进行综述。
1 阿维菌素家族
1.1 阿维菌素与杀虫抗螨类化合物
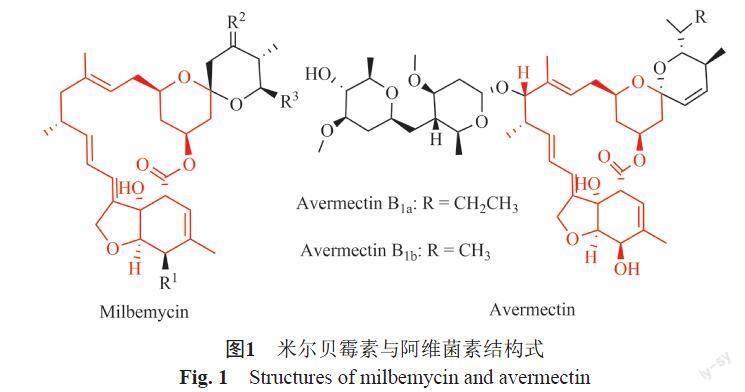
阿维菌素并不是最早发现的天然杀虫抗生素。1958年发现吸水链霉菌(Streptomyces hygroscopius)产生的潮霉素B和1967年发现的米尔贝霉素(milbemycin)都具有杀虫与杀螨作用,阿维菌素闪亮登场之后,很快成为杀虫杀螨的主角。值得注意的是,米尔贝霉素结构与阿维菌素高度相似(图 1),阿维菌素可以说是糖基化的米尔贝霉素[2]。近年来两者的姻亲关系受到关注,通过组合生物学,重组两种菌的相关基因,可直接发酵生产依维菌素[3]。
1.2 阿维菌素系列产品
以阿维菌素为母体进行修饰与改造,得了许多高效、低毒的产品。已经商品化的产品有依普菌素(Eprinomectin,EPM)、埃玛菌素(Emamectin,EMM)、道拉菌素(Doramectin,DRM)、依维菌素(Ivermectin,IVM)和 塞拉菌素(selamectin,SLM)等(图2)。阿维菌素分子中齐墩果糖C4''位的改造产生了埃玛菌素和依普菌素。埃玛菌素对温血动物的毒性更低,水溶性更好,对鳞翅目害虫特效。C4''引入乙酰氨基,即为依普菌素,乙酰氨基引入后,改变了药物在牛乳和血清中的分配比例,使得牛乳中的残留更低,更安全。阿维菌素C22与23位双键加氢即为依维菌素,依维菌素急性口服毒性更低、药效期更长、生物利用度更高、稳定性更好、活性更强。道拉菌素是利用基因突变生物合成的,它在阿维菌素C25位连接了环己烷基,具有更广的驱虫谱,对多种家畜寄生线虫有很高的防效,远优于依维菌素。2014年,海正药业对阿维菌素产生菌和米尔贝霉素生产菌基因改造,得到一株可发酵生产天维菌素(Tenvermectin)的新菌株。天维菌素对朱砂叶螨、小菜蛾、粘虫和松材线虫等的杀灭性更优。以上的衍生物主要以阿维菌素B1a为出发化合物进行的结构改造,近年来发现阿维菌素B2a的杀虫活性优于B1a,且对温血动物的毒性低于B1a,因而进行了农药登记[4]。
2 阿维菌素的生物活性研究
2.1 阿维菌素的杀虫抗螨活性
阿维菌素最初是以杀虫剂的形式商业化的,因产品由B1a(占80%)和B1b(占20%)构成,故英文名称为abamectin。与传统农药相比,abamectin杀虫活力强,易于分解,农药残留低,对环境的危害小。 阿维菌素家族中的依维菌素对服用者的急性口服毒性低、药效期更长,因而成为广谱兽用杀虫剂与人用抗寄生虫药。疟疾是由蚊子携带的疟原虫传播的一种疾病,疟原虫生活周期复杂,常常产生抗药性。依维菌素可杀灭按蚊,阻止了疟疾传播[5],它还能阻止寄生虫侵入肝脏,降低血液的疟原虫浓度,用于疟疾治疗[6],动物实验表明,依维菌素治疗中会有轻微的神经毒性反应[7]。
2.2 阿维菌素的抗菌活性
过去认为阿维菌素不过是一种杀虫剂,对微生物不起作用。2013年人们发现,阿维菌素居然对已产生抗药性的两种分枝杆菌有抑制作用[8],其杀菌机理是通过分枝杆菌特殊的细胞壁结构而起作用。阿维菌素的杀菌性能受到甘油的影响,有甘油存在的情况下,塞拉菌素、莫西菌素(moxidectin)和道拉菌素对分枝杆菌的活性大大地降低,而依维菌素受甘油的影响比较小[9]。菌膜的形成能够增强金黄色葡萄球菌的耐药性,对金黄色葡萄球菌引起的疾病治疗带来严重挑战,而依维菌素对金黄色葡萄球菌菌膜有良好的杀灭作用[10]。青霉素是最古老的一种抗生素,由于长期的使用,青霉素耐药菌成为一个棘手的问题,而依维菌素能抑制对甲氧基青霉素已有抗药性的金黄色葡萄球菌[11]。这些发现有可能开拓阿维菌素的临床应用,为新型抗菌药开发提供参考。
2.3 皮肤消炎活性
阿维菌素消炎活性研究最多的是依维菌素,它的消炎活性使得阿维菌素可能被开发成为一种皮肤消炎药。T细胞引起的皮肤发炎中,由于肥大细胞、巨噬细胞释放化学物质,作用于附近的毛细血管,导致毛细血管扩张,通透性增大,局部组织血流量增多,致使伤口周围出现红肿热的现象,即炎症反应,而依维菌素能够调节肥大细胞与巨噬细胞的免疫活性,消除炎症反应[12]。小鼠动物实验表明,外用依维菌素可以延缓皮肤粉尘螨导致的过敏炎症的发生[13]。
2.4 抗病毒活性
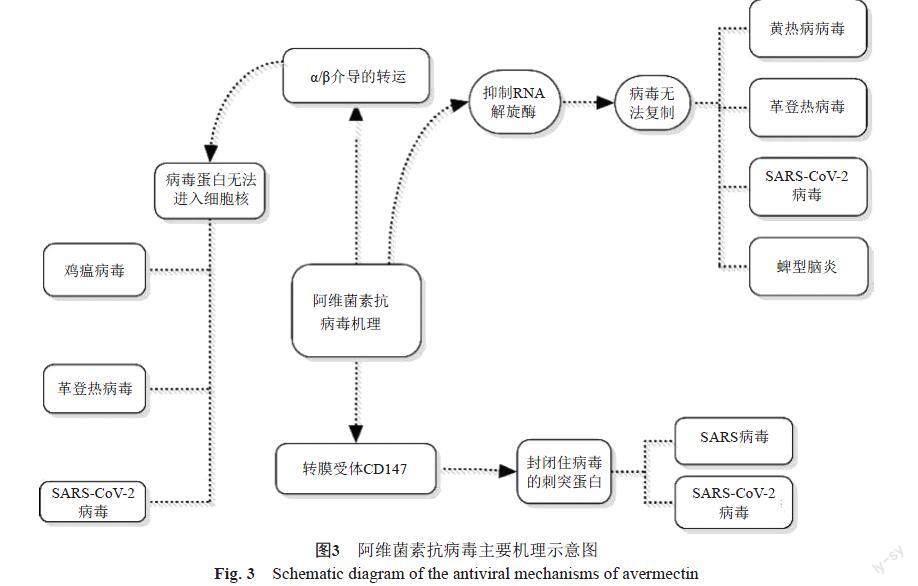
阿维菌素的抗病毒机理(图3)所示。阿维菌素能够抑制RNA解旋酶,阻止了RNA病毒的复制,因而能够用于治疗许多RNA病毒相关的疾病。以黄热病毒为例,它会引起登革热、黄热病和蜱型脑炎等疾病。为了筛选出对抗黄热病毒的药物,人们从Kunjing病毒NS3 helicase中发现了一个新的解旋蛋白位点,而依维菌素恰恰能与这个位点结合,从而阻止了病毒 RNA 的复制[14]。病毒蛋白进入细胞核是其感染复制的重要一环,依维菌素 能够阻止病毒蛋白进入细胞核,因而抑制病毒的传播。以HIV-1和登革热病毒为例,依维菌素能够抑制运输蛋白α/β介导的转运,导致病毒蛋白滞留在细胞膜与核之间,从而抑制了HIV-1和登革热病毒的复制[15]。新城鸡瘟病毒(NDV)的防治中发现,50 μg/mL 的依维菌素就具有细胞毒性,而对病毒最有效的抑制浓度是100 μg/mL以上[16],这意味着要用于NDV临床,依维菌素还需要进行某些改进。对于登革热病毒,依维菌素可以在任何一道传播途径上阻止蚊子来传播病毒[17],这使得依维菌素有可能成为一种有效预防与治疗登革热病的药物。 SARS-CoV-2病毒能引起严重急性呼吸综合症(SARS),依维菌素有可能成为一种治疗药物[18]。2020年3月6日,法国一名66岁女士因疥疮住院。医院顺理成章地使用了依维菌素(400和200 μg/kg的剂量)进行治疗。该患者3月25日SARS-CoV-2基因检测为阳性,4月7日就转阴。SARS-CoV-2传染性强,且60岁以上的老人为高危高死亡率人群,但该患者不仅自己很快地转为阴性,且其密切接触者均为阴性,这可能与她恰好使用依维菌素有關[19]。依维菌素具有广谱抗病毒活性,可抑制SARS-CoV-2感染,把病毒的感染率降低5000倍[20]。依维菌素气雾剂可能是一种治疗与预防新冠病毒的新方法[21]。依维菌素抑制SARS-CoV-2的机理尚不明确,一种推测是依维菌素能阻止病毒蛋白进入细胞核。大多数的RNA 病毒在感染时依赖于核质运输载体IMPα/β,而依维菌素能阻止其进入细胞核并启动抗病毒响应。另一种机制是通过转膜受体CD147起作用。CD147和ACE-2 是 SARS-CoV-2剌突蛋白结合位点。当SARS-CoV-刺突蛋白结合到CD147与ACE-2靶点时依维菌素可以封闭住病毒的刺突蛋白,从而阻断了病毒的感染[22]。
2.5 阿维菌素的抗肿瘤活性
抗肿瘤活性使得阿维菌素有可能重新定位为一种抗肿瘤药[23]。实验表明,依维菌素对白血病、前列腺癌、胶质母细胞瘤、卵巢癌、乳腺癌、黑色素瘤、胰腺癌和结肠癌等均有效果。阿维菌素的抗肿瘤机理是多样的(表1)。 Didier等[24]发现依维菌素可以抑制MDR,从而帮助抗肿瘤药物更好地发挥功效。另外,依维菌素在极低浓度下就可以诱导急性髓系白血病细胞的死亡,抑制了小鼠肿瘤的生长。依维菌素的作用靶点是线虫的氯离子通道,因而Sharmeen等[22]研究了依维菌素对白血病细胞氯离子流的影响,发现依维菌素提高了胞间氯离子浓度,导致细胞膜的超极化,细胞变大。依维菌素能抑制胶质母细胞瘤和HBMEC细胞Akt、mTOR 和核糖体S6的磷酸化, 说明其在Akt/mTOR pathway 的失活过程中具有抑制作用。
2.6 解酒作用
阿维菌素家族中的塞拉菌素、阿维菌素B1a、依维菌素和莫西菌素均具有解酒作用[34]。它一是降低了酒精的吸收,二是降低了大脑中的酒精浓度。实验发现,依维菌素在1.25~10 mg/kg的剂量可以减少酒精的吸收[35]。酒精滥用(alcohol use disorders, AUDs)在美国的致病率与致死率排名榜上排名第三,影响着180万人的健康,每年有10万人死于AUD,阿维菌素为这些瘾君子带来了健康的希望。
2.7 阿维菌素的毒性与副作用
与大多数药物一样,阿维菌素也存在副作用。研究依维菌素对肝巨噬细胞影响时发现,伊维菌素对肝巨噬细胞的吞噬功能无影响,但阻断了LPS诱导的肿瘤坏死因子、NO和前列腺素E2的分泌,增加了细胞内Ca2+浓度[36]。过量摄入阿维菌素会引起呼吸衰竭、血压升高与昏迷,处理不及时则会引起死亡[37]。阿维菌素药性发作时首先表现为过度兴奋,肌肉与身体不受控制地抖动,然后机能失调、昏迷。动物的P-糖蛋白受损会增强AVM的毒性。阿维菌素中依维菌素的副作用最小,且持续时间短。慢性毒性试验研究表明阿维菌素B1a最小作用量为0.25 mg/kg,致畸率的最小作用剂量为0.4 mg/kg·d。依维菌素的神经毒性在小鼠身上表现为代谢失调、行动迟缓、眼睑下垂,表现在狗身上是多涎、失调、失明、昏迷、呼吸受损、震颤、瞳孔散大、厌食和死亡。幼鼠对依维菌素的毒性更敏感,一是因为幼鼠的脑血屏障弱,二是因为幼鼠缺少P-糖蛋白。对狗而言,MDR1基因变异的狗对依维菌素的神经毒性更敏感,因为该基因的变异导致P-糖蛋白合成受到影响。
3 阿维菌素的生产技术
3.1 阿维菌素生物合成途径
阿维菌素的生物合成机理已经比较清晰,国内文献也有很好的综述[38]。简而言之,这是一个多步骤的酶促合成反应,前体物质是Val和Ile。其PKS的合成途径与红霉素、米尔贝霉素的合成过程非常相似,即首先在PKS酶催化下,乙酸盐、丙酸盐和支链脂肪酸起始单元依次聚合形成聚酮链,聚酮链内酯键环化形成起始糖苷配基。再经过一系列修饰转化为阿维菌素糖苷配基。最后再经糖基化修饰完成阿维菌素的生物合成。如图4所示,阿维菌素生物合成基因簇全长82 kb,共有18个开放读码框,米尔贝霉素的合成基因短一些,排列方向也与阿维菌素不同。这些基因的基本功能已经明确。aveA1-4 编码 PKS酶,aveB1-8编码糖基化相关的酶。米尔贝霉素没有糖基化,因而也没有B基因。阿维菌素起始酰基转移酶(AveAT0)能够以2-甲基丁酰-辅酶A和异丁酰-CoA作为起始单元分别合成“a”系列或“b”系列的阿维菌素。不同的起始酰基转移酶识别不同的底物,通过这些酰基转移酶序列比对,找到了AveAT0底物结合重要的氨基酸,为改造阿维菌素聚酮合酶酰基转移酶提供了依据[39]。
3.2 菌种技术
利用自然育种与诱变育种推动阿维菌素菌种进步的工作一直都在进行,诱变方法有NTG、紫外线、太空诱变[40]、重离子束、Co60-γ射线[41]等。邢新会教授研发的常压常温等离子体(ARTP)诱变技术也在阿维菌素育种中进行了应用[42]。江南大学集成 Qpix420微生物筛选系统、自动化移液工作站和酶标仪多孔板检测等技术,建立了高通量筛选方法[43],值得关注。高弘等[44]用96孔板代替摇瓶进行菌株的快速筛选与发酵,提高了筛选效率。在固体培养基上培养链霉菌时,抗生素开始大量合成发生在从基质菌丝向气生菌丝生长阶段;而在液体培养中抗生素合成则发生在从指数生长期过渡到稳定生长期阶段。程曦通过HPLC测定了平板上的菌落效价与摇瓶效价,发现二者高度相关,并建立了快速筛选方法[45]。链霉菌次级代谢产生抗生素的过程,受到了一系列外界营养环境信号和生理信号的复杂调控。阿维菌素的合成基因受aveR的调控,而aveR则被σhrdB识别与激活,将hrdB基因进行反向生物工程,成功地提高了阿维菌素产量[46]。
依维菌素传统工艺是将阿维菌素B1a精品在反应釜中催化加氢而产生的,现在通过组合生物合成技术学,可直接由链霉菌发酵产生依维菌素。2003年Gaisser等[47]最早报道了工程设计PKS的重组菌株具有直接合成依维菌素的能力,中国农业大学用不同的技术路线也构建了直接合成依维菌素的菌株[3]。米尔贝霉素是与阿维菌素结构类似的杀虫药物,用来自冰城链霉菌米尔贝霉素PKS模块2的DH-ER-KR替换aveDH2-KR2的新菌株可直接发酵生产依维菌素,其效价可达3450 μg/mL[2]。
3.3 发酵技术
阿维菌素的发酵进展主要体现在发酵品种增加、
发酵效价提高,发酵罐容积扩大,其核心是提高产能,降低成本。阿维菌素刚刚投入生产时,发酵后提取的也是阿维菌素8种成份的混和物,当时也是用总效价来衡量发酵水平。20多年来,发酵罐容积从70 t发展到500 t,发酵单位从200单位到6000单位,发酵时间从当初的50 h发展到360 h。阿维菌素发酵使用的是机械搅拌式发酵罐,LIGHGTINA315 和CD-6的组合搅拌装置最有利于菌体形成致密的菌丝团,利于阿维菌素的发酵[48]。阿维链霉菌的生长温度与产素温度并不完全相同,赵乐等[49]采用变温控制来改善发酵效率,结果发酵液平均效价提高18.7%。阿维菌素发酵过程存在着泡沫问题,影响装液量,并可能造成染菌。企業常用的消泡方法是化学法(豆油或泡敌等)和物理法(耙式消泡桨)。一种基于泡沫旋风分离与发酵尾气再回收相结合原理的新型阻沫回收分离器的应用,使得装料体积增加22.47%[50]。程曦等[51]研究了生产线上发酵罐的最佳液位,发现液位控制在96%,并控制好合适的风量,发酵效价最高可达6758 μg/g。通过补料技术控制pH与糖浓度可以提高发酵的水平,李永亮[52]优化了补料技术,使产能提高了28%以上。阿维菌素发酵过程中还常常采用带放工艺,它提高了设备产能,增加阿维菌素发酵放罐体积[34]。笔者曾在某企业偶遇发酵罐轴故障。该罐仅靠无菌空气来维持传质,但其发酵单位并不低于其它正常搅拌的发酵罐,因而气升式发酵罐可能更适合于阿维菌素的发酵。
3.4 提取纯化技术
阿维菌素发酵结束后,经过升温灭活、过滤、闪蒸、浸提、浓缩、高温水洗残糖、活性碳脱色、结晶等步骤,最后得到阿维菌素B1a的粗品(图5)。阿维菌素菌丝体提取过程中也有用超声波来提高浸提效率的研究,超声波循环提取设备的一次提取率可高达96%以上[54]。也有改进溶剂用超声波辅助直接从湿菌丝体浸提阿维菌素的新工艺[55],但未见投入应用。粗品二次溶解后,再结晶得到阿维菌素的精品。二次晶的质量直接决定着最终产品的质量,企业对于这一步工艺实行严格的保密措施,因而重结晶技术的公开报道并不多见。中科院过程所分离科学与工程实验室曾公开报道了阿维菌素重结晶技术研究成果,值得借鉴与参考[56]。
4 阿维菌素的应用
4.1 农药的应用
阿维菌素是高毒农药,无致畸、致癌、致突变作用,内吸性不佳,触杀毒性一般。好在它对叶片具有很强的渗透性,喷洒到植物上后,作物会吸收药剂,使药液遍布整株作物。这样害虫吃后会中毒死亡,同时它还能抑制新生的幼虫潜入叶内。现主要用于蔬菜、水稻、棉花、茶树、果树以及园林花卉的杀虫、杀螨。随着阿维菌素的应用,害虫的抗药性随之产生,因而建议联合用药。制剂技术可以提高阿维菌素的药效,制剂的发展方向是水基化、超微化、无粉尘、控制释放。
阿维菌素对哺乳动物的繁殖能力具有毒性作用,中毒后没有特效解毒药物,只能采取吸氧、洗胃、补液、利尿等措施。因而,国际上对阿维菌素的 MRL(maximum residue limit)要求非常严格。阿维菌素对光敏感,C8-C9和C10-C11位的双键会吸收紫外线能量而分解破坏。阿维菌素还易于被土壤吸附,不易被雨水冲刷和下渗,因而对水质影响不大。
4.2 兽药的应用
1981年美国Merk公司把阿维菌素作为兽药投入市场,用做家畜驱虫剂与宠物用药,治疗多种家畜体内外寄生虫病。阿维菌素是脂溶性药物,无论是口服、皮下注射、还是肠道给药,均吸收良好,并分布至全身各组织,能充分地发挥其驱虫杀虫效果。单就吸收速率而言,口服效果明显比皮下注射快。但皮下注射在体内持效时间长,所以生物利用度比口服高。常用的有依维菌素、道拉菌素和乙酰氨基阿维菌素等[57]。由于阿维菌素的脂溶性,在动物体内存留时间长,使用阿维菌素产品的肉食饲养动物屠宰前的休药期更长。
4.3 人用药的应用
阿维菌素的杀虫杀螨功能在人用药方面已有应用。依维菌素在1988年首先成功地用于治疗盘尾虫病和淋巴丝虫病[58],后来还用于治疗线虫感染、蛔虫和皮肤寄生虫病。对登革热、疟疾疫区而言,阿维菌素是一种有效的药物[59]。因为它的抗肿瘤、消炎、抗病毒作用,未来有可能以阿维菌素为先导化合物,开发出更多的抗肿瘤药物、皮肤过敏消炎药物、抗病毒药物等,可能会推动基于阿维菌素的SARS-CoV-2的抑制药物的研发。由于阿维菌素对HIV的抑制作用,也可能应用于艾滋病鸡尾酒疗法中。
5 阿维菌素的产业展望
5.1 生产企业与产能
阿维菌素主要产自中国。中国现在有10余家企业发酵生产阿维菌素,产能充足。2010 年4月,中国13家阿维菌素生产企业成立了阿维菌素产业联盟,希望通过产能控制与技术协作来保护阿维菌素产业,相约轮流做东每年召开一次年会,遗憾的是该年会只持续了两届。阿维菌素产品协作组是由中国农药工业协会组织的,一直在运转与协作交流。主要的阿维菌素生产企业如表2所示,阿维菌素原药主要来自于表2中的前五家。2018年12月,河北省批准成立了河北省阿维菌素生物技术重点实验室,依托单位是河北兴柏农业科技有限公司,相信在科技的支持下,阿维菌素产业会不断地茁壮成长。
5.2 市场需求与价格
阿维菌素B1a原料一部分用于依维菌素、甲维盐的合成,一部分用于农药制剂的配制。其价格受市场与病虫害的影响很大,阿维菌素B1a精品一般在500~1200 元/kg之间,最低价500元基本是企业的保本线。国内阿维菌素产品的第一出口国是美国,占出口量的30%以上。阿维菌素的需要量受自然因素影响比较大,即使在避光的情况下,阿维菌素原料药长期贮存过程中也会缓慢分解,影响产品质量。因而,阿维菌素企业不可能通过大量地生产与贮存阿维菌素来对抗市场风险,现行的做法是生产其它的发酵品种来抵御市场风险。
5.3 展望与研究建议
放线菌所产抗生素的90%由链霉菌产生,链霉菌中研究最为透彻的菌株是天蓝色链霉菌、灰色链霉菌和阿维链霉菌,这3株菌的全基因组测序已经完成,为后续的基因改造铺平了道路。预计未来阿维链霉菌可作为一个宿主菌来生产越来越多的抗生素。例如端粒酶抑素是一种抗肿瘤物质,本由 Streptomyces annulatusv发酵生产,2017年通过转基因改造后,由Streptomyces avermitilis生产[60]。
对于阿维菌素发酵技术的提升给出以下建议: ①改变细胞通透性来提高阿维菌素物发酵水平。阿维菌素是一种胞内产物,大量积累会反馈影响发酵水平。通过特殊控制方法来改变细胞通透性,使阿维菌素部分分泌到细胞外,消除反馈抑制,很有可能提高阿维菌素的产量。②在菌种的筛选过程中,向固体培养基中加入阿维菌素,筛选耐受高浓度阿维菌素的菌株。加入阿维菌素发酵液,筛选对阿维菌素代谢产物有耐受性的菌株。通过加入阿维菌素前体来推理育种,筛选高产菌株。③借鉴天蓝色链霉菌的次级代谢调控研究成果[61],对阿维链霉菌进行基因改造。链霉菌次级代谢具有一定的复杂性,简单的代谢途径基因改造往往不能奏效。以天蓝色链霉菌为对象的次级代谢调控取得了很多的进展,借鉴这些调控机制来改造阿维链霉菌基因可能会事半而功倍。④利用多参数在线传感器监控代谢过程的代谢流的变化,通过营养成份与理化指标的控制来调整代谢流,提升阿维菌素的产量。⑤在发酵设备上,建议研究气升式发酵设备进行阿维菌素的生产。阿维链霉菌对剪切力敏感,机械搅拌对菌丝球破坏较大,而气升式發酵罐剪切力小,可能更适合阿维链霉菌发酵。⑥化学结构上米尔贝霉素与阿维菌素高度相似,也都是链霉菌发酵生产的。因此建议把阿维链霉菌与Streptomyces milbemycinicus进行细胞融合育种,这样有可能提高阿维菌素或米尔贝霉素的产量,也有可能筛选出新的抗生素品种。
阿維菌素的替代品种是多杀菌素,由美国陶氏益农公司生产,与阿维菌素相比,多杀菌素是低毒的生物杀虫剂,适合无公害蔬菜、水果生产应用,目前还不能完全取代阿维菌素。而阿维菌素在抗肿瘤、抗菌、抗病毒等活性的发现必然促使阿维菌素的重新定位,相信未来的阿维菌素产品会更丰富,应用会更广泛。
参 考 文 献
[1]缑仲轩. 阿维菌素产业的现状与展望[J]. 农化新世纪, 2007, 12: 20-1.
[2]Zhang J, Yan Y J, An J, et al. Designed biosynthesis of 25-methyl and 25-ethyl ivermectin with enhanced insecticidal activity by domain swap of avermectin polyketide synthase[J]. Microb Cell Fact, 2015, 14(1): 152.
[3]Li M, Chen Z, Lin X, et al. Engineering of avermectin biosynthetic genes to improve production of ivermectin in Streptomyces avermitilis[J]. Bioorg Med Chem Lett, 2008, 18(20): 5359-5363.
[4]Fangfang H, Huan L, Jiao L, et al. Synthesis, bioactivities and 3D-QSAR of novel avermectin B2a aglycon derivatives[J]. Chinese Chemical Letters, 2020, 31(1): 141-144.
[5]Dhiman S. Correction to: Are malaria elimination efforts on right track? An analysis of gains achieved and challenges ahead[J]. Infect Dis Poverty, 2019, 8(1): 19.
[6]Slater H C, Foy B D, Kobylinskik K, et al. Ivermectin as a novel complementary malaria control tool to reduce incidence and prevalence: A modelling study[J]. Lancet Infect Dis, 2020, 20(4): 498-508.
[7]Chaccour C, Rabinovich N R. Ivermectin to reduce malaria transmission III. Considerations regarding regulatory and policy pathways[J]. Malar J, 2017, 16(1): 162.
[8]Lim L E, Vilcheze C, NG C, et al. Anthelmintic avermectins kill Mycobacterium tuberculosis, including multidrug-resistant clinical strains[J]. Antimicrob Agents Chemother, 2013, 57(2): 1040-1046.
[9]Miro-Canturri A, Ayebre-Algaba R, Smani Y. Drug repurposing for the treatment of bacterial and fungal infections[J]. Front Microbiol, 2019, 10(1): 41.
[10]Torrens N S, Abercrombie J J, Srinivasan A, et al. Screening a commercial library of pharmacologically active small molecules against Staphylococcus aureus biofilms[J]. Antimicrob Agents Chemother, 2016, 60(10): 5663-5672.
[11]Ashraf S, Chaudhry U, Raza A, et al. In vitro activity of ivermectin against Staphylococcus aureus clinical isolates[J]. Antimicrob Resist Infect Control, 2018, 27(7): 1-6.
[12]Norenberg W, Sobottka H, Henpel C, et al. Positive allosteric modulation by ivermectin of human but not murine P2X7 receptors[J]. Br J Pharmacol, 2012, 167(1): 48-66
[13]Ventre E, Rozieres A, Lenief V, et al. Topical ivermectin improves allergic skin inflammation[J]. Allergy, 2017, 72(8): 1212-1221.
[14]Eloise M, Margherita P, Tine D B, et al. Ivermectin is a potent inhibitor of flavivirus replication specifically targeting NS3 helicase activity: New prospects for an old drug[J]. J Antimicrob Chemother, 2012, 67(8): 1884-1894.
[15]M W K, Haran S, M H S, et al. Ivermectin is a specific inhibitor of importin α/β-mediated nuclear import able to inhibit replication of HIV-1 and dengue virus[J]. The Biochemical journal, 2012, 443(3): 851-856.
[16]Sidra A, Muhammad A, Adil R M, et al. Evaluation of cytotoxicity and antiviral activity of ivermectin against Newcastle disease virus[J]. Pak J Pharm Sci, 2015, 28(2): 597-602.
[17]Xu T-L, Han Y, Liu W, et al. Antivirus effectiveness of ivermectin on dengue virus type 2 in Aedes albopictus[J]. PLOS Neglect Trop Dis, 2018, 12(11): 1-14.
[18]Anastasiou I A, Eleftheriadou I, Tentoloutris A, et al. In vitro data of current therapies for SARS-CoV-2[J]. Curr Med Chem, 2020, 27(27): 4542-4548.
[19]Bernigaud C, Guillemot D, Ahmed -Beiklacea A, et al. Oral ivermectin for a scabies outbreak in a long-termcare facility: Potential value in preventing COVID-19 and associated mortality?[J]. Br J Dermatol, 2021, 1(1): 1-14.
[20]Caly L, Druce J D, Catton M G, et al. The FDA-approved drug ivermectin inhibits the replication of SARSCoV-2 in vitro[J]. Antiviral Res, 2020, 178(6): 104787.
[21]Mittal N, Mittal R. Inhaled route and anti-inflammatory action of ivermectin: Do they hold promise in fighting against COVID-19[J]? Med Hypotheses, 2021, 146(1): 110364.
[22]Kaur H, Shekhar N, Sharma S, et al. Ivermectin as a potential drug for treatment of COVID-19: An in-sync review with clinical and computational attributes[J]. Pharmacol Rep, 2021, 1(1): 1-14.
[23]Juarez M, Schcolnik-Cabrera A, Duenas-Gonzalez A. The multitargeted drug ivermectin: From an antiparasitic agent to a repositioned cancer drug[J]. Am J Cancer Res, 2018, 8(2): 317-331.
[24]Didier A, Loor F. The abamectin derivative ivermectin is a potent P-glycoprotein inhibitor[J]. Anticancer Drugs, 1996, 7(7): 745-751
[25]Sharmeen S, Skrtic M, Sukhai M A, et al. The antiparasitic agent ivermectin induces chloride-dependent membrane hyperpolarization and cell death in leukemia cells[J]. Blood, 2010, 116(18): 3593-3603.
[26]Liu Y, Fang S, Sun Q, et al. Anthelmintic drug ivermectin inhibits angiogenesis, growth and survival of glioblastoma through inducing mitochondrial dysfunction and oxidative stress[J]. Biochem Biophys Res Commun, 2016, 480(3): 415-421.
[27]Draganov D, Gopalakrishna-Pillai S, Chen Y R, et al. Modulation of P2X4/P2X7/Pannexin-1 sensitivity to extracellular ATP via Ivermectin induces a non-apoptotic and inflammatory form of cancer cell death[J]. Sci Rep, 2015, 5: 16222.
[28]Dou Q, Chen H N, Wang K, et al. Ivermectin induces cytostatic autophagy by blocking the PAK1/Akt axis in breast cancer[J]. Cancer Res, 2016, 76(15): 4457-4469.
[29]Takahashi K, Suzuki K. Membrane transport of WAVE2 and lamellipodia formation require Pak1 that mediates phosphorylation and recruitment of stathmin/Op18 to Pak1-WAVE2-kinesin complex[J]. Cell Signal, 2009, 21(5): 695-703
[30]Melotti A, Mas C, Kuciak M, et al. The river blindness drug Ivermectin and related macrocyclic lactones inhibit WNT-TCF pathway responses in human cancer[J]. EMBO Mol Med, 2014, 6(10): 1263-1278.
[31]Kwon Y J, Petrie K, Leibovitch B A, et al. Selective inhibition of SIN3 corepressor with avermectins as a novel therapeutic strategy in triple-negative breast cancer[J]. Mol Cancer Ther, 2015, 14(8): 1824-1836.
[32]Yin J. DEAD-box RNA helicase DDX23 modulates glioma malignancy via elevating miR-21 biogenesis[J]. Brain, 2015, 138(Pt 9): 2553-2570.
[33]Juarez M, Díaz-Chávez J, Gonzalez-Fierro A, et al. Ivermectin as an inhibitor of cancer stemlike cells[J]. Mol Med Rep, 2018, 17(2): 3397-3403.
[34]Jakowec M W, Warnecke A M P, Huynh N, et al. Preclinical evaluation of avermectins as novel therapeutic agents for alcohol use disorders[J]. Psychopharmacology, 2018, 235(6): 1697-709.
[35]Asatryan L, Yardley M M, Khoja S, et al. Avermectins differentially affect ethanol intake and receptor function: Implications for developing new therapeutics for alcohol use disorders[J]. Int J Neuropsychopharmacol, 2014, 17(6): 907-916.
[36]Viktorov A V, Yurkiv V A. Effect of ivermectin on function of liver macrophages[J]. Bull Exp Biol Med, 2003, 136(6): 569-571.
[37]Yang C C. Acute human toxicity of macrocyclic lactones[J]. Curr Pharm Biotechnol, 2012, 13(6): 999-1003.
[38]文瑩, 张立新. 阿维菌素的中国“智”造[J]. 遗传, 2018, 40(10): 888-899.
[39]李海伟, 张法, 郑舰艇. 阿维菌素起始酰基转移酶的底物特异性[J]. 微生物学通报, 2020, 47(1): 190-199.
[40]苏维, 吕志堂, 王洪滨, 等. 飞船搭载菌株的阿维菌素B1a组分分析[J]. 河北大学学报(自然科学版), 2006, 26(1): 54-57.
[41]徐丽, 张怡轩, 王勇, 等. Co60γ射线照射技术在阿维菌素产生菌诱变育种中的应用[J]. 安徽农业科学, 2007, 35(13): 3797-3739.
[42]田萍萍, 曹鹏, 常传友, 等. 阿维菌素生产菌的常压室温等离子体诱变育种及培养基优化[J]. 微生物学通报, 2017, 44(1): 150-160.
[43]Cao X, Luo Z, Zeng W, et al. Enhanced avermectin production by Streptomyces avermitilis ATCC 31267 using high-throughput screening aided by fluorescence-activated cell sorting[J]. Appl Microbiol Biotechnol, 2018, 102(2): 703-712.
[44]Gao H, Liu M, Zhou X, et al. Identification of avermectin-high-producing strains by high-throughput screening methods[J]. Appl Microbiol Biotechnol, 2010, 85(4): 1219-1225.
[45]程曦, 刘丽虹, 刘进峰, 等. 单菌落效价测定在阿维菌素菌种筛选中的应用研究[J]. 现代农业科技, 2020, 12: 129-130.
[46]Zhuo Y, Zhang W, Chen D, et al. Reverse biological engineering of hrdB to enhance the production of avermectins in an industrial strain of Streptomyces avermitilis[J]. PNAS, 2010, 107(25): 11250-11254.
[47]Gaisser S, Kellenberger L, Kaja A L, et al. Direct production of ivermectin-like drugs after domain exchange in the avermectin polyketide synthase of Streptomyces avermitilis ATCC31272[J]. Org Biomol Chem, 2003, 1(16): 2840-2847.
[48]陈万河, 王普, 刘亮, 等. 不同搅拌器型式对阿维菌素发酵的影响[J]. 浙江工业大学学报, 2009, 37(3): 52-56.
[49]赵乐, 郝艳阳, 马志斌, 等. 变温控制工艺在阿维菌素发酵中的应用[J]. 科技资讯, 2011, 10): 209-210.
[50]武威, 楊励, 郭美锦. 阻沫回收分离器在阿维菌素发酵中的应用[J]. 中国抗生素杂志, 2011, 36(3): 187-190.
[51]程曦, 刘进峰, 刘丽虹, 等. 液位控制对阿维菌素发酵效价的影响研究[J]. 南方农业, 2019, 13(30): 121-122.
[52]李永亮, 杨玉淮, 邹球龙, 等. 阿维菌素发酵补料工艺的研究[J]. 中国抗生素杂志, 2011, 36(7): 515-518.
[53]程曦, 刘丽虹, 刘进峰, 等. 半连续发酵对提高阿维菌素放罐体积的影响[J]. 化学与生物工程, 2021, 38(1): 60-64.
[54]王斓, 周丽莉, 礼彤, 等. 超声波提取阿维菌素 B1a 的工艺[J]. 沈阳药科大学学报, 2007, 24(3): 182-185.
[55]郭鸿雁. 使用“M 溶剂”提取阿维菌素技术的研究[J]. 石油化工应用, 2016, 35(1): 122-124.
[56]Liu J, Chang Z, Sun X, et al. Impurity effects on the crystallization of avermectin B1a[J]. J Crystal Growth, 2006, 291(2): 448-454.
[57]蔡进忠, 李春花, 雷萌桐, 等. 牦牛主要寄生虫病高效低残留防治技术试验示范[J]. 青海畜牧兽医杂志, 2020, 50(1): 16-21.
[58]Fox L M. Ivermectin: uses and impact 20 years on[J]. Curr Opin Infect Dis, 2006, 19(6): 588-593.
[59]Xu T L, Han Y, Liu W, et al. Antivirus effectiveness of ivermectin on dengue virus type 2 in Aedes albopictus[J]. PLoS Negl Trop Dis, 2018, 12(11): e0006934.
[60]Amagai K, Ikeda H, Hashimoto J, et al. Identification of a gene cluster for telomestatin biosynthesis and heterologous expression using a specific promoter in a clean host[J]. Sci Rep, 2017, 7(1): 3382.
[61]陈允亮, 杨云鹏, 李国权, 等. 天蓝色链霉菌中抗生素合成相关双组分调控系统 AfsQ1/Q2 上游信号传导机制的研究[J]. 生物化学与生物物理进展. 2021,48(4): 450-464.
