子宫内膜癌免疫治疗的进展及现状*
2022-05-30吴倩华李碧岚
吴倩华,李碧岚
(1.同济大学医学院,上海 200092;2.同济大学附属第一妇婴保健院,上海 200092)
子宫内膜癌(endometrial cancer,EC)是发生于子宫内膜的一组上皮性恶性肿瘤,为女性生殖道三大恶性肿瘤之一。根据国际癌症研究机构(IARC)发布的全球癌症报告统计,2020年全世界范围内185个国家总的内膜癌新发病例为417367例,在女性新发癌症病例数(约9200万)中占4.5%,排名第七,在女性生殖道恶性肿瘤中仅次于宫颈癌(新发病例604127例,6.5%)[1]。目前内膜癌的治疗是结合国际妇产科协会(FIGO)分期及分子分型来制定,以手术治疗为主,术后辅助放疗、化疗等综合治疗。尽管大多数内膜癌可以在早期诊断和治疗,并且预后较好,但部分内膜癌发现时已经发生子宫外转移,难以通过放化疗等取得较满意的治疗效果。此外,随着我国三胎政策的放开,以及女性平均生育年龄的推迟,年轻内膜癌患者尚未完成生育计划而期望保留生育功能,因此需要更加精准的内膜癌治疗方式。
近十几年来,免疫治疗的研究发展迅速,已成为肿瘤治疗的新热点,《Science》更是将肿瘤免疫治疗列入2013年科学十大突破之首。研究表明,在内膜癌中,免疫治疗对于分子分型为MSI-H患者的有效率为57%[2],有望成为继手术、化疗、放疗、肿瘤靶向治疗等传统治疗方式后的新一代的肿瘤治疗方式,亦为内膜癌患者提供了新的治疗方案的选择。
1 肿瘤微环境
肿瘤微环境(tumor microenvironment,TME)是肿瘤细胞生存的基本场所,由肿瘤细胞、免疫细胞、基质细胞、细胞外基质、炎症介质和间质组织等组成[3]。肿瘤微环境中的成分在肿瘤细胞的生长和生存、侵袭、转移、血管生成、炎症及免疫调节等方面发挥重要作用,对肿瘤化疗耐受性和临床治疗结局有显著影响。肿瘤微环境中的不同细胞在肿瘤的发生及进展过程中发挥着不同的作用。
1.1 免疫细胞 内膜癌间质中浸润有大量的免疫细胞及相关炎性因子,对内膜癌的生物学行为有明显的影响。
1.1.1 细胞毒性T淋巴细胞 CD8+细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)是适应性免疫应答的重要部分,通过其表面的T细胞受体(T cell receptor,TCR)识别感染或损伤细胞表达的与MCH-I类分子结合的抗原。CTL免疫应答由专业抗原提呈细胞(antigen presenting cell,APC)启动,通过抗原与MCH-I类分子结合,与CD4+Th1细胞的共刺激信号维持作用,从而产生有效的细胞溶解反应[4]。有研究发现,内膜癌中复发性JAK1基因缺陷可减少MHC-I类复合物向CTL提呈肿瘤抗原[5]。
1.1.2 调节性T细胞 调节性T细胞(regulatory T cell,Treg)是对机体进行免疫负调控的一类T细胞亚群,在细胞核中特异表达转录因子FoxP3,在细胞表面特异表达CD25,它在建立和维持免疫耐受中发挥重要作用[6]。有研究发现,在内膜样腺癌患者中,Treg细胞/CD4+T细胞的比值明显高于健康女性,表明免疫抑制Treg细胞数量的增加可能是内膜癌免疫耐受的原因之一[7]。
1.1.3 自然杀伤细胞 自然杀伤细胞(natural killer cell,NK)是介导肿瘤免疫监视的免疫细胞的重要组成部分。在树突状细胞分泌的趋化因子的引导下,NK细胞向炎症或肿瘤组织中作定向移动。NK细胞可以分泌促炎细胞因子和趋化因子(如干扰素-γ、肿瘤坏死因子、白细胞介素-6、粒细胞集落刺激因子和趋化因子CCL5)来促进抗肿瘤活性[8]。有研究发现,内膜癌肿瘤浸润处NK细胞缺乏,CD103+NK细胞表达共抑制分子(如Tigit和TIM-3)增加,趋化因子(CXCL12、IP-10和CCL27)和细胞因子(IL-1β和IL-6)在肿瘤微环境中都发生了改变,结果证实了肿瘤微环境降低了固有NK细胞的细胞毒性这一假设[9]。
1.1.4 巨噬细胞 巨噬细胞由单核细胞转化而来,是肿瘤微环境中重要的免疫细胞类型,它存在两种极化状态:经典激活的巨噬细胞(M1型)产生促炎细胞因子和活性氧/氮物质,它们对宿主防御和杀死肿瘤细胞至关重要,在一定程度尚发挥肿瘤拮抗作用;交替激活的巨噬细胞(M2型)产生抗炎细胞因子并参与炎症的消退,抑制对肿瘤细胞的免疫监视,诱导血管生成和基质重塑,促进肿瘤的进展和转移[10]。有研究发现,内膜癌组织中M2型巨噬细胞的浸润数目明显高于正常内膜组织,并且与高级别分级、分期较晚、淋巴结转移和脉管浸润有关,表明M2型巨噬细胞的浸润与内膜癌进展可能有一定关系[11]。
1.1.5 树突状细胞 树突状细胞(dendritic cell,DC)是专业抗原提呈细胞,它们捕获外来抗原并呈现给T细胞和B细胞以激活淋巴细胞,DC是诱导适应性免疫系统最有效的免疫细胞。肿瘤微环境能影响DC的发育、功能和迁移,从而避免强的适应性免疫反应。有研究发现,在内膜癌的不同免疫亚型中,CD8+T细胞、NK细胞和DC细胞的数量与内膜癌患者的总生存期显著相关[12]。
1.1.6 中性粒细胞 中性粒细胞在肿瘤发生进展中具有两面性:一方面,中性粒细胞对肿瘤细胞具有毒性作用,另一方面,中性粒细胞可诱导肿瘤增殖和血管生成,促进肿瘤转移。有研究发现,内膜癌患者中性粒细胞在NF-κB依赖信号中炎症和血管生成细胞因子的表达存在差异,表明中性粒细胞可能在内膜癌进展过程中获得促肿瘤功能[13]。
1.1.7 B细胞 B细胞是一个具有不同功能亚群的异质性群体,不同亚群之间的平衡影响肿瘤的发展。一方面,B细胞通过产生天然抗肿瘤抗体和诱导细胞毒性免疫反应来发挥抗肿瘤作用,另一方面,B细胞可能通过多种机制促进肿瘤的进展[14]。有研究发现,调节性B细胞(regulatory B cells,Bregs)升高是影响内膜癌患者病情及预后的独立危险因素,Bregs细胞可作为判断内膜癌患者病情及预后的标志物,具有一定的临床意义[15]。
1.1.8 髓源性抑制细胞 髓源性抑制细胞(myeloid-derived suppressor cells,MDSCs)是感染、肿瘤等病理条件下产生的一种异质性细胞群,来源于骨髓祖细胞和未成熟髓细胞,由粒细胞或多形核MDSCs(PMN-MDSCs)和单核细胞MDSCs(M-MDSCs)组成[16]。MDSCs通过多种机制以抗原特异性和非特异性两种方式抑制T细胞,促进肿瘤进展。有实验观察到内膜癌患者中MDSCs数量明显增加,抑制MDSCs的肿瘤促进作用有助于开发最佳的MDSCs靶向治疗内膜癌[17]。
1.2 基质细胞
1.2.1 内皮细胞 血管内皮细胞和淋巴内皮细胞是微环境的两种组成部分,肿瘤血管作为血液供应到肿瘤的滋养通道,对肿瘤生长和血源性肿瘤传播都很重要,淋巴管是淋巴性肿瘤传播的必要条件。研究发现,早期内膜癌患者外周血内皮祖细胞明显增多,循环内皮细胞与正常对照组相似,表明招募内皮祖细胞的新生血管主要在内膜癌进展早期形成[18]。
1.2.2 成纤维细胞 成纤维细胞在肿瘤微环境中转变为癌相关成纤维细胞(carcinoma-associated fibroblasts,CAFs),CAFs是表达α-SMA的成纤维细胞。CAFs除了具有促进肿瘤生长的作用外,还能调节免疫细胞的募集[19]。在内膜癌中,CAFs参与调节肿瘤细胞的生长和相关表型的转移,参与阻碍免疫防御和逃避免疫监视,并通过肿瘤细胞-CAFs相互作用来介导耐药性的产生[20]。
1.3 细胞外基质 细胞外基质(extracellular matrix,ECM)在肿瘤环境下不断降解和重构,CAFs出于致瘤目的而调节ECM成分,癌细胞的增殖、迁移、侵袭及血管生成都是ECM降解和重构的结果。ECM介导的TGF-β信号途径在人类内膜癌转移中发挥了重要作用[21]。
2 肿瘤免疫治疗原理
免疫系统可以通过免疫防御、免疫监视来发挥抗肿瘤效应,阻止肿瘤的发生并清除肿瘤;而肿瘤细胞则可负性调控免疫系统,通过各种不同机制产生免疫耐受或免疫逃逸,从而导致肿瘤的形成,并进一步促进肿瘤的恶性进展。肿瘤细胞产生免疫逃逸的机制主要以下几种:(1)肿瘤细胞表面抗原的免疫原性较弱,不能有效激活机体免疫系统应答[22];(2)肿瘤细胞表面免疫检查点的表达,导致T细胞的功能紊乱或低反应性,T细胞活性受到抑制,从而逃逸免疫[23];(3)肿瘤微环境中免疫抑制性细胞的存在,抑制机体免疫系统对肿瘤细胞的反应[24];(4)肿瘤细胞释放酸性和毒性代谢产物来抑制免疫细胞的活性,产生逃逸免疫[25]。肿瘤的免疫治疗主要是利用肿瘤微环境的免疫细胞对癌细胞进行特异性识别和攻击,理论上来看,免疫治疗具有更高的特异性和更低的副作用。
3 内膜癌的免疫治疗
2013年,美国癌症基因组图谱计划(TCGA)根据基因组特征分析提出了新的内膜癌分子分型,该分型将内膜癌分成4种类型:POLE超突变型(POLE ultramutated)、微卫星不稳定型(microsatellite instability,MSI)、低拷贝数型/微卫星稳定型(copy-number low/microsatellite stability,MSS)和高拷贝数型(copy-number high)。2020年3月,美国国立综合癌症网络(NCCN)首次推荐TCGA内膜癌分子分型并将其纳入内膜癌的诊治指南,这预示着基于新的分子分型的内膜癌的免疫治疗将更多地应用到临床治疗中,将有更多的内膜癌患者从中受益。内膜癌的免疫治疗具有广阔的应用前景,目前已知的免疫治疗方式主要包括免疫检查点抑制剂、CAR-T细胞疗法、癌症疫苗。
3.1 免疫检查点抑制剂 免疫检查点(免疫共抑制)是指进入免疫系统的大量抑制通路,这些通路对于维持自身耐受性和调节外周组织中生理免疫反应的持续时间和幅度以最大限度地减少组织损伤至关重要[26]。免疫检查点经常过表达于肿瘤细胞或肿瘤微环境中的其他细胞,其作用是使免疫系统不能产生有效的抗肿瘤应答。肿瘤选择某些细胞上的免疫检查点途径作为产生免疫抵抗的主要机制,尤其是针对肿瘤抗原特异性的T细胞[27]。许多免疫检查点是由配体-受体相互作用启动的,因此很容易被抗体阻断或被重组形式的配体或受体调节。免疫检查点抑制剂可以逆转机体的免疫抑制,激活免疫细胞的抗肿瘤作用,从而达到肿瘤免疫治疗的效果。然而,免疫检查点抑制剂亦可导致免疫自我耐受的破坏,从而导致一种新的影响多种器官的自身免疫/自身炎症副作用综合征,称为“免疫相关不良事件(immune-related adverse events,irAEs)”,包括风湿性疾病、内分泌疾病、肝炎、皮疹、腹泻、疲劳等,irAEs事件的发生可能反映了T细胞的活化增强是不可预测的、异质的,在某些情况下甚至是永久性、危及生命的[28]。目前临床上常见的免疫检查点抑制剂,主要包括PD-1/PD-L1抑制剂和CTLA-4抑制剂。
3.1.1 PD-1/PD-L1抑制剂 程序性细胞死亡受体-1(programmed death-1,PD-1)是一种重要的免疫抑制性受体,属于CD28/CTLA-4家族,它有两个配体,分别是PD-L1和PD-L2。PD-1主要表达于活化的T细胞、B细胞、NK细胞等免疫细胞膜表面,发挥免疫抑制效应,其配体PD-L1常高表达于各种肿瘤细胞表面,PD-L2表达于DC细胞和巨噬细胞。在肿瘤侵袭时,PD-L1特异性结合肿瘤浸润T淋巴细胞上的PD-1,通过激活PD-1/PD-L1下游通路,使T细胞的增殖和分化功能失活,从而降低机体清除肿瘤细胞的能力,导致肿瘤细胞免疫逃逸[29]。PD-1和PD-L1抑制剂通过阻断PD-1/PD-L1结合,阻断负向调控信号,重新激活免疫反应,增强免疫应答,发挥抗肿瘤作用。Eggink等[30]研究结果显示,POLE超突变型和MSI型内膜癌组织中PD-1表达率分别为73%和69%,PD-L1表达率分别为100%和71%。Sloan等[31]研究显示,DNA错配修复基因缺陷型(mismatch repair deficient,dMMR)内膜癌组织的PD-L1表达率为100%,MMR完整型(mismatch repair proficient,pMMR)内膜癌的PD-L1表达率为66%。这表明POLE超突变型、MSI型和dMMR型内膜癌对免疫治疗更敏感,更适合PD-1/PD-L1抑制剂的治疗。
3.1.2 CTLA-4抑制剂 细胞毒性T淋巴细胞相关抗原4(cytotoxic T-lymphocyte-associated antigen 4,CTLA-4)是一种共刺激调节因子,表达于活化的T细胞表面,它通过与其配体B7-1、B7-2结合,干扰抗原提呈细胞与T细胞上CD28的相互作用,抑制T细胞的激活,负性调节免疫应答[32]。CTLA-4抑制剂主要是通过阻断抑制信号的传递,解除CTLA-4对T细胞活化的抑制,恢复抗肿瘤T细胞的激活。目前尚无CTLA-4抑制剂单药用于治疗内膜癌的案例可查,报道的少数病例均为CTLA-4抑制剂和PD-1/PD-L1抑制剂联合治疗。内膜癌患者免疫检查点抑制剂治疗的案例报道,见表1。
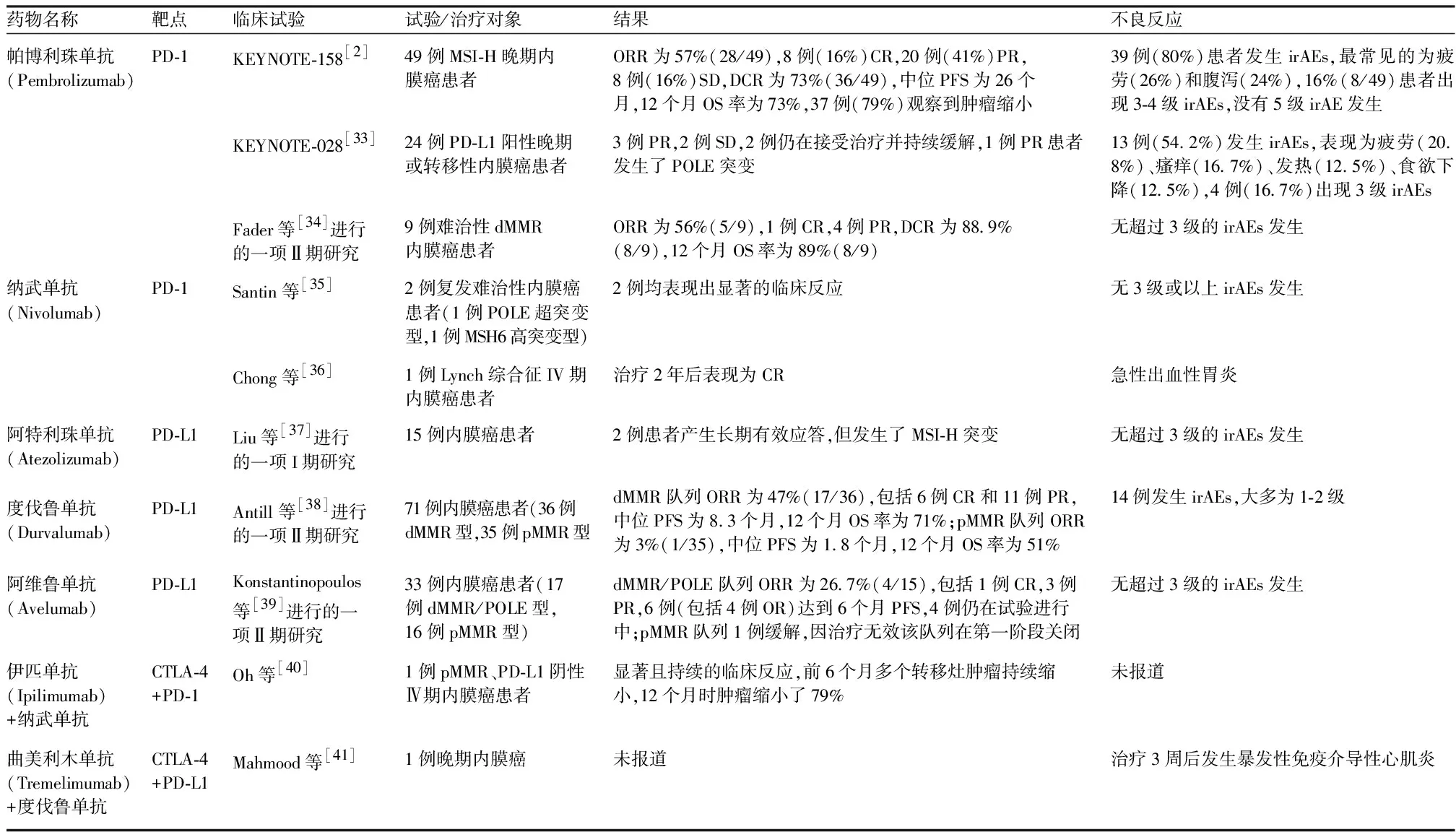
表1 内膜癌免疫检查点抑制剂治疗案例
3.2 CAR-T细胞疗法 CAR-T细胞疗法(chimeric antigen receptor-T cell therapy)是通过提取患者体内正常的T细胞,将经基因工程编辑的嵌合抗原受体(Chimeric antigen receptor,CAR)与T细胞进行整合培养,然后将培养成熟的CAR-T细胞输送回患者体内,使其特异性识别并杀伤肿瘤细胞从而达到治疗目的。CAR是人工合成的抗原受体,可重新定向抗原特异性、激活T细胞并通过其共刺激成分进一步增强T细胞功能[42]。
虽然CAR-T细胞疗法在恶性血液系统肿瘤中取得了不错的疗效,但是CAR-T细胞一旦注入患者体内就无法控制,其安全性问题仍是一个重大挑战。因为细胞因子释放综合征、脱靶效应、实体瘤疗效较差以及肿瘤复发率高等[43]问题的存在,迄今为止还没有CAR-T细胞疗法应用于内膜癌的研究。
3.3 肿瘤疫苗 肿瘤细胞的表面表达一类肿瘤特异性抗原,称为新抗原,它是因肿瘤细胞的遗传不稳定性导致的大量突变尤其是非同义突变而产生的,在正常组织中不表达。新抗原具有高度免疫原性,可激活CD4+T细胞和CD8+T细胞产生免疫应答。靶向新抗原的肿瘤疫苗可在不杀死正常细胞的情况下,有效诱导患者肿瘤特异性T细胞发挥抗肿瘤作用。
Coosemans等[44]使用电转染WT1 mRNA的DC疫苗治疗6例内膜癌患者的研究中,4例HLA-A2阳性患者中3例产生应答,其中2例观察到WT1特异性T细胞的富集,另2例HLA-A阴性患者无应答,1例患者出现局部过敏反应。Brown等[45]进行了一项E39肽+粒细胞巨噬细胞刺激因子(GM-CSF)疫苗预防卵巢癌和内膜癌复发的I/IIa期实验,E39肽是在多种恶性肿瘤中过表达的来源于叶酸结合蛋白的一种HLA-A2限制性免疫原肽,实验结果显示E39肽+GM-CSF是安全的,且可能有效预防内膜癌复发。
4 结论与前景
近几十年来,内膜癌的免疫治疗取得了许多突破性进展。内膜癌肿瘤微环境等方面的研究为内膜癌免疫治疗提供了潜在的研究方向。目前的实验研究表明,免疫检查点抑制剂,包括PD-1/PD-L1抑制剂、CTLA-4抑制剂,用于内膜癌的治疗取得了较显著的效果,且大多无严重治疗相关不良事件发生。CAR-T疗法和肿瘤疫苗在理论上证明了其用于肿瘤免疫治疗的可行性,但其用于内膜癌的治疗上尚缺乏大量的临床数据参考,仍有待进一步实践探索。如何为内膜癌患者有针对性地选择更有效的免疫疗法,提升肿瘤免疫应答率,并降低患者对免疫药物的耐受性与不良事件发生率,提高其临床效益,尽早将免疫疗法用于内膜癌的临床治疗中,这些将是我们未来研究的重点。内膜癌的免疫治疗前景广阔,将来免疫治疗应用于临床将会使更多的内膜癌患者受益,免疫治疗将成为内膜癌传统治疗方式之外的一个新的选择。
