晚期上皮性卵巢癌中间减瘤术的手术结局及预后相关因素分析*
2022-05-30邵思齐冯炜炜
邵思齐,冯炜炜
(上海交通大学医学院附属瑞金医院妇产科,上海 200025)
卵巢癌作为世界上第三大常见的妇科恶性肿瘤,由于其初始发病时常无明显症状,肿瘤隐匿生长且无合适的早期监测手段,卵巢癌诊断时多已发展为晚期,五年生存率为25%[1]。晚期上皮性卵巢癌的常规治疗手段为初始减瘤术(primary debulking surgery,PDS)+术后以铂类为主的辅助化疗。初次手术时因患者身体状况差、合并症多或无法行满意的减瘤术,新辅助化疗(neoadjuvant chemotherapy,NACT)+中间减瘤术(interval debulking surgery,IDS)+术后以铂类为主的辅助化疗为其替代方案。减瘤术的结局主要分为无肉眼可见残留肿瘤(R0),最大残留肿瘤直径≤1cm(R1),最大残留肿瘤直径>1cm(R2),R0及R1被认为是满意的减瘤术[2-5]。近年来,Vergote等[6]临床研究及CHORUS研究[7]关于PDS与NACT-IDS的研究结果表明,NACT+IDS的预后并不劣于PDS。NACT+IDS具有减少手术并发症的围术期优势,且更可能做到R0切除。而R0切除为晚期卵巢癌患者无进展生存时间(progression-free survival,PFS)及总生存时间(overall survival,OS)的独立保护因素[6-7]。因此,手术做到R0切除对于患者的生存结局至关重要。关于NACT+IDS手术结局的预测因素及该治疗方式预后相关因素的分析,已有一些研究。如Furukawa等[8]研究表明,IDS术前血清CA125<20U/mL是IDS达到满意减瘤的独立预测因素。Arab等[9]研究发现,IDS术前血清CA125>420U/mL,存在腹水或大量腹水,以及肝转移是预测不满意减瘤术强有力的因素。Elzarkaa等[10]发现,腹腔癌症指数评分(peritoneal cancer index,PCI)系统可有效评估晚期上皮性卵巢癌病灶范围,但不能预测患者的预后。意大利学者提出,腹腔镜Fagotti评分可用于评估可切除性,但对预后是否有价值还有争议[11-12]。最近研究表明,利用血清CA125水平建模计算出的CA125动力学参数KELIM[13-14]可作为IDS手术时机的选择及预测晚期卵巢癌患者PFS及OS的独立因素。在一定程度上,KELIM越高,代表血清CA125清除率越高,即化疗敏感性更强。本研究通过分析晚期上皮性卵巢癌IDS手术R0减瘤以及预后的相关影响因素,探讨中间减瘤术手术时机的选择,为临床决策提供有效助力。
1 资料与方法
1.1 研究对象 回顾分析2012年1月1日至2020年10月30日在上海交通大学医学院附属瑞金医院妇产科接受初次探查术+NACT+IDS的89例卵巢癌患者(以初次化疗时间为准)。患者的平均发病年龄为(57.9±8.9)岁,NACT前行腹腔镜手术探查,活检明确病理类型,85例为高级别浆液性癌,2例为透明细胞癌,1例黏液性癌,1例子宫内膜样癌。患者手术病理分期FIGO Ⅲb~Ⅳ期(International Federation of Gynecology and Obstetrics,FIGO)。纳入标准:通过初次探查手术明确病理为上皮性卵巢癌;临床病理资料完整。排除标准:非上皮性类型及交界性肿瘤;复发、转移性肿瘤;行PDS;确诊后仅接受化疗,未行IDS;治疗期间临床病理资料缺失;无规律随访。本研究已通过医院伦理委员会审批,患者均已签署知情同意书。
1.2 方法
1.2.1 资料收集 收集患者相关临床病理资料,包括患者年龄、NACT方案、每次化疗日期及NACT疗程数、体质量指数(body mass index,BMI);初诊时、每次新辅助化疗后及IDS术前的血清肿瘤标志物水平(CA125)。记录探查术及IDS时对腹腔内肿瘤负荷的PCI/Fagotti评分。对于2018年前接受了NACT+IDS的晚期卵巢癌患者,根据其手术记录回顾性评分。2018年后的入组患者则由手术医生在术时直接记录评分;同时计算出NACT后的下降值ΔPCI、下降值ΔFagotti。记录IDS手术结局:腹腔内肉眼无肿瘤残留为R0,其余为非R0(R1/R2)。根据探查术后病理情况结合治疗前CT或PET-CT影像确认FIGO分期。
1.2.2 随访 定期电话随访,记录是否复发,PFS,复发部位以及复发后的治疗方案。根据NACT期间至少三次血清CA125数值来准确计算CA125动力学参数KELIM(https://www.biomarker-kinetics.org/CA-125-neo)。

评估各个因素预测IDS能达到R0减瘤的能力采用受试者工作特征曲线(receiver operating characteristic curve,ROC曲线)。计算影响R0切除的各因素的预测灵敏度、特异度、阳性预测值、阴性预测值、约登指数。约登指数=灵敏度+特异度-1,约登指数的最大值为最优界值。采用log-rank检验对可能影响PFS的预后因素进行单因素分析,选出其中P<0.05的因素进行多因素Cox回归分析,采用Kaplan-Meier法绘制生存曲线。P<0.05为差异有统计学意义。
2 结 果
2.1 患者的一般情况 NACT首选以紫杉醇+卡铂的化疗方案,其他方案包括紫杉醇+顺铂(1例),环磷酰胺+顺铂(2例),托泊替康+顺铂(1例)。IDS手术方式及范围包括开腹全子宫双附件切除,大网膜切除,盆腔淋巴结切除,腹主动脉旁淋巴结切除,盆腔腹膜剥离,腹腔腹膜剥离,小肠切除,肝切除,脾切除,膈膜剥离/切除,结肠切除,直乙状结肠切除端端吻合术等,术后再继续辅助化疗。87例术后化疗方案和新辅助化疗一致,2例加用贝伐单抗。2019年2月起一线治疗后PARP抑制剂维持治疗的患者有12例。末次随访时间为2021年7月31日,中位随访时间为32.4个月(6.4~116.6个月)。
2.2 影响IDS R0减瘤的因素分析 89例患者中,手术达到R0者48例,非R0者41例(R1 34例及R2 7例)。两组患者的年龄、BMI、FIGO分期、病理类型、探查术时腹腔癌症指数(PCI评分)及Fagotti评分,治疗前血清CA125水平比较,差异均无统计学意义(P>0.05),表明两组患者治疗前的临床特征相似。经新辅助化疗后,单因素分析结果显示,IDS时PCI及Fagotti评分、下降值ΔPCI、下降值ΔFagotti、IDS术前血清CA125水平及CA125动力学参数KELIM与手术能否做到R0显著相关(P<0.05),见表1。将上述与R0切除相关的单因素纳入多因素logistic回归分析,发现IDS时PCI评分及IDS术前血清CA125水平是IDS R0切除的独立预测因素(P<0.05),见表2。

表1 IDS R0切除组与非R0组的临床病理特征比较

表2 预测IDS R0切除的多因素分析
2.3 各个影响因素预测R0减瘤术能力的效能分析 KELIM、IDS术前血清CA125水平IDS时PCI评分、ΔPCI、IDS时Fagotti评分、ΔFagotti均有较满意的预测R0减瘤术的能力(P<0.001)。其中IDS时PCI评分的曲线下面积(AUC)最大,为0.826(95%CI为0.727~0.926,P<0.001),表明IDS时PCI评分预测手术结局的效能最佳。见图1及表3。

表3 各个影响因素的曲线下面积
KELIM预测R0切除的最优界值为0.62,IDS前血清CA125水平的最优界值为48.25;IDS时PCI评分界值为11,ΔPCI界值为6;IDS时Fagotti评分的界值为4,ΔFagotti的界值为5。IDS时PCI评分的灵敏度0.958最高,特异度为0.667;ΔFagotti的特异度0.750最高,灵敏度为0.854。表明IDS时PCI≤11,提示R0切除的可能性高达93.1%。KELIM≥0.62,ΔPCI≥6,ΔFagotti>5时,预示IDS R0切除率分别为86.7%、85.1%和81.4%。当IDS时Fagotti评分≤4,IDS术前血清CA125水平≤48.25时,预示R0切除率为76.7%和74.9%。见表4。

表4 各个影响因素预测R0切除的最优界值、灵敏度、特异度、阳性预测值、阴性预测值
2.4 晚期卵巢癌NACT+IDS治疗模式下预后的影响因素 单因素分析结果显示,IDS时PCI评分、IDS前血清CA125水平、KELIM及IDS手术结局、一线治疗后PARPi维持治疗(BRCA突变的患者接受奥拉帕利维持治疗)与患者的PFS显著相关(P<0.05),见表5。将上述与PFS显著相关的单因素纳入多因素Cox回归分析(因一线治疗后维持治疗仅限于2019~2020年病例,仅有12例,故未纳入研究),发现R0切除与KELIM≥1是影响患者PFS的独立预测因素(P<0.05),见表6。不同IDS手术结局,即R0或者非R0(R1/R2)的无进展生存曲线显示,R0的中位PFS为25.6月,R1/R2的中位PFS为18.3月,差异有统计学意义(χ2=4.635,P<0.05),见图2A。对于NACT时血清CA125的动力学参数KELIM,KELIM<1的中位PFS为17.7个月,KELIM≥1的中位PFS为25.7个月,差异有统计学意义(χ2=7.218,P<0.05),见图2B。
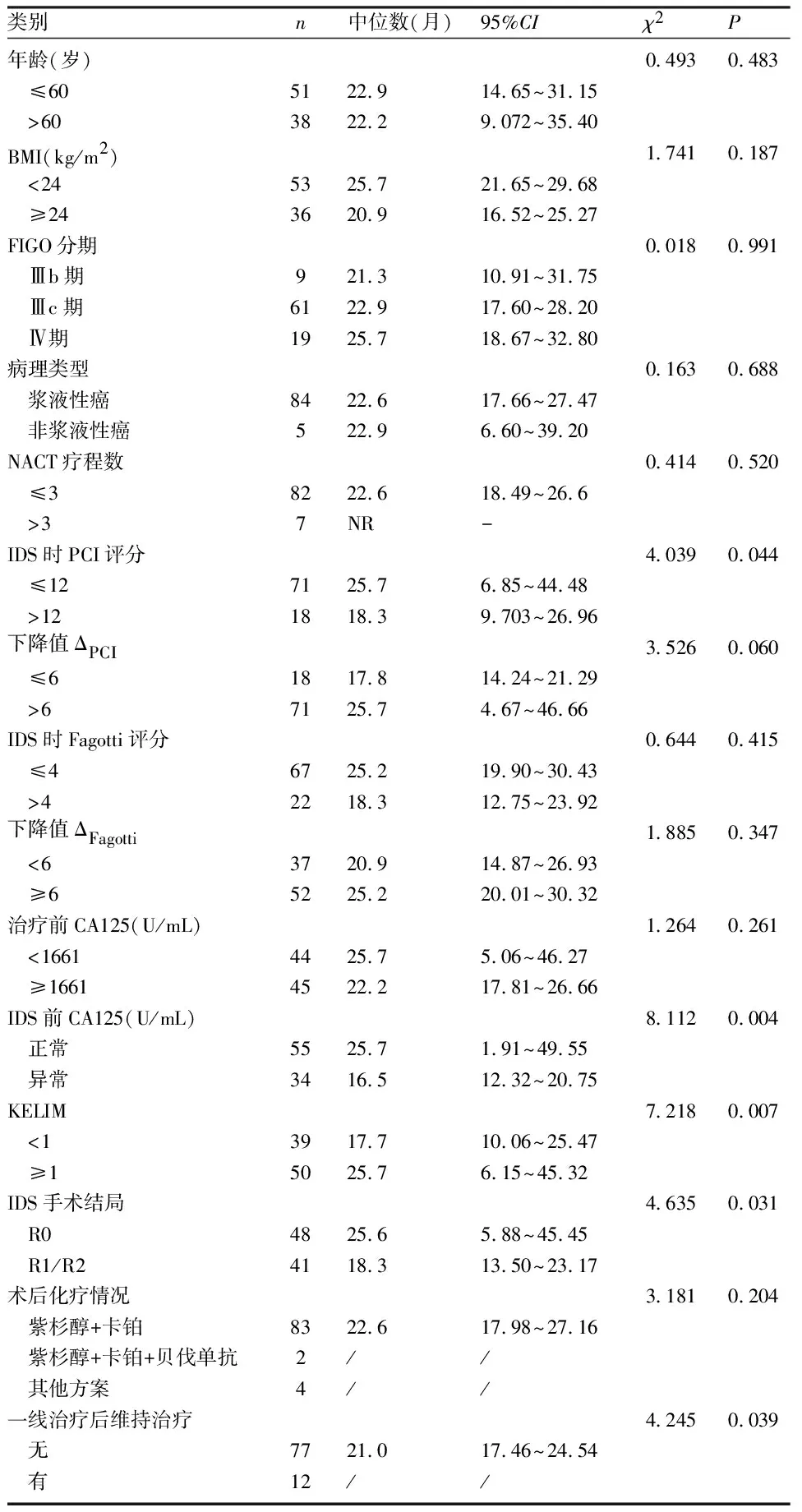
表5 影响晚期卵巢癌患者的PFS的单因素分析

表6 影响晚期卵巢癌患者的PFS的多因素Cox回归分析
3 讨 论
3.1 预测IDS减瘤程度的因素 晚期卵巢癌患者因为肿瘤负荷大,初次无法做到满意减瘤术而选择NACT+IDS治疗模式,本组患者都是通过腹腔镜探查决定先做NACT的患者。新辅助化疗有效提高了R0切除率,降低了手术难度及围术期并发症的发生率。本研究结果表明,IDS时PCI评分≤11分是IDS R0切除的最佳独立预测因素(R0切除可能性达93.1%)。Rosendahl等[15]利用PCI评分系统预测满意减瘤术:对于R0切除的患者PCI评分均值为10分,对于非R0的患者PCI评分均值为24分。这个PCI界值与本研究结果基本一致。本研究单因素分析结果显示,IDS时Fagotti评分也与R0切除相关,IDS时Faggoti≤4分提示预测IDS R0切除的可能性为76.7%。Fagotti等[16]研究表明,当Faggoti总评分≥8分时,手术无法做到满意减瘤(包括R0及R1)。由于本研究计算的是R0减瘤,Fagotti总分的界值为≥6分。本研究多因素分析显示,IDS时Fagotti评分失去了预测价值,因此在预测IDS R0减瘤能力上,PCI评分相比Faggoti评分更优。血清CA125值也是反映肿瘤负荷的一个良好指标,多项研究表明IDS术前血清CA125值与R0切除率相关,但各项研究的界值不一,从20~600不等[8-9,17-18]。本研究发现,IDS术前血清CA125水平是影响R0减瘤的独立因素,若CA125≤48.25U/mL,R0切除可能性达到74.9%。对于临床医生,NACT疗程数具有可控性,何时行IDS能最大程度做到R0切除需要更精准的评估。《2021NCCN卵巢癌包括输卵管癌及原发性腹膜癌临床实践指南(第1版)》指出,对于化疗反应良好或疾病稳定者,NACT行3~4疗程后可行IDS。手术时机并无前瞻性证据,需根据患者个体化因素而定。NACT疗程数的增加是否诱导耐药,影响IDS术后化疗效果及疗程数,需要化疗多少疗程才最有利手术,并有利于生存期的延长,没有定论。本研究表明,NACT的疗程数对手术结局无影响,可能与样本量小相关。IDS术前血清CA125水平是影响手术结局的独立因素,而治疗前CA125水平与IDS手术结局无关,因此化疗的敏感性决定了IDS前疗程数。文献报道,CA125动力学参数KELIM值越大,化疗敏感性越高,可能与IDS手术时机选择相关[13,19]。本研究发现,KELIM虽然在单因素分析时也影响了R0切除,但多因素分析表示其不是独立预后因素。但结合治疗前CA125值以及NACT 2个疗程期间KELIM值,可预测出该患者需新辅助化疗几个疗程CA125才能降到界值以下。这可能帮助临床医生决策患者做NACT的疗程数,从而达到最好的减瘤效果。
3.2 关于NACT+IDS治疗模式预后的影响因素 本研究后续对患者进行了长期的随访,通过单因素及多因素的分析,发现预测PFS的独立因素是R0切除与血清CA125动力学参数KELIM≥1。满意的减瘤术是预后获益最重要的独立因素[5],IDS做到R0的长期生存率和初次瘤体减灭术时做到R1相似[7]。张国楠等[20]研究表明,BMI、手术减瘤程度、IDS后≤7d开始化疗是显著影响NACT+IDS治疗的晚期卵巢癌患者PFS获益的相关因素。本研究进一步证实,IDS R0切除中位无瘤生存期达25.6月,手术减瘤程度对于PFS有显著影响。
本研究发现,KELIM≥1中位PFS为25.7月,在其他研究中KELIM值≥1被称为有利的KELIM,0.5~1称为中等的KELIM,而<0.5为不利的KELIM,其中KELIM≥1与预后显著相关[21],与本研究结果相一致。可见应用KELIM反应化疗的敏感性,让临床工作者能精准地把握肿瘤标志物的动态变化,对于手术时机的选择、预后的判断有重要的价值。
本研究也有一定的局限性,如样本量较小、研究为回顾性分析,2018年之前的探查术和IDS时的PCI和Fagotti评分为根据手术记录回顾性评分,也可能使分析结果产生一定偏倚。此外2019年开始,BRCA突变的患者接受了PARP抑制剂维持治疗,一般认为BRCA突变的患者对化疗较为敏感,再加上维持治疗,无瘤生存期显著延长,本次分析中由于例数少未纳入多因素研究,但在维持治疗逐渐普遍应用后,这必将影响IDS后患者的预后。
3.3 总结 IDS时PCI评分以及IDS术前血清CA125水平是预测IDS R0切除的独立预测因素,而R0切除与KELIM≥1是预测晚期卵巢癌患者PFS的独立因素。通过监测NACT时血清CA125水平及计算KELIM,可指导临床治疗和预测预后。如何选择最佳进行IDS的时机及如何让晚期卵巢癌患者预后获益,仍需进一步的探索与讨论。
