声表面波微流控液滴生成技术研究进展
2022-05-30杨紫薇金少搏张传禹韦学勇
杨紫薇, 李 磊,2, 杨 磊, 金少搏, 张传禹, 韦学勇
(1.西安交通大学 机械制造系统工程国家重点实验室, 陕西 西安 710049;2.西安交通大学 苏州研究院, 江苏 苏州 215123; 3.郑州轻工业大学 河南省机械装备智能制造重点实验室, 河南 郑州 450002)
引言
微液滴作为一种优秀的微反应器,具有体积小、液滴间无扩散、可快速混合等优点,已经被广泛用于研究微尺度条件下的生化反应过程,如化学合成、液滴PCR、微萃取、生化检测、细胞包裹等[1]。制备微液滴是生产周期的第一环,也是应用的关键。传统方法通过简单的机械搅拌混合、挤压或振动有孔洞模具、驱使液体通过特定小孔等方法,能够快速制备大量液滴[2]。但这些方法相对粗放,易引入杂质且液滴尺寸大小不一,分布不均匀,不易操纵,存在局限性。微流控的发展尤其是声表面波等主动控制的方法的引入,为液滴生成技术的进步和应用的拓展提供了契机。
1 微流控液滴生成方法
液滴是少量液体分散在另一相的流体中时的物质状态。其中一相类似不溶性杂质,间隔分布,称为分散相,而另一相类似溶剂,称为连续相。当两相都是液体时,液滴生成过程也称为乳化。
液滴的尺寸和结构与具体的需求息息相关。在样本数量小、实验条件复杂、重复性要求高的研究中对液滴的制备精度和控制能力有更高的要求。此时,被称为“芯片实验室”的微流控方法成为了一种重要的液滴生成手段。
连续相和分散相分别通过设计的微流道注入微流控芯片,整个液滴生成过程在密闭的微流道中进行,受外界干扰较少。两相液体分开驱动,其比例和流速更易调控,液滴的组分和尺寸也更加可控。
根据是否施加外场,液滴生成分为被动法和主动法[3-4]。被动法是通过流道结构的设计使流体相互剪切、挤压,分散相逐渐失去稳定性在连续相中破碎后形成液滴,其中根据流道结构的不同,又分为T型流道、流动聚焦、同轴流等形式。主动法则是引入外场给微流道中的液体额外激励,能够主动控制液滴的生成与运动,常见的外力场有:电场、磁场、光场、热场、声场等[5]。电场主动式调控中,通常需要高达成百上千伏的电压幅值,会造成对生物样本的损伤,并伴有电极耦合现象,影响系统可靠性[6-7]。磁场只能对磁性流体进行操纵,适用范围小[8-9]。激光调控响应速度快,但由于激光聚焦能量高,会引起微流控系统的快速升温,需要激光设备和配套的散热设备,成本高昂[10]。热场调控需要集成较为复杂的加热设备等,增加了装置复杂性[11-12]。声场调控多采用声表面波设备,具有高能量、非接触、无污染、高度生物兼容、设备简单等特点,更加灵活简便,应用领域也更加广泛[13]。微液滴生成技术发展趋势如图1所示。

图1 微液滴生成技术发展趋势
2 声流控液滴生成技术进展
声表面波是沿着材料表面进行传播的声波,由于大部分能量都存在于表面附近,表面的流体与结构达到高效耦合[13]。声表面波微流控在近年来得到广泛研究和快速发展。1989年SHIOKAWA S等[14]第一次用声表面波技术生成了液滴,在电压峰峰值Vpp=25 V,频率f=50 MHz的交流电驱动产生的声表面波作用下,生成并喷射了微液滴的现象,这也引发了许多研究者对声表面波超声雾化液滴生成的研究[15-16]。同年,ELROD SA等[17]将聚焦叉指换能器放置在液面下,通过改变工作频率,生成了直径为5~300 μm的微液滴。后续有研究者利用该技术,实现了多种结构和方式的声表面波液滴喷射生成[18-19]。21世纪初,WIXFORTH A等[20]利用声表面波在具有局部亲疏水特性的芯片表面操纵大液滴,并在操纵过程中生成了微液滴,成功用于生化分析。2008年,GIRARDO S等[21]将声表面波与微流控技术结合,用于液滴的生成与控制,利用声表面波推动液滴在微流道定向移动。2012年之后,声表面波微流控技术越来越多的用于液滴生成和操纵,并结合叉指换能器(IDT)的设计与布置[22-24],发展出了多种方法。主要的声表面波微流控液滴操纵和生成技术如图2所示。图2a利用声表面波控制流体定向流动的启停和节奏[25];图2b利用声表面波产生定向的声辐射推力,将分散相挤入连续相形成液滴,现在有多种结构能实现这类方法的液滴生成[26-28];图2c通过在两相交汇处施加振动破碎液滴,在不改变流量或流道尺寸的情况下来调控液滴尺寸[29];图2d在液体流动的方向上设计叉指电极,实现可编程、高精度的定向流动操纵[30];图2e中本课题组利用聚焦型叉指电极(FIDT)给分散相施加声辐射力,通过调节驱动电压和频率可以控制微液滴的大小[31];图2f利用声表面波的声辐射力将大液滴分割成小液滴[32]。

图2 声表面波液滴生成策略[25-32]
2.1 声表面波微流控液滴生成模型
声表面波有多种方法促进液滴生成,其中泵送作用的方法是声辐射力单方向推动流体流动,而声表面波与微流体的相互耦合生成液滴就复杂很多,以H型流道为例,如图3a所示[31]。
理论分析上,在未受声表面波影响时,由于界面张力的存在,液滴的界面可视为球面,以拟合界面圆的圆心O1作为原点建立极坐标系,两相界面的形变模型如图3b。其中,紫色曲线表示无声场作用下两相界面的初始形状,红色虚线表示均匀声场作用下的两相界面扁圆变形形状。基于TIAN等[33]的研究,在声表面波的作用下,界面形变后的轮廓可用以下表达式描述:
(1)
式中,r—— 极半径/m
θ—— 极角/rad
R—— 两相界面拟合圆的半径/m
pa(θ) —— 两相界面上任意位置的声辐射压力的幅值/Pa
γ—— 界面张力/N·m
c0—— 声表面波在流体中的传播速度/m·s
ρ0—— 流体密度
k0—— 流体中的声波数
δ—— 声表面波作用下界面的变形量/m
当声场分布均匀的时候,pa(θ)恒定,可以将两相界面变形后的轮廓形状看作是一个椭圆曲线,在两相界面底部具有最大的变形rbottom=r(-π),如图3b所示。

图3 声表面波作用下的液滴生成模型[31]
使用不均匀的聚焦声表面波(FSAW),如图3中蓝线所示,声表面波聚焦点O处的声辐射力最强,沿在以O点为中心的y方向上的振幅分布类似高斯分布,会产生如图3b中绿线所示的不均匀形变轮廓形状。
由于聚焦声表面波的进一步作用和内部流体的不断挤压,两相界面的最大变形位置会继续出现两相界面的底部和声表面波的聚焦位置。
在聚焦声表面波作用之前,根据Young-Laplace方程,在垂直方向上,界面两侧的局部压力差与界面张力相等。当声表面波沿着基底传播到流体中时,由于声表面波在两相界面中的折射和反射,在两侧的界面流体在垂直方向存在增大的压差[34-35]:
Δpr=p1-p2-γ(1/R1+1/h)
(2)
式中,p1—— 两相界面内侧的压力/Pa
p2—— 两相界面外侧的压力/Pa
R1—— 聚焦声表面波关闭时两相界面的曲率半径
h—— 流道高度
当Δpr=0时,界面两侧的局部压差(p1-p2)和界面张力导致的压力γ(1/R1+1/h)相等,两相界面稳定。当Δpr≠0,即受声辐射力时,增加的压差会破坏界面两侧流体的压力平衡,导致第二阶段中液滴体积增大(图3c)。
同时由于声压场的不均匀性,进入颈缩阶段,两相界面上会存在一个声学梯度力Fs。当微液滴体积增长到一定程度,声学梯度力将使微液滴断裂并进入连续相,如图3d所示。
总的来说,微液滴生成的本质是由于聚焦声表面波的引入打破了原有界面的力学平衡,引起了界面的不稳定性,从而诱导了微液滴的连续生成。
2.2 液滴生成工艺参数研究
液滴生成受声表面波影响,可以通过改变聚焦叉指换能器的输入频率f和电压峰值Vpp影响产生的声波能量,进而来调控微液滴的生成大小。
图4a显示了输入频率对液滴长度尺寸L的影响,输入频率对液滴尺寸的调控规律类似一条抛物线,且在共振频率时为波谷,液滴长度尺寸最小。这是因为,当输入频率越接近共振频率,则从电能到声能的转换就越有效,引起更强的声辐射压力,加速了不稳定性的形成,从而对微液滴形成时的两相界面施加更大的影响。
当频率一定,且流道两相入口压力为恒定值,不同驱动电压下所产生的微液滴大小的变化趋势。随着电压峰峰值在一定范围内的增加,微液滴的大小呈现减小的趋势。液滴尺寸与施加的驱动电压之间的线性拟合关系如图4b所示。
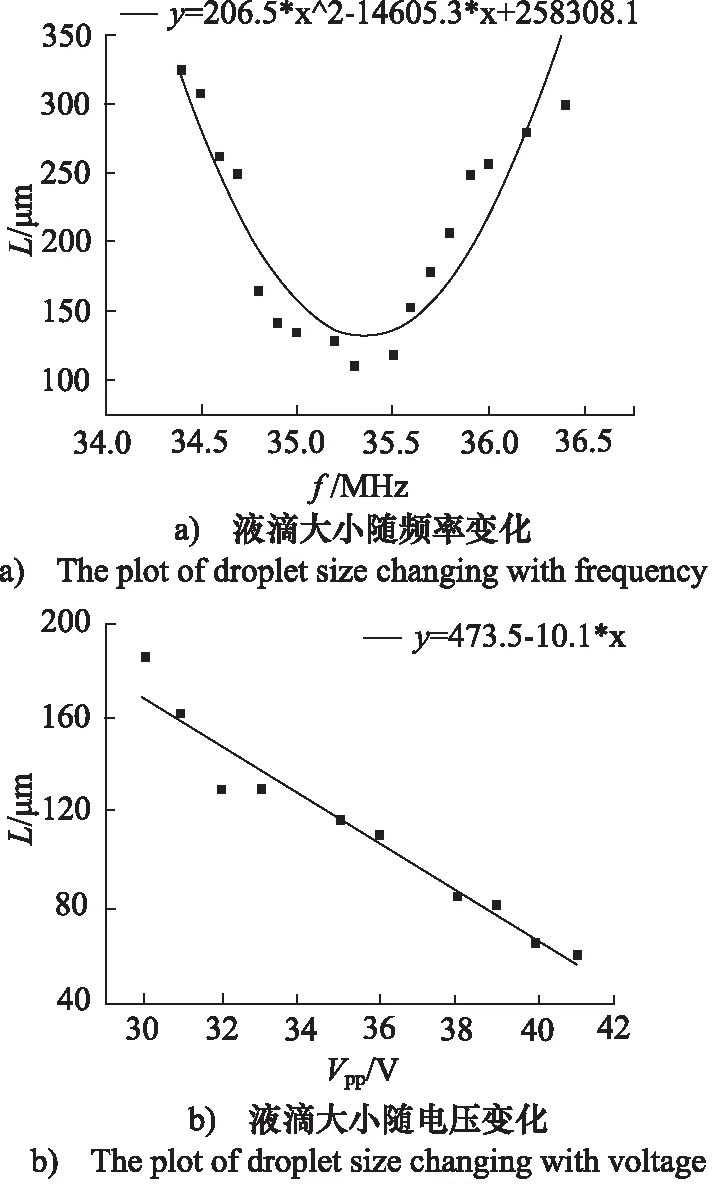
图4 液滴大小与声波参数的关系[31]
该模型中,液滴大小依赖于FSAW产生的声辐射力对油水界面的作用,而不是流体剪切力[31],因此生成液滴尺寸范围较窄。正如前文所述,声流控液滴生成技术多种多样,利用SAW可以产生接近几何极限大小的液滴而不改变流速[36]。在实际应用中,可以根据需求,选择设计合适的电极结构,合理设计微流控芯片,改变声场作用位置及参数,调整液滴生成的尺寸范围[25,36]。
3 声流控复杂结构液滴生成及应用
核壳型微液滴是由至少两种材料组成的结构化复合液滴,其壳壁可以保护内部生物分子或细胞的活性、湿度、PH值不受外界环境的影响和破坏,已经广泛应用于材料合成、生物医学研究和药物输送释放中[37]。
传统的核壳微液滴制备多采用本体乳化法,难以控制核壳微液滴的尺寸、形状和结构,限制了核壳微液滴的应用。微流控技术的快速发展为不同结构、尺寸、组分核壳液滴制备提供了新方法。依靠微流体装置,将多种互不相溶的液体依次剪切并乳化,从而层层包覆形成多重乳液[38]。然而,为了满足各相界面张力平衡条件,需要设计成2D多级微流道或3D嵌套毛细管微流道结构来生成[39],设计与制造都相对复杂。利用声表面波来驱动微液滴/微粒,使得声控核壳微液滴的生成方法更为灵活,借助声辐射力的作用引导液滴/微粒穿过不混溶的界面以获得多层壳,极大地简化了微流道的结构设计[40]。
SAW微流控生成核壳微液滴的装置如图5A所示:该装置有3个聚焦叉指换能器,用于操控液滴运动,当三个流道通入相应的流体并保持一定的流速流动时形成三相并行的层流。
利用聚焦叉指换能器产生的聚焦声表面波能够克服由流体引起的斯托克斯阻力和剪切梯度提升力,以及水平方向的界面张力,来驱动液滴/微粒穿过油/水界面,从而产生核壳型微液滴。在此基础上,可以将更多的叉指换能器集成到器件中以制造更多壳层的核壳微液滴,如图5a,液滴在FSAW的作用下,从油相(O2)穿过界面到水相(W3),从油包水滴生成在水相(W3)中的带有油壳的核壳微液滴。如图5b所示,微液滴在聚焦声表面波的作用下,能够形成由液滴核(绿)和油壳(红)组成的核壳微液滴,实现利用油壳来隔绝内外环境。该核壳液滴无论是制备工艺还是材料组分,均具有良好的生物兼容性。以实心粒子为核心,用类似的方法还可以生成以固体颗粒为核心的核壳微液滴。如图5c所示聚苯乙烯小球在声表面波的作用,通过两次穿过油/水界面,可以形成具有聚乙烯醇(PVA)水膜壳(绿色圆圈)和油壳(红色圆圈)的双层核壳结构。制备的核壳型微液滴具有非常薄的液态油膜[41]。

图5 声控生成核壳微液滴[40]
除核壳微液滴外,微腔封装的微液滴,是以液滴为载体,将细胞或功能性的微粒包裹在其中的复杂液滴。液滴由于界面的存在,提供了一个相对稳定的内部环境,有利于特定对象的分析和研究。传统的被动微腔封装将悬浮在水溶液中的一群细胞或颗粒作为分散相,另一不混溶的流体作连续相,生成包封细胞或微粒的液滴。但这种方法不能直接控制每个液滴中包裹的数量,包裹数量遵循泊松分布,面临着高比例的空液滴或更高比例的具有多个细胞或颗粒的液滴的困难[42]。采用声表面波喷射液滴的方法,液滴中的细胞数与液滴体积呈线性关系,通过调节声波参数能控制液滴生成的节奏和尺寸即细胞数,并且对生物损伤也很小[43]。也可以利用声波对粒子的富集和声流作用,将液滴生成、富集、封装结合在单个微流控芯片中,调节SAW按需生成颗粒封装液滴[44]。优秀的包封率和可控的粒子封装数使得细胞孵育[45],单细胞基因测序[46],药物递送[47]效率更高。可以将包封粒子或细胞后的液滴通过穿越层流获得壳层,实现细胞培养或药物释放的特定需求[48]等。
图6为常见复杂结构液滴及其应用。图6a通过微流控技术生成了具有大液体核和聚合物壳的生物相容性微胶囊,用于药物释放[49];图6b中封装壳的原位光聚合使得合成的结晶胶体阵列结构稳定,并且不允许离子物质渗透,能够在高离子强度的连续水相中保持至少一个月[50];图6c展示了具有半透性壳的水凝胶胶囊,该种胶囊在单个大肠杆菌细胞的单基因组扩增实验中,比水凝胶珠或液滴更为有效[51];图6d用微流体技术生成一种具有程序化顺序药物释放的复杂核壳壳聚糖微胶囊,用于急性胃病治疗,其微胶囊由交联的壳聚糖水凝胶壳和含有游离药物分子和载药聚(乳酸-乙醇酸)(PLGA)纳米颗粒的油核组成[52];图6e中设计了一种具有油核、混合聚合物中间壳、二氧化硅壳的纳米载体胶囊,聚合物层在二氧化硅层的构建时稳定乳液,二氧化硅外层作为生物结合和将亲水药物嵌入多孔结构的最佳生物界面,并使纳米胶囊具有防污性能。对比了在二氧化硅层外涂有聚乙二醇(PEG)和没有涂层下的纳米胶囊(绿色)进入细胞的生物兼容性,此外,适当地官能化不同壳层可以实现纳米载体胶囊的多功能化[53]。

图6 常见复杂结构液滴及其应用[49-53]
虽然声表面波对于液滴生成的操控能力很强,但制备复杂结构的微液滴往往需要将声表面波等多种技术结合才能够满足要求,实现更复杂的液滴制备。
4 结论
声表面波微流控技术在在过去的20年中得到了快速发展,在微液滴生成方面,只需通过控制输入电压、频率等参数,即可实现对微液滴生成和运动的主动控制,器件结构和操作都比较简单,具有显著的优势。未来可以与相关模块进行集成,发展成为便携式生化医疗设备。
此外,使用脉冲信号激励压电换能器,产生的声波振动尖头毛细管,从而高频打印液滴阵列,再结合数字微液滴生成,即可实现可编程化操控,可用于单细胞封装培养、PCR等生物实验[54];还可以利用动态聚焦声场将液/气界面抬升至一定高度,以便液/气界面破裂,从而按需喷射打印无油液滴,将编程的射频信号用于圆形叉指换能器,实现精确控制生成时间和顺序以及准确的液滴体积。该喷射装置还可以将细胞封装在液滴中,并将这些液滴沉积到基板上的液滴阵列中,快速处理和保存细胞[55]。除液滴外,也可打印细胞甚至细胞球体。这种声学打印液滴装置由于没有喷嘴,可以稳定地打印高浓度细胞,甚至细胞球体,也不会堵塞。同时,打印的细胞活力较高可以用其创建更多功能的天然组织、类器官或疾病模型[56];利用声流体对悬浮粒子(如细胞)的影响,无支架生成多细胞球体,细胞球体等3D细胞培养物,广泛用于组织工程、再生医学和转化医学等[57-58]。
