舞蹈运动员节奏感知同步优势及大脑神经活动特点
2022-05-30金鑫虹王小宇王碧野王怡萱周成林
金鑫虹,王小宇,王碧野,王怡萱,周成林*
节奏感知(rhythm perception)是协调外界环境感知与动作同步的核心能力,人们在完成基本动作(如走路、拍手、说话)时,感知系统和运动系统形成了规律性的节奏同步效应。但是,日常生活中时常出现“动作不协调”现象,表现为肢体动作与外界节奏无法产生同步响应。在竞技运动赛场上,有效地响应来自外界刺激的同步信号,是实现运动技能的基本环节。舞蹈作为协调外界刺激感知和肢体运动特点最突出的项目之一,已成为该领域的研究热点。
感觉运动同步(sensorimotor synchronization)实现了个体动作与节奏在时间上的协调(Repp et al.,2013),体现了节奏加工的本质属性(潘禄等,2015),是一项重要的认知能力(Honing,2012)。目前,常用手指打拍子任务(finger‑tapping task)作为研究范式,探讨感觉运动同步的动作表现。其中,节奏自身属性是影响感觉运动同步的主要因素之一。人们倾向对较短时间节奏(250~400 ms)判断过长,而对较长节奏(600 ms~2 s)判断较短,对400~600 ms节奏的判断绩效最好(Ra‑jendran et al.,2018)。因此,有研究指出,人体自发动作节奏的最佳频率约为 2 Hz(Repp et al.,2013;Will et al.,2007),这一机制影响了注意、时间预期和动作协同等能力(Large et al.,2015)。还有研究表明,节奏感知的同步响应能力与感觉通道相关,但受到个体经验的影响(Blais et al.,2015;London et al.,2016;Repp et al.,2013;Su,2014)。前期在不同感觉通道下,对200~1 200 ms间隔的节奏同步研究中发现,与无舞蹈经验组相比,舞蹈运动员对听觉节奏同步优势显著,且在较宽的频段内同步绩效较好(Jin et al.,2019)。但该研究并未对舞蹈运动员节奏感知同步优势的机制进行深入探讨。
“有节奏的大脑”(the rhythmic brain)模型提出了大脑神经语言的时间特性和音乐节奏特性的相似性,认为节奏也是大脑神经活动的本质属性之一(潘禄等,2015)。共振理论提出,神经振荡(neural oscillations)是大脑在节奏感知中的关键特征,神经兴奋的节律性波动是同步能力的基础(Large et al.,2009),可对外界刺激与同步动作进行协调响应,协调的基本过程是内部振荡的相位和周期适应外部刺激的过程(Palmer et al.,2014)。神经振荡可以通过非侵入性手段脑电图(electroencephalograph,EEG)进行测量,反映神经元组的同步兴奋性波动(Fries,2005)。当神经振荡与外界刺激保持规律性一致时,神经会处于高兴奋状态,并且与音乐的内在旋律保持一致。例如,当向听众呈现2.4 Hz的音乐时,在测量的EEG中可以看到2.4 Hz的响应(Nozaradan et al.,2011)。事件相关电位(event‑related potentials,ERPs)可测量特定刺激出现或消失在大脑所产生的电位变化,有助于考查大脑完成节奏同步过程的机制。在节奏感知过程中,N1和P2是探讨较多的成分,与节奏刺激相关。N1成分是预测过程的重要成分之一,P2成分则对识别加工过程较敏感,受到认知负荷水平的影响(Crowley et al.,2004)。在一项考察声音节律对大脑神经振荡诱发特征的研究中发现,声音节奏可诱发神经振荡同步化和N1成分,当外界节律结束后仍能探测到神经振荡同步化,提示,外界节律与神经振荡同步化过程不仅受到外界节律的影响,也包括了内部时机加工过程(Stupacher et al.,2016)。
基于舞蹈经验可提高节奏同步绩效的研究结果(Jin et al.,2019;Karpati et al.,2016;Miura et al.,2016),本研究选取人体偏好节奏频率(2 Hz)下的3种节奏刺激(视觉、听觉和视听同步节奏),考察舞蹈运动员是否仍存在节奏感知优势以及这一优势的大脑神经活动特征。由此,本研究假设,即使在人体适宜动作频率下,舞蹈运动员仍表现出听觉相关节奏感知优势,即同步性绩效更好,更加稳定,而这一优势与其大脑神经活动相关,表现为2 Hz频段下神经活动能量更大,但较少分配注意资源。
1 研究对象与方法
1.1 研究对象
招募体育学院体育舞蹈专业运动员32名[10名男性,平均年龄(19.8±1.8)岁]作为舞蹈组,平均舞蹈训练年限(8.5±3.7)年,平均每周舞蹈训练时间(10.78±1.96)h。招募无舞蹈和音乐经验的普通大学生31名[10名男性,平均年龄(22.6±3.1)岁]为对照组。所有被试听力、视力或矫正视力正常,均为右利手,健康状况良好,无任何心理、精神疾病,自愿参与本次实验。
1.2 实验材料
实验刺激材料分为视觉节奏、听觉节奏和视听同步节奏3种类型,要求被试将右手食指放于键盘“M”键上完成节奏同步打拍子任务。视觉节奏刺激为在灰色背景正中均匀闪烁的蓝色圆圈(直径为2.5 cm),呈现时间是40 ms。声音节奏刺激为低音调(500 Hz)的纯音“beep”,呈现时间也为40 ms。视听同步节奏刺激为听觉刺激和声音刺激同时出现,呈现时间 40 ms(Blais et al.,2015;Jin et al.,2019)。刺激呈现的时间间隔为500 ms,即120 BPM,频率为2 Hz。
实验程序采用Matlab(2013a)中的Psychotoolbox 3.0进行代码编辑和运行,并在台式电脑上进行视觉刺激的呈现和听觉刺激播放。被试与屏幕相隔1 m。视觉刺激呈现在19寸的显示器上,显示器刷新率为60 Hz,分辨率为1 440×900 dpi。听觉刺激采用入耳式耳机进行播放,音量为被试舒适的音量。被试按键在键盘上进行。
1.3 实验程序
实验在心理学实验室独立隔音的房间进行。实验开始前,被试阅读并签署知情同意书。被试填写基本信息后,保持舒适的姿势在电脑前坐好,距离电脑屏幕1 m。在了解实验程序和任务要求之后,佩戴脑电帽,带上入耳式耳机进行节奏感知同步任务。在每个试次开始之前,屏幕上会呈现注视点“+”1 000 ms,然后出现同步节奏刺激10次,试次结束后,呈现2~6 s随机空屏时间,然后进行下一个试次。听觉节奏同步任务中,屏幕上会一直呈现注视点“+”,要求被试全程睁着眼睛,而在视觉和视听双通道节奏同步任务中,黑色注视点会变成闪烁的蓝色圆点。实验过程中要求被试集中注意力,在节奏刺激出现同时按键盘中的“M”键进行同步反应,要求被试的按键与节奏越同步越好。每个block中500 ms节奏出现10个试次,实验共4个block,节奏刺激类型在被试间均衡。为了避免被试产生练习效应,每个block中会出现其他节奏时间间隔(Jin et al.,2019)共20试次,但不记录数据统计当中。
1.4 数据采集与处理
1.4.1 行为数据
手指打拍子任务主要考察的是节奏出现的时机与手指打拍子时机之间同步性(synchrony)和异步性(asyn‑chrony)特征(Blais et al.,2015;Chen et al.,2002)。同步性和异步性是通过平均每个刺激呈现与被试相应打拍子之间的时间差值计算的,是测试同步反应的准确性指标。同步反应时间将由被试在按下键盘时开始计算时间,数据筛选标准:1)当被试按键正好落在两个刺激之间时,其被分配给先前的节奏刺激;2)如果被试在呈现刺激时没有按下键盘,最后输出结果则删除该试次数据;3)如果被试在一系列节奏出现时,直到第二拍出现时才对第一拍进行反应,则从输出结果中删除该次反应(Jin et al.,2019)。
平均异步性可考查节奏同步的策略,平均异步性为正值,即多在节奏刺激出现后进行反应,则表现为追踪时机策略;若平均异步性为负,则多在刺激之前进行按键同步,为预测时机策略。以每次按键与节奏刺激之间时间差的绝对值(绝对异步性,absolute asynchrony)表示节奏同步的准确性,以避免不同策略的影响(Dione et al.,2015)。节奏同步异步性的标准差(SD)用来估计被试同步协调的稳定性(Blais et al.,2015;Chen et al.,2002)。
1.4.2 脑电数据
脑电数据采集使用德国Brain Products公司的EEG记录与分析系统对实验数据进行测量(带宽0.01~100 Hz,采样率1 000 Hz),采用Ag/Agcl电极。按国际10‑20系统扩展的64导电极帽记录EEG,在右眼外眶下表面1 cm处采用电极记录水平眼电(horizontal electrooculogram,HEOG),在左侧眼眶下表面1 cm处采用电极记录垂直眼电(vertical electrooculogram,VEOG),电极阻抗保持在5 kΩ以下。
EEG数据采用Brain Product Analyzer软件对数据进行预处理:以双耳乳突(TP9和TP10)的平均电位作为参考,并还原FCz电极;进行滤波(包括去除市电50 Hz,高通为0.1 Hz,低通为30 Hz,斜度为24 dB/oct);采用ICA方法去除眼电伪迹;波幅大于±100 μV的视为伪迹自动去除。采用复莫莱小波变换(complex morlet wavelet transforma‑tions,CWT)对实验数据进行功率谱分析(Mallat,1999)。CWT分析采用以下参数:中心频率fc=1 Hz,频谱带宽fb=1.5 Hz,线性频率为0.5~30.0 Hz,分辨率为0.05 Hz。根据以往文献和预实验结果(Stupacher et al.,2016),本研究选取 Fz电极点,对 2 Hz、delta(1~4 Hz)、alpha(8~13 Hz)和low beta(13~20 Hz)计算功率谱能量,反应大脑对节奏刺激的神经振荡活动特征。
ERP数据预处理:刺激诱发的ERP,以每个刺激出现为0点,取之前100 ms至之后400 ms对数据进行分段,并以0点前100 ms做基线矫正,然后采用MATLAB软件(Version,2015b,The Mathworks,Inc.,Natick,MA)和EEGLab工具箱对导出的数据进行叠加,根据3种节奏形式下的总平均和脑地形图特征,找到N1、P2成分。其中,N1成分选取Fz和FCz电极,以3种节奏条件波峰为中心,听觉节奏N1成分时间窗为70~140 ms,视觉节奏为85~155 ms,视听节奏为100~170 ms。选取FCz和Cz两电极对P2成分进行分析,P2成分听觉节奏时间窗为150~220 ms,视觉节奏时间窗为160~230 ms,视听节奏为170~240 ms。
采用SPSS 17.0统计软件对其进行2组别(舞蹈运动员和对照组)×3节奏类型(听觉节奏、视觉节奏和视听节奏)的重复测量方差分析。在统计分析中使用Mauchly球型检验评估数据的方差齐性,对不满足球型检验的统计量采用Greenhouse‑Geisser法进行自由度矫正。统计显著水平设定为P<0.05。
2 研究结果
2.1 节奏同步行为绩效结果
2.1.1 平均异步性
舞蹈组和对照组节奏同步的平均异步性结果(图1)显示,舞蹈组在3种节奏刺激同步任务中,平均异步性均呈现负值,即采取了预测策略;对照组在视听双通道任务中平均异步性为正值,体现出追踪的策略倾向。同时,舞蹈组在听觉和视听节奏下同步平均异步性小于视觉刺激,对照组只在视觉刺激中,平均异步性与零更接近。

图1 节奏同步的平均异步性Figure 1. Mean Asynchrony of Rhythm Synchronization
2.1.2 同步准确性——绝对异步性
绝对异步性反映了节奏感知同步的准确性,对两组被试同步的绝对异步性进行2×3重复测量方差分析,结果显示 ,节奏类型主 效 应 显著[F(2,122)=5.195,P=0.012,ηp2=0.078],视听双通道节奏绝对异步性[(23.72±2.65)ms]显著小于视觉节奏[(35.84±4.25)ms],即对视听双通道节奏的同步准确性显著优于视觉节奏,P=0.029。组间主效应显著[F(1,61)=4.334,P=0.042,ηp2=0.066],舞蹈组绝对异步值[(23.47±3.17)ms]显著小于对照组[(32.88±3.22)ms],即舞蹈组节奏同步的准确性高于对照组。但组 别 × 节 奏 间 隔交 互 作 用 不显著[F(2,122)=0.113,P=0.843;图2]。
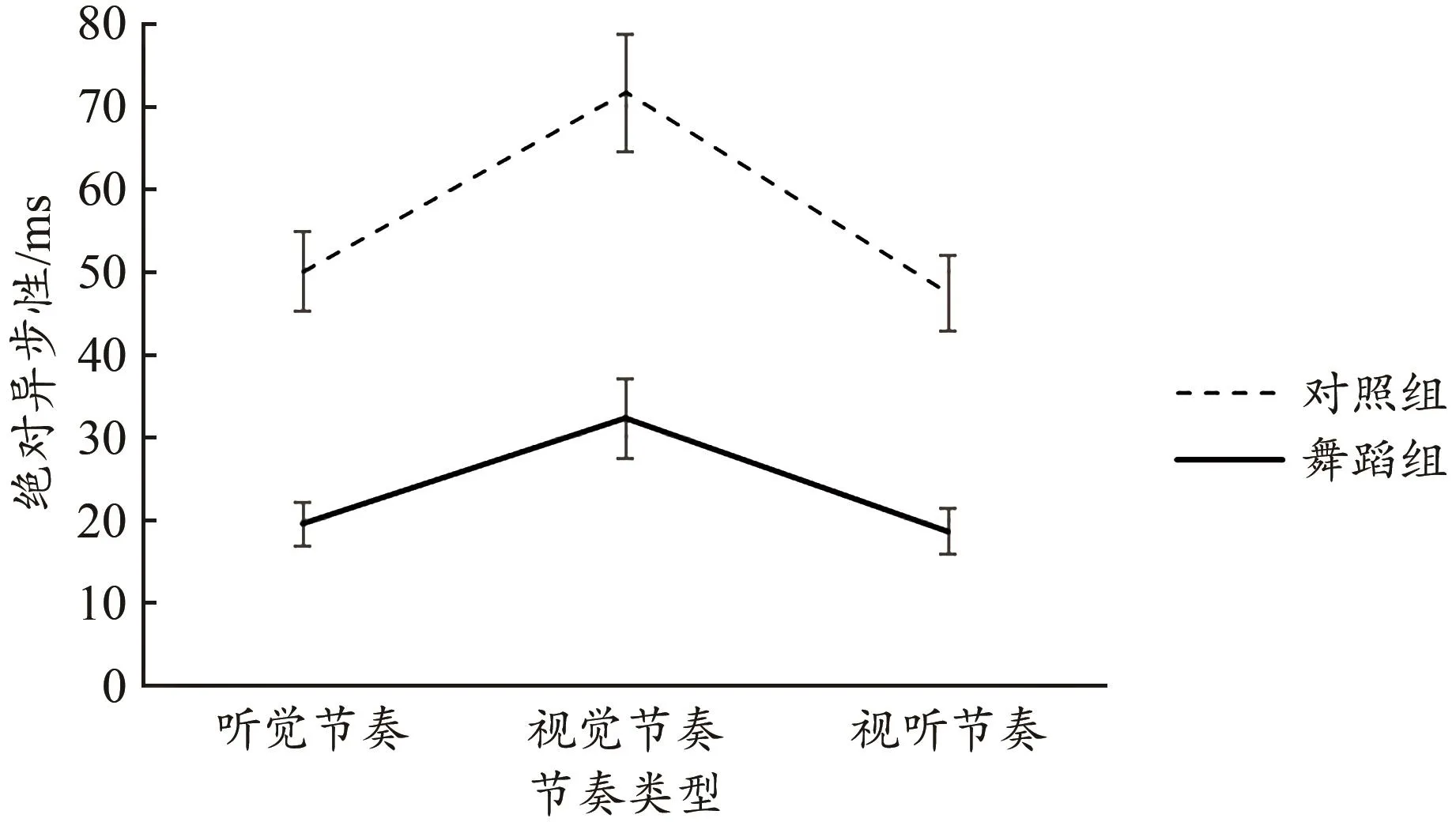
图2 节奏同步的绝对异步性Figure 2. Absolute Asynchrony of Rhythm Synchronization
2.1.3 同步稳定性——标准差
对节奏同步过程的标准差进行2×3重复测量方差分析,结果显示,节奏类型主效应显著[F(2,122)=181.423,P<0.001,ηp2=0.748],视觉节奏刺激同步的标准差(71.13±2.05)显著大于听觉节奏(38.93±1.44)和视听节奏(38.99±1.63),即对听觉和视听节奏的同步稳定性显著优于视觉节奏,P<0.001。组间主效应[F(1,61)=1.210,P=0.276]、组 别×节奏间隔交 互 作 用[F(2,122)=0.741,P=0.452],均不显著(图3)。

图3 节奏异步性标准差Figure 3. Standard Deviation of the Asynchrony
上述研究结果表明,舞蹈运动员节奏感知同步多采用预测策略,对500 ms间隔节奏的感觉运动同步准确性高于对照组,且听觉和视听节奏感知同步能力优于视觉节奏。
2.2 节奏同步的大脑神经活动特征
2.2.1 2 Hz频率
对两组在节奏感知同步过程中(图4),2 Hz频率下的能量进行2×3重复测量方差分析,结果显示,节奏类型主效应显著[F(2,122)=4.732,P=0.011,ηp2=0.072],视觉节奏下能量[(14.93±0.42)dB]显著小于听觉节奏[(16.17±0.33)dB,P=0.032]和视听节奏[(16.04±0.35)dB,P=0.046],即在听觉和视听双通道节奏感知动作同步时,大脑神经活动在2 Hz节奏频率下更加活跃。同时,两组2 Hz频段活动组间主效应显著[F(1,61)=5.76,P=0.019,ηp2=0.086],舞蹈组节奏感知2 Hz能量[(16.36±0.38)dB]显著大于对照组[(15.07±0.38)dB],即节奏同步过程中,舞蹈组与节奏频率共振的神经活动更活跃。但组别×节奏类型交互作用不显著[F(2,122)=0.175,P=0.835]。

图4 Fz电极下被试在3种节奏类型下的2 Hz能量Figure 4. 2 Hz Power of Three Rhythm Types at Fz Electrode
2.2.2 delta波能量
对两组被试在节奏同步过程中,delta波能量进行2×3重复测量方差分析显示,节奏类型主效应显著[F(2,122)=4.42,P=0.016,ηp2=0.068],视觉节奏下delta能量[(14.12±0.35)dB]显著小于听觉节奏[(15.16±0.31)dB,P=0.041]和视听双通道节奏[(14.99±0.32)dB,P=0.031;图5]。组别×节奏类型交互作用不显著[F(2,122)=0.04,P=0.953],两组被试 delta 能量组间主效应不显著[F(1,61)=3.73,P=0.058]。
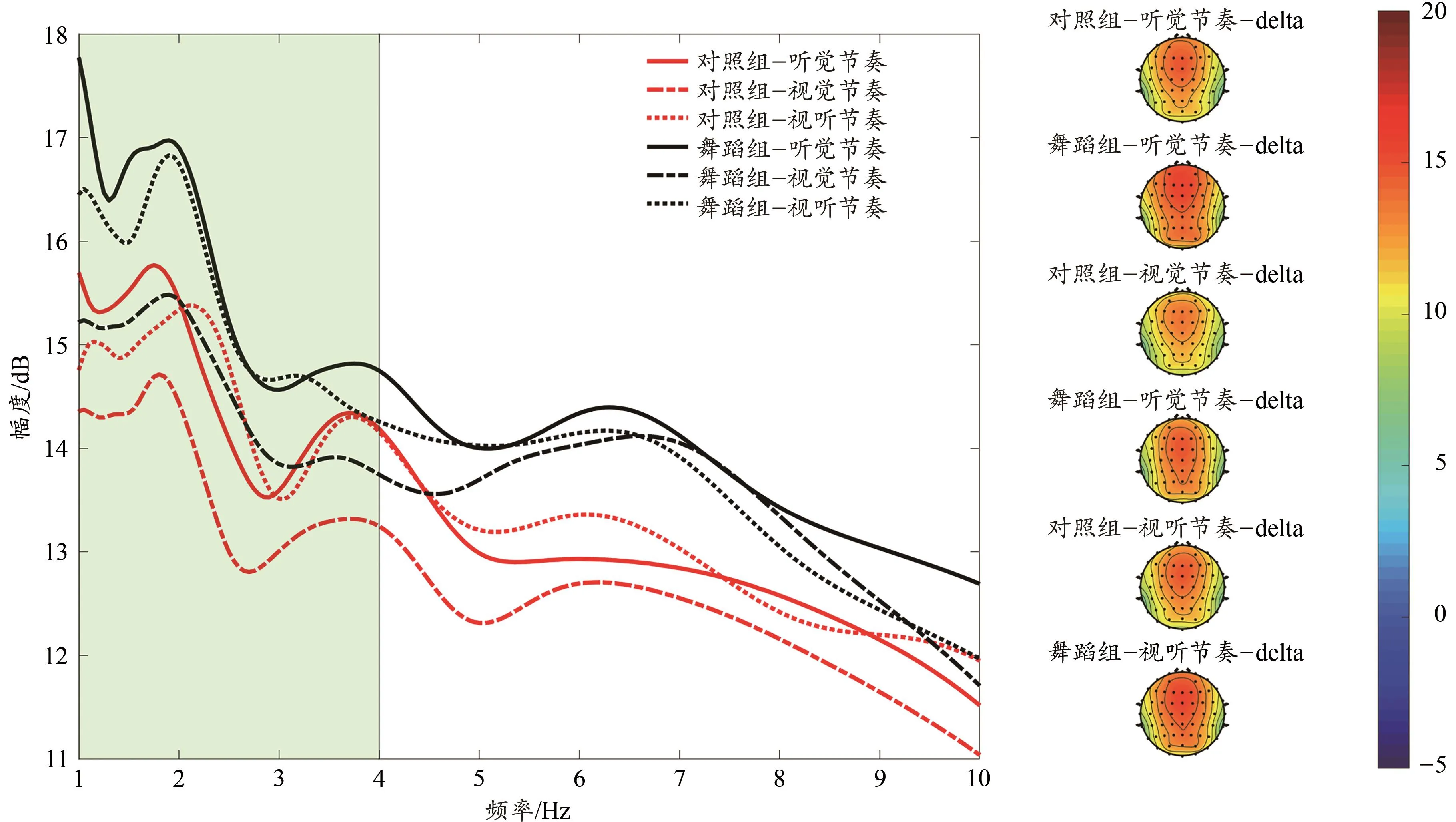
图5 Fz电极下两组被试在3种节奏类型下的delta能量Figure 5. Delta Power of Three Rhythm Types at Fz Electrode in the Two Groups
2.2.3 alpha波能量
alpha波能量的2×3重复测量方差分析显示,节奏类型主效应[F(2,122)=1.37,P=0.258]、节奏类型×组别交互作用[F(2,122)=0.82,P=0.440]、组别主效应[F(1,61)=0.62,P=0.435],均不显著。
2.2.4 low beta波能量
low beta波能量的2×3重复测量方差分析显示,节奏类型主效应[F(2,122)=0.16,P=0.849]、节奏类型×组别交互作用[F(2,122)=2.26,P=0.110]、组别主效应[F(1,61)=2.91,P=0.093],均不显著。
研究表明,节奏同步过程中,大脑神经活动与外界节奏振荡同步,舞蹈运动员2 Hz神经共振能量更大,且在2 Hz和delta频段下,听觉和视听节奏振荡大于视觉节奏。
2.3 节奏同步的事件相关电位特征
2.3.1 节奏刺激N1成分
对节奏刺激诱发的N1成分振幅进行2组别(舞蹈组、对照组)×3节奏类型(听觉节奏、视觉节奏、视听节奏)×2电极点(Fz和FCz)重复测量方差分析,结果显示,节奏类型主效应[F(2,122)=1.68,P=0.190]、组间主效应[F(1,61)=1.02,P=0.316]、电极点主效应[F(1,61)=1.59,P=0.213],以及交互作用均不显著(P>0.05)。
N1潜伏期重复测量方差分析显示,节奏类型主效应显著[F(2,122)=75.22,P<0.000 1,ηp2=0.552],视听双通道刺激节奏潜伏期[(142.17±2.06)ms]显著慢于听觉刺激[(106.42±2.31)ms]和视觉节奏[(123.01±2.03)ms]。组别×节奏类型×电极点交互作用边缘显著[F(2,122)=3.08,P=0.054,ηp2=0.048],简单效应分析显示(图6),对照组中,在Fz电极点下,视听节奏N1潜伏期显著慢于听觉节奏和视觉节奏;在FCz电极下,听觉节奏显著快于视觉节奏和视听节奏,视听节奏显著更慢;在FCz电极下,听觉节奏N1潜伏期显著快于Fz点(P=0.021),但视听节奏相反,Fz电极显著快于FCz电极点(P=0.037)。在舞蹈组中,Fz和FCz电极下,听觉节奏N1潜伏期显著快于视觉节奏和视听节奏,视听节奏显著最慢(P<0.01)。
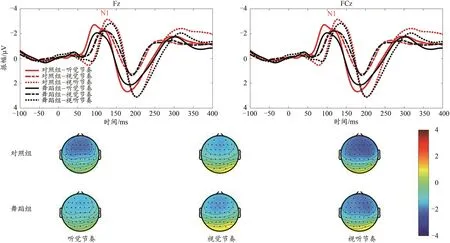
图6 对照组和舞蹈组在3种节奏类型下刺激诱发N1成分Figure 6. Induced N1 Component under Three Rhythm Types in Control Group and Dance Group
2.3.2 节奏刺激P2成分
对节奏刺激诱发的P2成分振幅进行2×3×2重复测量方差分析,结果显示,节奏类型主效应显著[F(2,122)=39.55,P<0.000 1,ηp2=0.393],视觉节奏诱发的P2成分振幅[(0.65±0.20)μV]显著小于听觉刺激[(2.37±0.21)μV]和视听双通道刺激节奏[(2.71±0.26)μV,P<0.000 1]。组间主效应[F(1,61)=0.66,P=0.421]、电极点主效应[F(1,61)=0.30,P=0.589]、组别×节奏类型交互作用[F(2,122)=1.15,P=0.314]、组别×节奏类型×电极点交互作用[F(2,122)=1.21,P=0.303],均不显著。
对P2潜伏期进行2×3×2重复测量方差分析显示,节奏类型主效应显著[F(2,122)=34.56,P<0.000 1,ηp2=0.362],听觉节奏刺激P2潜伏期[(178.27±2.17)ms]显著快于视觉节奏[(197.04±2.58)ms]和视听节奏[(203.72±2.26)ms,P<0.000 1]。组间主效应[F(1,61)=0.551,P=0.461]、组别×节奏类型交互作用[F(2,122)=2.25,P=0.110]、组别×节奏类型×电极点交互作用[F(2,122)=0.259,P=0.735],均不显著(图7)。

图7 对照组和舞蹈组在3种节奏类型下刺激诱发P2成分Figure 7. Induced P2 Component under Three Rhythm Types in Control Group and Dance Group
研究显示,听觉节奏刺激诱发的N1成分和P2成分探测速度均快于视觉节奏和视听节奏,视听双通道节奏探测速度最慢,个体对听觉刺激更敏感,且在脑区间存在差异,同时,听觉和视听节奏诱发的P2成分振幅更大,注意加工程度更深。
3 讨论
节奏感知体现了个体与外界环境的协调同步过程,是感知-运动过程的重要能力之一。本研究在舞蹈经验促进节奏感知的前期研究基础上,选取简单的、适宜人体动作频率的500 ms时间间隔节奏刺激,考察在听觉、视觉和视听双通道节奏同步任务中,舞蹈运动员的节奏感知同步及大脑神经活动特点。研究结果提示,在适宜节奏条件下,舞蹈运动员仍存在节奏同步优势,对不同感觉通道的节奏感知能力均优于普通人,表现为节奏同步的准确性高,多采用预测节奏策略,这一动作同步优势与大脑神经振荡和外界节奏共振强度相关。
3.1 舞蹈运动员节奏感知同步行为优势特征
在众多运动项目中,体育舞蹈集舞蹈艺术与运动特征于一体,舞蹈运动员在感知节奏的同时需要配合肢体的动作进行协调同步,是节奏感知的典型行为表现。考察舞蹈运动员节奏感知特征是研究节奏感知与动作协调的有效途径。在同步打拍子过程中,个体常常会在节奏之前进行同步响应,这一现象称为负平均异步性(nega‑tive mean asynchrony)(Repp,2005)。有研究显示,负平均异步性与音乐训练经验和感觉通道均相关(Repp,2005)。对比平均异步性可发现,舞蹈运动员对3种节奏类型均显示出负平均异步性特征,倾向在刺激出现之前进行预测同步响应,视觉节奏的负平均异步性更明显,这与前期发现的舞蹈运动员对视觉节奏同步绩效较差结果相符(Jin et al.,2019);对照组在视觉节奏方面平均异步性接近零,但是视听节奏同步情况下,同步策略为追踪。换言之,两组被试对感觉通道节奏刺激进行同步时采取的策略不同,并且受到了感觉通道的影响。两组被试平均异步性的差异可以理解为感觉通道优势特征的不同,舞蹈运动员对于听觉相关的节奏刺激更加敏感,而对照组则对视觉刺激较敏感,这与前期研究结果一致(Jin et al.,2019)。
对节奏同步的绝对异步性结果提示,舞蹈运动员在不同感觉通道下的节奏同步任务绩效均显著优于对照组,3种节奏刺激中视觉节奏的同步准确性较差,视听节奏同步性最佳,这一结果与前人的行为研究成果一致(Repp et al.,2013),但本研究未发现两者之间存在交互作用。这可能与本研究选取的节奏频率为多数人偏好的节奏,动作同步难度较小有关。而同步稳定性结果再一次证实了感觉通道间差异,视觉节奏同步的稳定性明显差于听觉节奏与视听节奏,这与日常生活中常见的节奏刺激多为听觉音乐形式相关,人们对听觉节奏则更加敏感。同时,双通道节奏较单通道信息量更丰富,在节奏同步过程中可参考信息更多,提高了准确性和稳定性。由此可以推测,舞蹈运动员在节奏感知同步中的优势与其长期的训练经验相关,在训练和比赛中,舞蹈运动员需要准确对每个节拍进行踩点并协调外界节奏,舞蹈训练不仅可以提高复杂节奏的感知能力,对于个体的适宜节奏同步也有促进作用。
3.2 舞蹈运动员节奏感知同步神经活动优势特征
舞蹈经验可提高个体在节奏感知过程中的准确性和协调性已得到一些研究的证实(Jin et al.,2019;Miura et al.,2011,2016),但以往研究多以行为特征为主,鲜见对舞蹈经验促进节奏感知的神经机制探讨。因此,本研究进一步考察了节奏感知同步过程中的大脑神经活动特征,试图解释舞蹈运动员的节奏感知同步优势。本研究发现,在2 Hz的节奏同步过程中,所有被试均检测出2 Hz的神经振荡,说明大脑神经振荡与外界节奏刺激发生了同步化,这一结果印证了共振理论(Large et al.,2009)。有趣的是,舞蹈运动员神经振荡2 Hz能量显著大于对照组,即外界节奏-大脑神经活动共振更加显著,节奏与大脑神经活动的同步化可能是舞蹈运动员节奏感知同步优势的主要原因。在感觉通道方面,听觉节奏和视听节奏下大脑2 Hz神经振荡能量明显大于视觉节奏,两组被试在听觉相关的节奏同步中诱发了更大的神经共振,这也解释了听觉相关节奏同步绩效更优的行为表现。由此推测,在节奏感知同步过程中,外界节奏与神经振荡同步起到了重要作用,当大脑神经活动与外界节奏刺激产生共振时,动作同步性更好。而在delta能量中,视觉节奏能量明显低于听觉与视听节奏,再一次表明了节奏感知过程中神经振荡与动作同步的关系。然而,在2 Hz和delta频段的能量中,听觉节奏的神经振荡平均能量较视听双通道更大,导致这一结果的可能原因是,在简单的双通道节奏刺激感知过程中,双通道的促进作用较听觉节奏而言并不显著。在对alpha和low beta能量检验中,并未发现明显差异,这可能与节奏频率和任务难度相关,印证了本研究选取的节奏刺激是在两组被试均适宜的频率下进行动作同步检验。为了进一步验证假设,本研究对节奏刺激诱发的ERP成分进行了分析。
基于前期研究和预处理地形图结果,本研究选取了节奏感知常见的前额区和中央区电极点进行分析,主要考察节奏感知过程中,舞蹈经验对节奏刺激的注意资源分配情况。N1成分被认为是与节奏刺激相关的注意主要成分,在研究中,N1成分常与节奏的预测性相联系,对于不一致节奏常能发现更大的N1振幅(Sanabria et al.,2013;Stupacher et al.,2016)。还有研究指出,听觉刺激出现后的N1成分可作为知觉过程中听觉反馈感觉加工过程的标记,在音乐表现中反映了计划和调控过程(Mathias et al.,2017)。但本研究选取的是匀速的节奏,且频率适合人体的律动,因此,并未发现N1成分振幅在感觉通道和两组间的差异。但研究发现N1成分在前额区较活跃,节奏同步过程中参与早期的节奏加工过程(Mathias et al.,2017;Stupacher et al.,2016)。不同感觉通道的节奏在探测速度方面也存在差异,个体对单通道节奏的探测速度显著快于双通道,这可能与通道间的交互作用相关,当出现两种通道的简单节奏时,注意力可能存在分配,从而影响到同步探测的速度。简单效应分析还发现,听觉节奏与视听节奏在电极点上的速度不一致,可能存在脑区加工的差异,需要今后进一步的研究验证。同时,在舞蹈组中发现听觉节奏刺激的探测速度最快,体现出舞蹈运动员对听觉节奏的敏感性。P2成分则主要涉及注意的分配和加工过程(Zhao et al.,2017)。研究结果表明,听觉与视听节奏刺激能引起个体更深的注意加工,而这一加工过程主要在中央区,对应着较晚期的注意成分。P2探测速度方面与N1一样,听觉节奏加工速度最快,这也与听觉节奏同步的动作响应更快结果相符。
4 结论
即使在人体适宜律动节奏下,舞蹈运动员仍表现出节奏感知优势,对听觉有关节奏更加敏感,这一优势与其大脑神经振荡和注意资源投入相关,舞蹈运动员在节奏同步任务中外界节奏与大脑神经振荡共振更明显,同步性更好,对听觉刺激更敏感,探测速度更快。因此,长期舞蹈训练可以有效提高个体的节奏感知能力,并影响神经振荡可塑性。
