肌骨交互视阈下肌骨共减综合症的生物学机制及其运动干预研究进展
2022-05-30赵常红徐道明
徐 帅,赵常红,徐道明,季 泰
肌肉(muscle)和骨骼(skeleton)是维持机体机能形态的基础性组织,肌肉和骨骼在生命早期一起生长发育,以此达到健康机体对新陈代谢和运动调控的需要(Lima et al.,2019)。肌肉收缩可增加肌肉质量和肌肉力量,并传递至骨骼,从而增强骨骼质量和强度,产生更强壮、更有效的骨骼功能;骨骼会分泌相关因子改善肌肉代谢,提高肌肉力量、改善肌肉质量。伴随交互调控机制的深入研究发现,肌肉和骨骼可通过分泌性因子进行相互调节。肌肉和骨骼中生物力学相互作用和生化相互作用均显示出组织功能调节的重要性(Wu et al.,2017)。
在整合思路上,逐渐将肌肉和骨骼作为交互性组织,由此提出肌骨系统(Musculosk‑eletal System)理论。人口统计学认为,肌少症(sarcopenia)和骨质疏松症(osteoporosis)将影响数百万人的运动健康状况。肌骨串扰联络性具有巨大的研究潜质和运动干预研究价值(Wu et al.,2017)。伴随年龄增长,肌少症和骨质疏松症将成为针对老年人机体功能退化的研究重点。由于老年人出现跌倒和骨折等风险增高,肌少症和骨质疏松症共发病机理已被提出,肌骨共减综合症(osteosarcopenia)受到广泛关注(徐帅等,2019;Bonewald,2019;Huo et al.,2015)。
1 肌骨交互视阈下肌骨共减综合症的靶向研究
2021年第七次全国人口普查数据显示:我国60岁及以上老年人口约2.64亿,占人口比例为18.7%;65岁及以上老年人口约1.9亿,占人口比例为13.5%。衰老对肌肉和骨骼质量有着巨大影响,机体大约在同一时段会出现肌肉耗损和骨质流失现象。与骨质流失现象类似,机体肌肉质量丢失自30岁后开始,在60岁之后进入快速衰弱状态(Bonewald,2019)。《老龄蓝皮书:中国城乡老年人生活状况调查报告(2018)》指出:我国约有三成老年人健康状况较好,一半老年人从不锻炼。预计到2050年,全球范围内60岁以上人口约有20%将患有肌少症;到2150年,该人口增至33%左右(徐帅 等,2019;Bonewald,2019)。随着亚健康老年人口增加,肌骨共减综合症患病率将进一步上升,运动作为改善肌肉和骨骼的有效手段,可以缓解由于肌肉和骨骼质量下降带来的系列问题。
在研究骨骼和肌肉之间的相互作用机制中,骨骼调节与肌肉调节密切相关,在生化作用和机械作用(运动干预)过程中,肌肉分泌肌肉因子调节骨骼代谢;骨骼分泌骨骼因子调节肌肉代谢、机能健康状态,骨骼和肌肉交互形成健康机能形态、肌骨系统循环体系;基于老龄化/其他因素引发的肌少症和骨质疏松症,并由此带来的肌骨共减综合症问题亟待解决。肌骨共减综合症、体弱多病老年人表现出身体机能降低和骨代谢异常,与单纯性的肌少症和骨质疏松症相比,肌骨共减综合症功能衰退和骨折风险更高(Drey et al.,2015;Paintin et al.,2018)。伴随老龄化/其他因素原因,肌肉质量下降,生成肌少症;骨骼质量下降,生成骨质疏松症。当共发病出现时,机体形成衰老性非机能健康状态,表现出肌骨共减综合症循环特征(图1)。本研究将以肌骨共减综合症为阐述背景:1)说明肌肉与骨骼之间相互作用的生理机制;2)说明肌骨共减综合症中的生理性变化和调节特点;3)进一步探讨运动干预在肌肉和骨骼之间的作用。

图1 肌骨串扰介导下肌骨共减综合症的功能性调节(Brotto et al.,2015)Figure 1. Functional Regulation of Osteosarcopenia with Musculoskeletal Crosstalk(Brotto et al.,2015)
2 运动干预肌骨共减综合症中肌少症机制调节
肌肉和骨骼之间发生机械相互作用。有研究将肌肉描述为分泌性器官(金晶等,2021),其肌肉因子包括:肌肉生长抑制素(myostatin,MSTN)、鸢尾素(irisin)、β-氨基异丁酸(β‑Aminoisobutyric acid,BAIBA)、脑源性神经营养因子(brain derived neurotrophic factor,BDNF)和白细胞介素(interleukin,IL)等。由此产生的肌肉因子可进一步调节骨骼质量,引发骨微结构发生改变,诱导骨骼质量变化;肌肉收缩诱导具有保护骨骼功能的肌动蛋白分泌(Pedersen,2011;Wu et al.,2017),以肌肉附着于骨骼并收缩,负责骨骼运动。肌肉产生力量是骨骼产生应变的机械载荷来源,而肌少症会引起骨量减少和骨脆性的显著增加。
2.1 肌少症的生理性变化及其运动干预
肌少症指机体肌肉质量随着年龄的增长而下降到2个标准偏差(standard deviation,SD)以下(Carlos,1989),欧洲老年人肌少症工作组(European Working Group on Sar‑copenia in Older People,EWGSOP)将肌少症分为3个阶段:前肌少症、肌少症以及严重肌少症(图2)。与年龄相关的肌少症是由于肌肉质量下降和肌肉力量丧失导致,与肌肉衰老相关的重大结构重组问题,包括慢速氧化(Ⅰ型)肌纤维丧失、快速糖酵解(Ⅱ型)肌纤维萎缩或肌纤维类型转换、神经肌肉接头重塑和选择性丧失(Wilkin‑son et al.,2010),表现为肌肉组织及肌纤维亚群结构紊乱,Ⅱ型肌纤维大量减少,I型肌纤维和脂肪组织增多。有研究显示,80岁老人肌纤维数量会减少50%;老年大鼠肌纤维损失5%~10%(Tarantino et al.,2015)。高龄人群中,高水平促炎因子与肌少症相关,肌肉质量下降和肌肉力量减弱风险更大(Wackerhage,2017)。
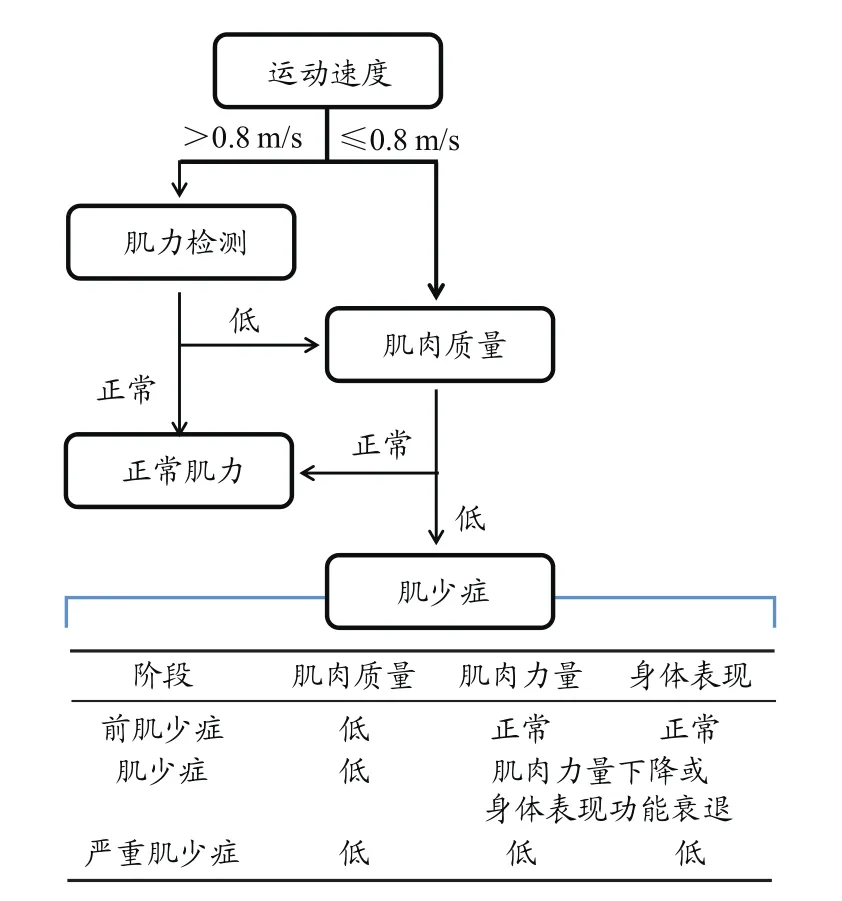
图2 EWGSOP改进的肌少症筛查和分类法Figure 2. EWGSOP Modified Algorithm for Screening and Classification of Sarcopenia
抗阻运动和耐力运动可明显改善肌肉质量和提高肌肉力量,增强老年人运动能力(Snijders et al.,2009)。中等强度跑台运动亦可改善老年小鼠肌肉质量(金晶等,2019)。急性或慢性有氧/耐力运动均会降低肌肉和循环体系中MSTN水平,对(53.1±5.5)岁男性进行6个月中等强度运动(40%~55%V˙O2peak)研究发现,肌肉中MSTN水平降低37%;在对C57BL/6雄性小鼠注射高生理水平的重组MSTN,血浆MSTN水平增加44%(Hittel et al.,2010)。8周运动训练,鸢尾素和胰岛素水平降低(Dundar et al.,2019);急性高强度间歇运动可降低鸢尾素水平,同时提高MSTN水平(Banu et al.,2018)。小鼠自主跑轮运动3周和运动干预者的次最大有氧运动20周后,循环BAIBA水平均显著升高(宗博艺等,2019)。严重破坏性急性肌肉运动做出反应时,血清BDNF水平降低,IL‑6水平升高(Verbickas et al.,2018)。除此以外,老年人在进行抗阻运动后,在第3 h、6 h和24 h进行股外侧肌活性检测,3组10次重复双侧膝关节伸展中,抗阻运动会引起成肌分化抗原基因(myogenicdifferentiation antigen,MyoD)(2.0倍)和生肌调节因子 4(myogenic regulatory factor 4,MRF4)(1.4倍)上调、MSTN(2.2倍)下调(Ziaaldini,2015)。
2.2 肌肉分泌因子在运动调控骨骼内稳态的机制作用
2.2.1 新型肌肉因子MSTN和鸢尾素对骨骼的调控
鸢尾素和MSTN均由肌肉组织合成,二者分泌受运动干预调节作用。MSTN对肌肉质量属于负调节,MSTN隶属于转化生长因子β超家族成员,可负性调节骨骼功能,诱导破骨细胞相关因子表达,增强破骨细胞形成。废用性肌肉萎缩会减少成骨细胞生成(Dankbar et al.,2015;Qin et al.,2017)。对12月龄雌性小鼠腹腔注射抗MSTN抗体,持续12周后,小鼠骨小梁体积增大、骨间距减少、骨细胞数量增加(Le et al.,2017)。与WT小鼠相比,MSTN-/-小鼠肌肉质量增加100%、体质量增加10%、髂腰肌增大50%、骨小梁骨密度(bone mineral density,BMD)提高50%(Hamrick et al.,2010),MSTN-/-小鼠相对骨强度增加30%(Hamrick et al.,2006)。以此推测,在肌骨共减综合症中,随着肌肉质量和骨骼质量的下降,机体内肌肉分泌MSTN水平增加,经由循环调节,MSTN进而抑制骨骼的发生发展,最终使骨骼质量与肌肉质量同步下降。
鸢尾素及其前体在MSTN-/-小鼠的肌肉中高表达,鸢尾素属于运动后肌肉分泌性肌动蛋白,可激活白色脂肪细胞褐变反应,增加机体能量消耗,改善高脂膳食小鼠的葡萄糖耐量水平(Fabian et al.,2014;Wu et al.,2017)。鸢尾素也是调节肌肉对骨骼保护作用的参与者,在体外诱导成骨细胞分化,对骨骼具有合成代谢作用,在控制骨量方面发挥核心功能,对BMD和骨骼机械特性产生积极影响,可以改善后肢垂悬小鼠的骨质疏松症状。在骨骼调节作用中,鸢尾素通过机械作用力诱导骨骼下游信号转导通路,下调骨硬化蛋白(sclerostin,SOST)表达,促进Wnt/β‑catenin通路,调节新骨生成,并将RANKL/OPG保持在健康水平,降低护骨素(osteoprotegerin,OPG)表达(张怡等,2017)。郭丽君等(2019)对肌少症(237例)和非肌少症(343例)人群的研究发现,鸢尾素与肌少症发病程度存在密切关联,肌少症前期鸢尾素含量最高,肌少症严重期鸢尾素含量最低,足球运动员肌肉分泌鸢尾素水平与TB‑BMD之间呈现正相关(Colaianni et al.,2017)。
2.2.2 BAIBA和BDNF对骨骼的调控
BAIBA是运动过程中肌肉产生的小分子物质,属于胸腺嘧啶分解代谢物,分子量为103.6 g/mol(Roberts et al.,2014),是主要的骨细胞保护性因子。但BAIBA保护骨骼作用会随着机体增龄而丧失(Kitase et al.,2018)。肌少症中BAIBA含量下降后,引发BAIBA调节骨质量能力减弱,甚至引发或加重骨质疏松症,使得肌骨共减综合症发生。BAIBA通过受体-γ共激活因子1α(proliferator acti‑vated receptor gamma coactivator 1α,PGC‑1α)收缩肌肉而分泌,在白色脂肪褐变和胰岛素抵抗中起到调节作用,由PPARα途径刺激肝脏白色脂肪褐变和脂肪酸β氧化,改善胰岛素抵抗、肌肉炎症、缓解脂质代谢紊乱(Jung et al.,2018)。BAIBA参与Mas相关G蛋白偶联受体D(mas‑re‑lated g protein‑coupled receptor type D,MRGPRD)的信号传递,通过MRGPRD保护骨细胞以此免受细胞死亡,防止骨细胞中线粒体分解,进而保护骨细胞。
BDNF参与成肌细胞及肌纤维发育和分化,并随肌细胞成熟而下降,抑制卫星细胞或肌祖细胞(muscle progeni‑tor cells,MPC)肌源性分化,BDNF降低可导致成肌细胞早期成肌分化(Mousavi,2006)。其中,BDNF通过原肌球蛋白相关激酶 B 受体(tropomyosin‑related kinase‑B receptor,TrkBR)和p75神经营养蛋白受体(p75 neurotrophin recep‑tor,p75NTR)发挥作用,p75NTR是高分化潜能肌肉前体细胞标志物,正向调控肌发生和肌纤维成熟,损伤小鼠模型体内p75NTR信号传导可阻断肌肉再生(Kalinkovich et al.,2015)。内源性BDNF丧失先于衰老小鼠膈肌内TrkBR活性降低过程(Greising et al.,2015)。此外,BDNF会加重大鼠骨痛感,抗BDNF在骨癌痛中具有明显的镇痛作用(Huang,2018)。BDNF在成骨细胞和软骨细胞中含有受体,且对骨细胞具有积极作用,小鼠BDNF表达缺失会导致骨量增加和白色脂肪组织增加(Tagliaferri et al.,2015)。
2.2.3 白细胞介素对骨骼的调控
白细胞介素中IL‑6、IL‑7和 IL‑15 是参与到肌骨系统调节的肌肉因子。IL‑6属于骨骼前吸收细胞因子,可调节肌肉干细胞中卫星细胞分化,介导骨骼质量提高。机械刺激引起肌管释放,IL‑6促进破骨细胞形成并刺激骨吸收。IL‑6启动子区域的单核苷酸多态性(single nucleo‑tide polymorphisms,SNP)与BMD密切相关。Tagliaferri等(2015)在对38名绝经后骨质减少的女性服用双膦酸盐和骨化三醇分析研究中发现,血清IL‑6与握力和腰椎BMD均呈负相关,经6月治疗后,IL‑6下降,腰椎BMD增加。当IL‑6缺乏亦会表现出骨质疏松、肥胖和胰岛素抵抗等症状(Mi,2017)。
IL‑7作为破骨细胞生成细胞因子,雌性IL‑7-/-小鼠骨髓B淋巴细胞生成和骨量变化与同龄卵巢切除小鼠(ovariectomy,OVX)相一致;IL‑7受体敲除小鼠,抑制骨髓中B淋巴细胞的增殖分化过程(Sato et al.,2007)。与WT小鼠相比,雌性和雄性IL‑7受体敲除小鼠股骨的骨小梁体积显著增加(马剑雄 等,2018;Miyaura,1997)。有研究显示,IL‑15与衰老和年龄有关,肌少症老年人血清IL‑15水平低。肌源性IL‑15可降低肥胖发生,高表达IL‑15小鼠的骨矿物质含量增加(Delphine et al.,2017),IL‑15可刺激大鼠骨髓培养物中多核破骨细胞形成。在无基质培养物中,IL‑15在破骨细胞形成的早期阶段增加单核前破骨细胞数量,低浓度IL‑15(0.1 ng/ml)增加单核类破骨细胞的骨钙素(osteocalcin,OCN)的受体mRNA水平(Ogata et al.,1999)。换言之,IL‑15具有刺激破骨细胞祖细胞分化成前破骨细胞的活性。
2.3 运动干预下肌骨共减综合症中肌肉分泌对骨骼的调节
有研究表明,双X射线吸收法(dual X‑ray absorptiom‑etry,DXA)可用于肌肉质量和BMD检测,低BMD和肌少症的老年人为肌骨共减综合症患者(Hirschfeld,2017),患病者中肌骨交互性显著,肌肉质量下降会直接导致骨骼质量减弱,由于体育锻炼、医疗干预的缺失,机体肌肉质量和骨骼质量下降,会形成体能性非健康状态,在肌骨共减综合症中,肌肉通过运动干预改善肌肉质量,同时机械作用传导促进骨代谢,控制骨量和BMD(图3)。
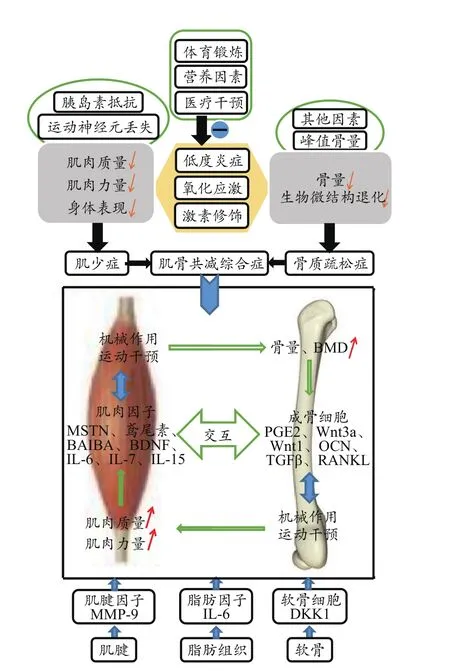
图3 肌骨共减综合症分子机制及因子调节示意图(Tagliaferri et al.,2015)Figure 3. Molecular Mechanism of Musculoskeletal Syndrome and Factor Regulation(Tagliaferri et al.,2015)
与肌少症生理特性相一致,肌骨共减综合症亦存在Ⅱ型肌纤维数量减少、肌肉力量和平衡减弱等特点。在肌骨共减综合症相关研究中,老年男性血清MSTN水平低与肌肉低质量水平有关,而老年女性尚未发现其关联性(Peng et al.,2018)。有研究表明,MSTN-/-小鼠间充质干细胞(mesenchymal stem cells,MSC)分化为成骨细胞比例高,MSTN抑制骨髓干细胞(bone marrow stem cells,BMSCs)增殖和软骨细胞分化,外源性MSTN会加剧肌纤维化,抑制骨骼修复,严重肌肉创伤或肌肉损伤会增加MSTN表达,进而损害骨骼愈合。运动释放鸢尾素会在肌肉内部进行表达,也可作为远端靶器官激素,增加机体能量消耗,减轻肥胖和饮食引起胰岛素抵抗,但是鸢尾素水平会随年龄增长而下降(Fabian et al.,2014)。高水平循环鸢尾素与椎骨骨折发生率低有关,成人骨膜变薄模型中,鸢尾素对骨骼作用受到限制,运动对成人骨骼质量的影响,需要进一步研究探讨鸢尾素与骨折的关系(Park et al.,2019)。在后肢垂悬小鼠实验干预中发现,饮水中提供BAIBA物质即可防止肌肉功能丧失和骨骼质量下降。小鼠跑轮运动可提供循环的BAIBA表达水平(Ginter et al.,2014)。
BDNF参与运动会引起肌肉再生和脂肪氧化,运动后BDNF在脑、血清和肌肉中高水平表达,将BDNF基因转入BMSCs,可治疗脊髓损伤(spinal cord injury,SCI)。自主跑台运动对脊髓损伤中BDNF细胞外信号调节激酶1/2(extracellular signal regulated kinases 1/2,ERK1/2)途径具有重要作用,同时BDNF激活BMSCs移植中的神经再生作用(Kim et al.,2018)。在孕期运动干预吗啡依赖雌鼠发现,BDNF水平升高,可增加大鼠幼鼠BMSCs增殖和幼鼠生存概率,孕期长期服用吗啡能够增加幼鼠BMSCs增殖和生存能力(Haydari et al.,2016),并进一步提高骨骼质量。此外,BDNF参与MAPK途径,进而影响成骨细胞增殖和分化,而siRNA敲除BDNF会降低CREB mRNA和蛋白表达水平,即BDNF通过CREB调节影响成骨细胞分化(Yang et al.,2017)。换言之,BDNF亦是重要的骨质疏松易感基因,影响体内骨骼质量。Calvani等(2017)对社区老年人的调查发现,较低的肌肉质量和伸肌力量弱与炎性因子高浓度的 IL‑6、IL‑10、IL‑12、IL‑13 水平相关,运动可有效降低其分泌水平,提高肌肉质量和肌肉力量,进而改善骨骼质量。在有氧运动或抗阻运动中,IL‑15水平变化存在差异性,马拉松运动员IL‑15 mRNA变化较小,而未经训练男子血清IL‑15水平瞬时增加,2 h后恢复至正常水平(Yalcin et al.,2018)。
3 运动干预肌骨共减综合症中骨质疏松症机制调节
骨骼长期作为惰性器官和硬组织,多作为被动接受器官。伴随骨内分泌系统(bone endocrine system)学说和肌骨交互性研究提出,骨骼作为分泌性组织的特性得到认可,串扰性骨骼因子包括:前列腺素E2(prostaglandin E2,PGE2)、Wnt信号因子、OCN、转化生长因子β(trans‑forming growth factor β,TGFβ)和NF‑Kβ受体活化因子配体(receptor for activation of nuclear factor kappa β ligand,RANKL)等。赵常红等(2017)研究认为,高质量的骨骼对肌肉调节也存在正向调节作用。
3.1 骨质疏松症的生理性变化及其运动干预
1830年,骨质疏松症由Lobstein提出,是一种以低骨量为特征的骨骼疾病,并伴随骨微结构退化,易出现骨脆性增加和骨折风险,主要是骨重建偏向破骨细胞骨吸收等不平衡过程,骨质疏松症在绝经后的女性中发病率高,老年男性相对偏低。运动可为骨骼提供成骨刺激,预防骨质疏松症/骨折的发生发展、维持BMD水平,且老年男性BMD与骨折关联性高于老年女性(Kemmler et al.,2018)。在振动运动干预中,通过机械振动传导,压力会在电位差中诱导骨形成,预防骨质疏松症的发生发展(Weber et al.,2015),同时加强运动亦可提高骨质疏松症患者的肌肉力量、耐力、功能活动以及生活质量。Yetkin等(2019)对(60.3±9.3)岁绝经后女性进行为期6周后伸肌运动干预,分析运动结束时测量结果发现,背伸肌力量、躯干和手臂的耐力、驼背、功能活动性和生活质量等均有显著改善。
Almuktabar(2010)对55~65岁老年女性进行16周运动干预发现,渐进式抗阻运动与骨质疏松症预防锻炼(os‑teoporosis prevention exercise,SPO)相比,渐进式抗阻运动具有高运动强度和短时间内提高BMD水平的能力。在一项为期10个月的有氧运动研究显示,老年男性和老年女性IL‑6浓度降低,可显著促进运动水平与骨质疏松症的逆向关系(Paintin et al.,2018;Tartibian et al.,2011)。闭经运动员应激性骨折风险高于普通运动员,同时与大强度运动训练的压力性骨折有关(Wolman,1994)。绝经后骨丢失和雌激素耗竭存在显著联系,在老年女性中,运动对BMD具有积极作用,包括步行、抗阻运动、步行+抗阻运动、抗阻运动+冲击负荷活动,以及抗阻运动+太极拳等,均具有显著改善骨骼的效果(Bolam et al.,2013)。
3.2 骨骼分泌因子在运动调控肌肉内稳态的机制作用
3.2.1 PGE2对肌肉的调控
PGE2由花生四烯酸经环氧合酶途径合成,是原代成肌细胞中的成肌分化刺激物,可加速肌肉成肌分化。研究发现,骨细胞产生的PGE2比肌细胞分泌量高100倍以上,PGE2可从骨骼集中释放,由缝隙连接蛋白43(connexin,Cx43)半通道从骨细胞中释放,可增强肌生成和肌肉功能,全身性注射PGE2可刺激体内骨形成(Gil et al.,1999;Tartibian et al.,2011)。成骨细胞中Cx43靶向敲除可降低皮质骨厚度,导致趾长伸肌(extensor digitorum longus,EDL)肌肉表型缺陷(Bonewald,2019)。机体骨骼PGE2合成酶及PGE2受体存在Ⅰ型肌纤维和Ⅱ型肌纤维的差异性表达(Liu et al.,2016),PGE2/COX途径酶及受体在Ⅰ型肌纤维和衰老肌肉中通常较高,在病理上PGE2在气道炎症和肌肉增生中起保护作用(Sastre et al.,2011)。PGE2结合G蛋白偶联受体亚型中的EP4调控肌肉代谢,PGE2诱导C2C12成肌细胞肌生成的加速,与细胞内钙稳态显著相关(Mo et al.,2012)。
3.2.2 传统经典Wnt信号途径对肌肉的调控
Wnt/β‑catenin途径与机械传感/转导在骨细胞中紧密相连,在骨代谢中起主要作用,同时在成年胚胎肌肉发育和维持肌肉稳态中起重要的作用,Wnt/β‑catenin途径激活会加剧肌纤维损伤水平。胚胎早期Wnt信号激活肌肉因子中,Wnt1在骨细胞中高表达,Wnt3a由骨细胞响应切应力产生,将支持肌肉发生和肌肉功能(Huang et al.,2017),参与肌原性程序控制和卫星细胞分化,支持肌肉发生、提高肌肉功能。Wnt3a受机械应力调节,运动可有效提高骨骼质量,进一步调控肌细胞功能,骨细胞样MLO‑Y4细胞培养基(conditioned medium,CM)内抑制Wnt3a,使比目鱼肌收缩力显著减弱。Wnt3a激活可抑制p85α、IGF‑1和Bmyb表达,这些蛋白协同作用会削弱肌祖细胞增殖,从而导致肌肉萎缩(Hu et al.,2014)。
Wnt3a激活转录激活因子3(signal transducers and acti‑vators of transcription 3,STAT3)调节C2C12成肌细胞分化(Huang et al.,2017),注射Wnt3a重组蛋白至小鼠体内,引起小鼠肌祖细胞向纤维祖细胞转化,注射Wnt抑制剂后,会抑制肌祖细胞向纤维祖细胞转化水平(刘晓光等,2018;Brack et al.,2007)。Cx43调节成骨细胞Akt和β‑catenin活性,协同增强 Wnt/β‑catenin 信号传导(Gupta et al.,2019)。Wnt/β‑catenin途径通过增加OPG/RANKL水平,促进成骨细胞增殖和矿化。
3.2.3 骨内分泌OCN对肌肉的调控
OCN是由骨细胞和成骨细胞分泌的能量代谢物质,属于非胶原蛋白,内含有3个γ-羧基谷氨酸,在Ca2+的环境下,促进矿物质沉积和骨重建。OCN以两种结构存在:与羟基磷灰石结合的羧化GlaOCN和释放到血液循环中的羧基化GluOCN,其中无活性GlaOCN可转化为有活性GluOCN,GluOCN通过作用于G蛋白偶联受体C家族6组A(g protein‑coupledreceptor family class C group 6 subtype A,GPRC6A)进一步刺激cAMP/CREB,诱导肌肉代谢表达(徐帅等,2018)。GPRC6A-/-小鼠肌肉质量减弱,胚胎干细胞磷酸酶(embryonic stem cell phosphatase,Esp)基因为抑制OCN功能的磷酸酶,在成骨细胞和Sertoli细胞中编码并影响能量代谢,其中Esp-/-小鼠肌肉质量增加。
OCN在破骨细胞pH 4.5酸性环境中,脱羧形成GluOCN进入GPRC6A循环体系,增强肌肉中葡萄糖摄取、提高线粒体生成。GPRC6A介导肌纤维OCN信号传导,OCN-/-小鼠肌肉中GPRC6A表达水平比WT小鼠肌肉内GPRC6A表达水平低(Mera et al.,2016)。补充OCN可恢复小鼠运动能力并增强肌肉强度。有氧运动增加循环OCN水平,诱导肌肉OCN信号传导,导致肌动蛋白IL‑6生成。除此以外,OCN作为骨内分泌系统核心因子,亦调节下丘脑神经递质合成与海马发育、脂肪组织脂联素和胰岛素敏感性、肝脏胰岛素敏感性、胰腺β细胞增殖和雄性性腺睾酮生成(徐帅 等,2017;Han et al.,2018)。
3.2.4 TGFβ和RANKL对肌肉的调控
TGFβ主要来源之一是骨骼,由成骨细胞分泌,TGFβ存在TGFβ1、TGFβ2、TGFβ3 3种亚型,骨细胞缺乏TGFβ信号传导会增加骨脆性。通过TGFβ和Akt/mTOR信号通路参与调节,进而增强老年肌少症身体活动能力或减少老年跌倒发生(Morley et al.,2014)。TGFβ在骨骼与肌肉之间发挥作用,骨骼中乳腺癌细胞释放TGFβ会导致肌肉消瘦(Bonewald,2019;Waning et al.,2015)。TGFβ抑制肌卫星细胞、生肌分化、肌祖细胞融合以及蛋白表达,促进胶原蛋白合成、肌母细胞纤维化。对雄性衰老大鼠进行干预,运动组大鼠的体质量和腓肠肌比重均有所提高,并引起MSTN水平降低,进而抑制TGFβ通路并缓解衰老肌肉流失(王今越等,2014)。
RANKL可促进破骨细胞分化,增强成熟破骨细胞活性,其受体为 NF‑κB 受体活化因子(receptor activator of nuclear factor kappa β,RANK),并在肌肉中表达。肌肉中RANKL可以调节Ca2+储存和肌浆网Ca2+‑ATPase活性。肌肉内受体RANK表达在营养不良中发挥作用,其抗肌萎缩蛋白缺陷Mdx小鼠遗传缺失导致肌肉力量明显改善(Dufresne et al.,2018;Langdahl et al.,2015)。
3.3 运动干预下肌骨共减综合症中骨骼分泌对肌肉的调节
运动可有效提高肌骨共减综合症的生理性状,骨骼通过运动机械负荷激活信号传导途径促进骨代谢,骨骼质量提高,骨骼分泌因子进而提高肌肉代谢,改善肌肉代谢水平(图3)。Marques等(2011)对老年女性进行每周3次共8个月的运动干预发现,抗阻运动下大转子(2.9%)和全髋关节(1.5%)的BMD升高,身体水平得到显著改善,且8个月的抗阻运动比有氧运动更有效,使得BMD和肌肉力量发生有利变化,而两种干预措施均可以防止与摔倒风险密切相关的功能平衡控制。换言之,长期抗阻运动或直接应力刺激可提高BMD,抑制骨质流失,继而改善肌纤维结构化和肌肉重塑(徐帅等,2019)。OVX大鼠模型中,运动可上调老年大鼠胫骨上段OVX引起的松质骨丢失所需PGE2水平(Mo et al.,2002),最终导致机体质量增强。
3月龄SD大鼠经60天有氧运动后去卵巢造模,形成骨质疏松大鼠模型,运动后BMD和OCN水平显著提高(Sun et al.,2015),OCN会影响肌肉组织,运动前服用OCN可增加年轻小鼠运动能力,并恢复老年小鼠有氧耐力,OCN甚至增加老年小鼠肌肉质量。Tagliaferri等(2015)采用跑台实验测试肌肉功能发现,减少OCN-/-小鼠跑步距离、降低最大速度和跑台时间,小鼠肌肉功能明显降低。运动还可以提高骨骼中TGFβ分泌表达,进而改善肌肉质量,通过运动改善肌肉效果,亦会调节肌肉TGFβ水平,缓解肌肉快速流失过程。有研究表明,WT小鼠注入RANKL后3天引起骨量丢失,中等强度跑台运动上调骨OPG表达、下调RANKL表达,降低RANKL/OPG比重,增加OVX大鼠BMD。此外,软骨细胞分泌骨抑制Dickkopf相关蛋白1(Dickkopf‑1,DKK1)、脂肪细胞分泌脂肪因子、肌腱分泌肌腱因子亦会共同促进肌肉和骨骼代谢(图3)。
4 小结与展望
肌肉和骨骼作为运动性两大器官,是一个整体性结构,存在通信网络,共同承担着机体运动、免疫、营养等功能,其发生发展的过程受到彼此间的相互调节。肌肉和骨骼串扰的生化理论和干预机制不是排他性的功能调节,而是一种互补互惠生理机制。尤其是将肌肉分泌因子如何调节骨质疏松症、骨骼分泌因子如何调节肌少症作为研究靶点,逐渐成为现代老年医学和运动人体科学的研究热点。梳理文献发现,运动通过介导肌肉分泌因子支持骨骼的发生发展,进一步作用于衰老机体内肌肉分泌MSTN、鸢尾素、BAIBA、BDNF和白细胞介素串扰水平,以此对骨骼质量产生积极影响。同时运动通过介导骨骼分泌因子 PGE2、Wnt信号因子、OCN、TGFβ和RANKL等,形成对骨骼和肌肉的调控功能及闭合式循环回路,即肌肉—骨骼、骨骼—肌肉双项改善,为调节肌骨共减综合症提供了更为深入的立足点。
将肌骨共减综合症延伸贯通进行更深入的靶向研究,仍需要探讨:1)肌少症中出现肌肉因子变化,干预骨质疏松症变化外,对肌肉自身比重的影响。反之,骨质疏松症出现骨骼因子变化,干预肌少症变化外,对骨骼自身比重的影响;2)单独性肌肉质量或骨骼质量下降对肌骨共减综合症影响显著,还是肌少症和骨质疏松症交互对于加重肌骨共减综合症的调节更重要;3)干预效果中,有氧运动、抗阻运动以及组合运动可明显改善肌骨共减综合症,但是其干预机制对肌少症和骨质疏松症的相互影响更明显,还是运动分别改善肌少症和骨质疏松症更显著。尤其是组合运动模式在促进机体平衡、协调、肌骨共减综合症稳定方面有着显著效果。在未来的研究中,多式联动治疗将成为未来调节肌骨共减综合症的新方向。
