不同饲养方式下苏尼特羊肌纤维组成和羊肉品质的比较研究
2022-05-29侯艳茹徐丽媛王晨蕾赵丽华
孙 冰,侯艳茹,徐丽媛,王晨蕾,靳 烨,赵丽华,图 雅,苏 琳,
(1.内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特 010018;2.宁夏大学食品与葡萄酒学院,宁夏银川 750021;3.乌拉特中旗农牧和科技局,内蒙古乌拉特中旗 015300)
羊肉以富含优质蛋白质、矿物元素(如铁和锌)、肉质细嫩等特点而深受广大消费者青睐。羊肉的消费量不断攀升,并且养羊业由于投入资金量少、育肥周期短、经济效益显著的特点,已成为国内外畜牧业发展的重要组成部分[1]。目前,肉羊传统放牧方式一方面由于禁牧、限牧政策的实施以及集约化的生产要求,另一方面草原上的牧草质量、产量随季节的交替而波动,且四季营养不均衡,饲用价值、产草量降低,这些都是导致放牧羊的采食量下降、营养摄入不足的原因,因此需要通过舍饲和补饲的方式来实现肉羊的营养均衡,不同的饲养方式直接影响肉羊的生长性能及肉品质等特性[2]。肌纤维是骨骼肌的基本组成单位,伴随着动物的出生,其数量就已确定,但其类型之间可以互相转化,遵循Ⅰ型↔Ⅱa ↔Ⅱx/d ↔Ⅱb 的顺序,其生物学特性(密度、横截面积及类型分布等)都是影响肉品质的重要因素[3]。
有研究指出,放牧羊补饲含有大麦、玉米、豆粕、维生素添加剂和矿物元素的精料时,羊肉的氧化稳定性、营养价值和风味物质均有显著性的提高[4]。尹丽卿[5]对比了放牧和圈养两种饲养方式下苏尼特羊三个部位(臂三头肌、股二头肌、背最长肌)的肌纤维类型分布,发现圈养羊的酵解型肌纤维含量在三个部位中均高于放牧条件下的。以上结论说明饲养方式对反刍动物的肉品质和肌纤维类型的分布均有影响。增加肌肉中的Ⅰ型和Ⅱa 型肌纤维的占比,肉质也就越细嫩[6]。降低肌肉中Ⅱx 型和Ⅱb 型纤维的占比,能使宰后猪肉pH 下降速度减慢,改善肉品质[7]。
目前针对三种饲养方式间苏尼特羊胴体品质、屠宰性能及肌纤维生物学特性的全面研究较少,因此本研究以苏尼特羊为研究对象,分析放牧、放牧+补饲和舍饲三种饲养方式下肉品质指标,之后通过ATPase 染色法和MyHC mRNA 表达量的测定对肌纤维类型进行定性和定量的划分,对肌肉重要代谢酶活力进行比较,旨在探究不同饲养方式间苏尼特羊屠宰性能、肉品质及肌纤维特性的差异性,为日后通过改变饲养方式进而改善肉品品质提供理论依据。
1 材料与方法
1.1 材料与仪器
30 只苏尼特羊 在内蒙古乌拉特中旗哈拉图嘎查顺遂牧区饲养,在草原恒通食品有限公司进行屠宰,宰后 1 h 内取苏尼特羊背最长肌为实验材料。本实验中饲喂舍饲和放牧+补饲的苏尼特羊基础日粮组成及营养水平见表1;青贮饲料、葵花饼 牧民自制;精饲料 恒牧饲料科技有限公司;异戊烷 阿法埃莎(天津)化学有限公司;巴比妥钠 山东西亚化学股份有限公司;三磷酸腺苷二钠盐(ATP) 北京酷来搏科技有限公司;无水乙酸钠、无水氯化钙 国药集团化学试剂有限公司;氯化钴 天津市福晨化学试剂厂;异丙醇 上海振兴化工二厂有限公司;硫化铵上海麦克林生化科技有限公司;以上试剂均为分析纯。RNAiso Plus、TB GreenTM Premix Ex TaqTM II、PrimeScriptTM RT Reagent Kit with gDNA Eraser 试剂盒 大连宝生物工程大连有限公司;苹果酸脱氢酶、琥珀酸脱氢酶、乳酸脱氢酶试剂盒 南京建成生物工程研究所。

表1 试验羊日基础饲粮组成及营养水平(%)Table 1 Basic diet composition and nutritional levels (%)
Leica 4000B 显微镜 德国徕卡公司;MEV 冰冻切片机 德国 Slee 公司;Eppendorf 5417 冷冻离心机 德国Eppendorf 生物公司;DSH-300A 回旋式水浴恒温振荡器 上海雅荣生化设备仪器有限公司;凝胶成像分析系统 美国 Bio-Rad 公司;LightCycler®96 实时荧光定量 PCR 仪 罗氏诊断产品(上海)有限公司;YNERGY H1 型酶标仪 美国 Bio-Tek Instruments 公司;Biometra PCR 扩增仪 北京北方华奥贸易有限责任公司;C-LM3B 型数显式肌肉嫩度仪 东北农业大学工程学院;STC-P2A 全自动测色色差计 上海生物生化实验仪器公司;pH-STAR型胴体 pH 值直测仪 德国 Matthaus。
1.2 实验方法
1.2.1 实验动物的饲养管理 本实验所有实验动物于2018 年6 月~9 月在内蒙古乌拉特中旗哈拉图嘎查顺遂牧区饲养,选取体质量为(17.16±3.33)kg 的3 月龄苏尼特羊30 只,设置为舍饲(C)、放牧+补饲(S)、放牧(P)三个组别,每组10 只,饲喂期间自由饮水。预实验期7 d,实验期90 d。屠宰前试验羊禁食24 h、停水2 h,依照穆斯林阿訇屠宰要求屠宰30 只苏尼特羊。 舍饲组日粮:精饲料(10 kg)、青贮饲料(8 kg)和葵花饼(5 kg),并且每月依次增加精饲料(2 kg)、青贮饲料(8 kg)和葵花饼(5 kg);放牧+补饲组日粮:饲料种类和重量与舍饲组一样;放牧组日粮:自由放养,主要食用芨芨草,石针茅等牧草,不饲喂其它饲料。
1.2.2 屠宰性能和胴体品质的测定 屠宰性能的测定:分组前重指饲养管理开始前所有试验羊的体重;宰前活重指试验羊屠宰前禁食禁水后的体质量;总增重量指饲养管理到宰前这期间试验羊体重的增长量;棒骨、脊骨、肋骨重量指胴体剔除每一部分的肉后,肋骨、棒骨、脊骨分别称重;净肉重量指剔除骨头后试验羊胴体所剩余的净肉质量;净肉率(%)=净肉重量/活体重量×100;屠宰率(%)=胴体重量/活体重量×100;胴体产肉率(%)=净肉重量/胴体重量×100;骨肉比(%)=骨重量/净肉重量×100。
胴体品质的测定:胴体重量指试验羊屠宰放血后,去除头、尾、四肢、淋巴、内脏、皮毛,胴体静置30 min 后重量;胴体长将试验羊胴体倒挂,测得的耻骨联合前缘到第一颈椎前缘之间的长度;胴体宽是试验羊肋骨末端到脊骨之间测得的距离;背膘厚指试验羊背部脂肪的厚度。
1.2.3 羊肉品质指标测定 在羊屠宰后取左半胴体背最长肌(longissimus doris muscle,LD)对各项肉品质指标进行测定。使用全自动色差仪测定肌肉色泽,a*值表示红绿度、b*值表示黄蓝度、L*值表示亮度;参照侯普馨等[8]论文中的方法计算肌肉蒸煮损失;使用pH-STAR 型胴体直测式pH 计最初pH(pH45min),静置排酸24 h 后测得的pH 记为pH24h;CLM-3 型嫩度仪测定肌肉剪切力,每次测定重复6~8 次。
1.2.4 组织学特性测定 试验羊屠宰后45 min 内,顺沿肌纤维方向将肌肉切割,用刀片修整为体积约为0.5 cm×0.5 cm×1 cm 的块状,放进异戊烷(需提前经液氮预冷)中脱水干燥30 s,观察到肉块颜色完全脱水发白后投入液氮中,存放在无酶无菌冻存管中,−80 ℃的条件下长期保存。用于后续肌纤维组织的冰冻切片。
按照上述方法采集好的样品置于−25 ℃冰冻切片机中包埋并冷冻,将其切成10 μm 厚的横断面[9],组织切片通过ATP 酶组织化学染色法[10]进行染色,染好的组织切片在Leica 4000B 荧光倒置显微镜10×10 倍下观察,选择2~4 个分型清晰的视野,通过Leica Qwin V4.4 彩图软件分析肌纤维的密度、直径、横截面积、数量比例和面积比例[11]。
1.2.5 基因表达量的测定
1.2.5.1 样品采集 取80~100 mg 背最长肌肌肉块保存−80 ℃的冰箱中,用于后续实验总RNA 的提取。
1.2.5.2 RNA 提取与反转录 利用实验室传统的Trizol 抽提法,按照RNAiso Plus 的指导书提取肌肉中总RNA[12]。总RNA 浓度和纯度(A260nm/A280nm)用微量分光光度计和核酸蛋白分析仪测定。用1%的琼脂糖凝胶电泳检测并用凝胶成像系统曝光拍照以验证实验中提取好的总RNA 是否完整。反转录参照说明书进行,将合成的质量浓度为50 ng/μL 的cDNA 稀释到10 ng/μL 用于后续实验基因表达量的测定[13]。
秀容川的瞳孔再次变成赤金色,这是他的一门秘术:小满瞳。施展小满瞳后,目光就成了兵器,就是一只蚂蚁,呈现在小满瞳中,也如大象一般巨大。
1.2.5.3 引物序列及合成 实验所需MyHCs 基因序列引自尹丽卿、马晓冰论文[5,14],其他基因序列利用NCBI 网站设计,本实验中所有基因序列由生工生物公司(上海)合成,详细序列见表2 所示。

表2 引物序列Table 2 Primer sequences
1.2.5.4 实时荧光定量PCR 扩增 以cDNA 为模板,使用定量试剂盒(TB GreenTM Premix Ex TaqTM II),以GAPDH 为管家基因,对实验中多个目的基因进行实时荧光定量分析。PCR 反应条件为:预变性:95 ℃,30 s;变性:95 ℃,5 s;退火:58 ℃,30 s;延伸72 ℃,30 s;变性、退火、延伸三个过程进行45 个循环;延伸72 ℃,10 min。采用2−ΔΔCt法对数据进行处理。
1.2.6 酶活力测定 苹果酸脱氢酶、琥珀酸脱氢酶、乳酸脱氢酶活性均按照南京建成测试盒附带说明书进行。
1.3 数据处理
所需实验数据用SPSS25.0 进行统计学分析,分析结果全部用平均值±标准差表示。实验结果用单因素方差法进行差异性分析。P>0.05 表示组间差异不显著,P<0.01 表示组间差异极显著,P<0.05 表示组间差异显著。
2 结果与分析
2.1 三种饲养方式下苏尼特羊屠宰性能和胴体品质的差异比较
由表3 可知。放牧组和放牧+补饲组宰前活重量显著低于舍饲组(P<0.05);放牧组总增重量、净肉重、净肉率、产肉率、屠宰率、胴体重、背膘厚显著低于放牧+补饲组和舍饲组(P<0.05),脊骨重量和胴体长显著低于舍饲组(P<0.05),骨肉比显著高于放牧+补饲组和舍饲组(P<0.05)。

表3 三种饲养方式下苏尼特羊屠宰性能和胴体品质的差异比较Table 3 Differences in slaughter performance and carcass quality of Sunit sheep under three typical feeding patterns
屠宰性能和胴体品质主要受遗传、环境、性别、饲料和饲养管理等多方面因素的共同影响,在相同条件下饲粮是影响的主要因素。本实验结果显示,舍饲和放牧补充精料的方式都能够不同程度的提高苏尼特羊宰前总增重量、屠宰率、净肉率等指标。解进等[15]指出,在育肥期结束时,与传统的放牧方式相比,放牧后补饲精料的方式能够使呼伦贝尔羔羊的净肉质量、胴体质量、屠宰率、净肉率均有不同水平的积极影响,其中净肉质量最高可提高40.55%。Turner等[16]研究指出,与自然放牧方式下相比,放牧并补充全棉籽的方式会显著提高萨福克羔羊的胴体质量和肋骨面积。全舍饲的饲养方式可使得岗巴羊的宰前活体重量和平均日增重均显著高于纯自然放放牧和放牧后补充精料的方式[17]。王宏博等[18]报道,补饲的季节对于羔羊的生长性能也有一定的影响,在夏季给放牧羊补充精料的饲养方式能使得羔羊的宰前活体质量、胴体净肉质量、屠宰率等都优于纯放牧方式。以上结果说明舍饲和放牧+补饲对肉羊的屠宰性能有积极的改善作用,但对于各指标具有不同的效果。
2.2 三种饲养方式下苏尼特羊羊肉品质的差异比较
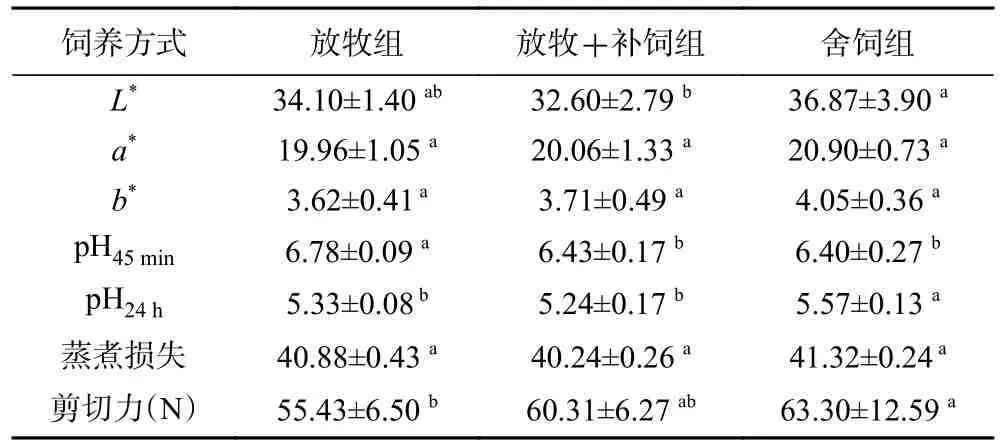
表4 三种饲养方式下苏尼特羊肉品质的差异比较Table 4 Differences in mutton quality of Sunit sheep under three typical feeding patterns
肉色作为评价肉品质的最直观指标,其中其关键作用的物质是肌红蛋白,肌肉色泽的差异主要是由于不同类型肌纤维中的肌红蛋白的含量有所不同所导致。因为氧化型(Ⅰ型+Ⅱa)肌纤维中肌红蛋白含量较高,所以氧化型肌纤维比例高的肌肉呈现的肉色愈加鲜红。本实验中放牧和放牧+补饲的苏尼特羊在L*优于舍饲组,三组间a*、b*值没有显著差异(P>0.05)。与此一致,王敏研究指出,放牧和舍饲两种饲养模式下肉牛的色泽并没有显著的差异性[19]。但是也有研究表明放牧羊L*和a*值显著高于舍饲方式下的[20]。饲养管理、肌肉部位、品种以及屠宰方式的差异都是影响畜禽胴体肉色的因素。pH 可以反映试验动物屠宰后肌肉糖原酵解水平和速率。刚屠宰后动物的肌肉pH 范围是 6.0~7.0,肌肉pH 的下降速度过快一方面会破坏水与蛋白质二者的结合,另一方面会影响肌肉组织的蛋白特性,进而对多项肉品质指标产生不利影响[21]。本实验中所有苏尼特羊屠宰后肌肉的pH0均处于正常区间,而冷库静置排酸24 h 后,结果却显示为放牧组和放牧+补饲组显著小于舍饲组(P<0.05),这极有可能是因为pH 下降速率和回升速率快,加快了肉的成熟速度。肉质嫩度与剪切力呈负相关,剪切力值的大小可以直接反映肉质是否足够鲜嫩[22]。本研究中得出的结果说明放牧和放牧+补饲方式下饲养的羊肉嫩度要优于舍饲方式下的,与此结果一致,有研究表明与放牧+补饲和全舍饲方式下饲养的岗巴羊相比较,纯自然放牧条件下的羊肉更加细嫩[17]。De 等[23]研究指出,在不同放牧方式下饲养的羔羊肉剪切力值没有显著差异。放牧+补饲条件下,绒山羊母羔肉质较羯羔嫩且新鲜,营养价值更高[24]。这可能是由于基础日粮营养水平、动物饲养管理、性别和品种等多种因素的不同而引起的差异。
肌纤维直径的大小、类型的分布以及各型纤维的数量占比均与羊肉品质紧密相关,因此,本实验对肌纤维的组织学特性进行了测定,以期从肌纤维角度探寻三种饲养方式下肉品质差异性的原因。
2.3 三种饲养方式下苏尼特羊肌纤维特性的差异比较
2.3.1 苏尼特羊背最长肌的 ATP 酶染色结果 如图1所示,在10×10 倍显微镜下观察到肌纤维排列紧密、轮廓清晰且分型明显。因为不同类型肌纤维内的ATP 酶对酸和碱的稳定性有所差异,可将其划分成三种类型,Ⅰ型(慢速氧化型)肌纤维在pH4.60条件下的ATPase 活性最强,呈黑色;Ⅱa 型(快速氧化-酵解型)肌纤维的ATPase 在pH4.60 条件下受到抑制,无法参与染色反应,呈白色;Ⅱb 型(快速酵解型)肌纤维在pH4.60 条件下具有一定的ATPase 活性,颜色呈棕褐色[25]。

图1 三种饲养方式下的苏尼特羊背最长肌 ATPase 染色结果Fig.1 ATPase staining results of LD of Sunit sheep under three feeding patterns注: S:放牧+补饲组;P:放牧组;C:舍饲组。
2.3.2 放牧、放牧+补饲和舍饲三种饲养方式下苏尼特羊肌纤维特性的差异比较 根据表5 可知,相比于舍饲组,放牧+补饲组Ⅱa 型肌纤维面积和数量比例显著升高(P<0.05),肌纤维密度显著增加(P<0.05),Ⅱb 型肌纤维直径和面积比例显著降低(P<0.05);放牧组Ⅱa 型肌纤维面积和数量比例显著增加(P<0.05),肌纤维密度显著增加(P<0.01),Ⅱb 型肌纤维直径、面积和数量比例显著降低(P<0.05),Ⅱb 型横截面积极显著降低(P<0.01),Ⅰ型和Ⅱa 型肌纤维的直径和横截面积显著降低(P<0.05)。放牧+补饲组Ⅱa 型肌纤维直径和横截面积显著高于放牧组(P<0.05)。
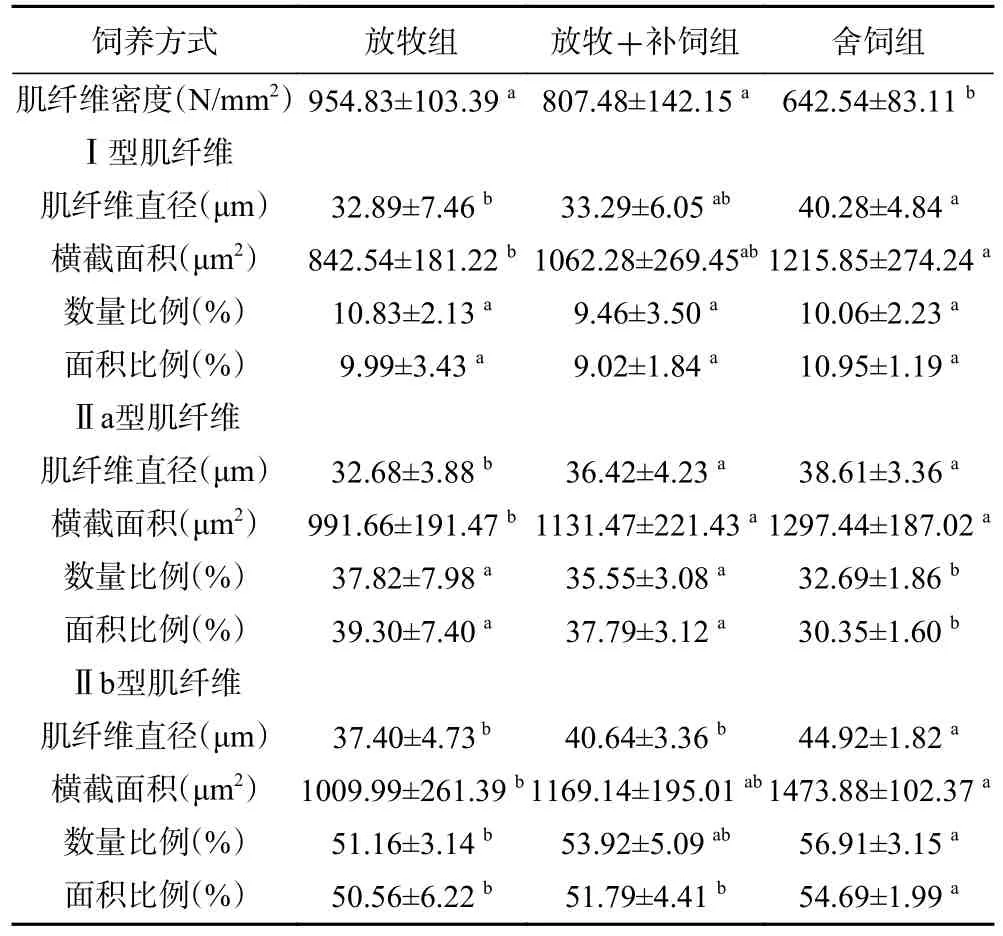
表5 三种饲养方式下肌纤维组织学特性的差异Table 5 Differences of muscle fiber characteristics under three typical feeding patterns
在三组苏尼特羊的背最长肌肌纤维组成中,均是Ⅱ型肌纤维所占比例较大(80%以上),Ⅰ型肌纤维是占比最小的,放牧、放牧+补饲和舍饲三种饲养方式之间肌纤维组织学特性指标差异相对较大。放牧组氧化型(Ⅰ型+Ⅱa 型)肌纤维的数量比例、面积比例分别是48.65%、49.29%,放牧+补饲组分别为45.01%、46.81%,舍饲组分别为42.75%、41.30%。在三种典型饲养方式下,放牧羊肌纤维密度最大,并且各型的肌纤维直径和横截面积都小于舍饲和放牧后补充精料方式下的。以上结果说明,与舍饲方式下的苏尼特羊相比,放牧和放牧+补饲方式能够上调肌肉中氧化型肌纤维的比例,直径和横截面积有效减小。侯艳茹也用ATPase 染色法对肌纤维进行了分型,得出圈养条件下苏尼特羊背最长肌的氧化型(Ⅰ型+Ⅱa 型)肌纤维比例不及放牧方式下的高[25]。
2.4 三种饲养方式下苏尼特羊MyHC mRNA 相对表达量的差异比较
由图2 可知,舍饲羊背最长肌的MyHCⅠmRNA相对表达量显著低于放牧羊和放牧+补饲羊(P<0.05),MyHCⅡbmRNA 相对表达量显著高于放牧羊和放牧+补饲羊(P<0.05);放牧羊MyHCⅡa、MyHCⅡxmRNA 相对表达量显著高于放牧+补饲羊和舍饲羊(P<0.05)。
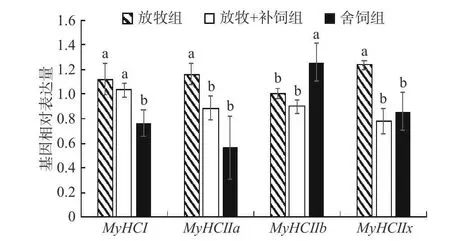
图2 三种饲养方式下MyHC mRNA 相对表达量的差异Fig.2 Differences of MyHC mRNA relative expression under three typical feeding patterns注:不同小写字母表示同一指标不用饲养方式下差异显著P<0.05,图3 同。
依据MyHCs 差异表达的分子分型法比组织化学染色法能更为准确的对肌纤维类型进行划分,可分为MyHCⅠ、Ⅱa、Ⅱb和Ⅱx型4 类亚基,据此将肌纤维分为Ⅰ型(慢速氧化型)、Ⅱa 型(快速氧化型)、Ⅱx 型(中间型)和Ⅱb 型(快速酵解型)[3]。本实验对ATPase 组化染色的结果进行分析,得出舍饲组酵解型肌纤维比例最高,氧化型肌纤维的比例最低,而放牧组与此相反。MyHCmRNA 表达量测定的结果与ATPase 染色法结果基本是一致的。肌肉的剪切力值与肌纤维直径和横截面积呈显著正相关[26−27],王莉关于牦牛嫩度与肌纤维类型分布之间的关系上的研究得出,肌肉中氧化型肌纤维分布越广,肌肉中的嫩度也就越好[28]。本实验结果显示,三种饲养方式中各型肌纤维直径和横截面积的趋势为舍饲组>放牧+补饲组>放牧组,且舍饲羊酵解型肌纤维比例相较放牧和放牧补饲方式下的苏尼特羊较高,氧化型纤维比例低,所以全舍饲羊肉的嫩度不及放牧和放牧+补饲羊。pH0的差异性表现为放牧组高于舍饲组,放牧+补饲组与舍饲组无差异,在排酸24 h 后,放牧组和放牧+补饲组pH24h小于舍饲组,这可能是由于舍饲羊肌肉中的酵解型肌纤维比例较高,酵解型肌纤维中因为糖原含量丰富,糖酵解潜力高,所以在宰后加速了糖酵解速率,使得pH 下降和回升速率快,最终加快了肉的成熟速度。侯普馨[26]在对苏尼特羊的肉品质研究中指出,pH24h与Ⅰ型肌纤维的比例存在显著负相关关系,与本实验结论相一致。肌纤维的分析结果与不同饲养方式下肉品质分析结果大体吻合,因此,舍饲、放牧+补饲和放牧三种饲养方式下羊肉品质存在差异的内在原因极可能是肌肉中肌纤维特性不同而造成的。
2.5 三种饲养方式下苏尼特羊MDH、LDH、SDH 活力的差异比较
据图3 可知,放牧组和放牧+补饲组背最长肌MDH 活力显著高于舍饲组(P<0.05),放牧组LDH活力极显著低于舍饲组和放牧+补饲组(P<0.01),放牧组SDH 活力极显著高于舍饲组和放牧+补饲组(P<0.01)。

图3 三种饲养方式下苏尼特羊代谢酶活力的差异Fig.3 Differences of metabolic enzyme activity under three typical feeding patterns
肌纤维类型组成与肌肉相关代谢酶密切相关,因此本试验检测了LDH、MDH 和SDH 活力。氧化型肌纤维为骨骼肌提供能量的主要途径是有氧氧化,因此SDH、MDH 等有氧代谢酶系活力很高,肌肉氧化代谢能力与酶活力成正相关关系[29]。酵解型肌纤维主要的能量供应途径是无氧酵解,LDH 等酵解酶系活力高低可以反映机体细胞无氧酵解过程的活跃情况[30]。本实验结果进一步说明舍饲的方式提高了肌肉的酵解代谢酶活力,降低了氧化代谢酶活力,而放牧和放牧+补饲的方式下都能不同程度的提高肌肉的氧化代谢酶活力,降低酵解代谢酶活力,这个结果与舍饲方式下酵解型肌纤维比例高、氧化型肌纤维比例低这一结果是一致的。
3 结论
与纯自然放牧方式相比,舍饲和放牧后补充精料方式下的苏尼特羊净肉质量、胴体质量、净肉率、屠宰率等多项屠宰性能和胴体品质指标有不同水平的提高,这说明舍饲方式和放牧后补充精料对改善苏尼特羊的生长性能有积极作用。同时舍饲组酵解型肌纤维比例最高,放牧组、放牧+补饲组氧化型肌纤维比例较高。此外,放牧方式增强了氧化代谢酶SDH 活力,降低了酵解代谢酶LDH 活力。即放牧和放牧补充精料的饲养方式均能够增强机体氧化代谢能力,上调氧化型肌纤维比例,提高肉的嫩度,延长肉的成熟时间。
综上,本研究的结果表明纯自然放牧方式下的苏尼特羊屠宰性能和胴体品质方面不及舍饲和放牧+补饲方式,本研究的实验结论为今后在调整饲养方式方面,如通过控制舍饲羊的运动量和饲粮角度提升羊肉品质建立了理论依据。
此外,本研究对于三种饲养方式间肉品质和肌纤维的差异只进行了初步实验,影响肌纤维特性变化的通路十分复杂,受到多种因素的共同作用,需要进一步结合细胞、分子实验找出调控肌纤维特性的关键因子。
