人参皂苷CK 对力竭游泳大鼠抗疲劳作用及骨骼肌氧化应激的影响*
2022-05-28蓝瑞高梁益军
蓝瑞高,梁益军
(桂林电子科技大学 体育部,广西 桂林 541004)
运动疲劳是一种复杂的生理现象,常表现为心跳速率加快、呼吸急促、注意力不集中、反应迟钝、肌肉僵硬或伴随疼痛等[1]。运动疲劳是竞技体育活动中的常见现象,其严重影响机体运动能力,同时也会对机体健康造成危害[2]。骨骼肌氧化应激水平的增加与运动疲劳的发生密切相关,因此,寻找有效的方法降低骨骼肌氧化应激水平进而减轻运动疲劳是目前研究的重点[3-4]。
人参为多年生五加科草本植物,作为百草之王,其药理作用广泛,具有抗疲劳、改善记忆、提高免疫及抗氧化等多种功效[5]。人参皂苷是人参的主要活性物质,其中人参皂苷Rg3、Re 及Rb1 等均表现出较好的抗疲劳作用[6-8],而关于人参皂苷CK 的抗疲劳作用鲜有报道。研究发现:人参皂苷CK 具有较好的抗氧化活性及优良的药物代谢动力学特征[9],引起了越来越多的关注。因此,本研究主要探讨人参皂苷CK 是否具有减轻力竭游泳大鼠疲劳的作用,并在此基础上深入阐明该作用与骨骼肌氧化应激的相关性,以期为缓解运动疲劳提供新思路。
1 材料与方法
1.1 动物分组、药物干预及力竭游泳训练
SPF 级雄性SD 大鼠50 只,体质量180~220 g,购于西安交通大学实验动物中心,生产许可证号:SCXK(陕)2020-001。
适应环境3 d 后,将大鼠按体质量随机分为安静对照组、运动模型组及人参皂苷CK 低、中、高剂量组,每组10 只。人参皂苷CK 低、中、高剂量组分别灌胃10、20 和40 mg/kg 的人参皂苷CK[10],人参皂苷CK(纯度>95%,批号nkl-00153)由成都钠钶锂生物科技公司提供;安静对照组及运动模型组灌胃等体积蒸馏水,每天1 次,连续4 周。
安静对照组大鼠不参加运动,常规饮食和饮水;其余各组大鼠于给药当天进行游泳训练,每周训练6 d,休息1 d,第1 周每次训练时长30 min,以后每周每次训练时长增加10 min,连续训练4 周[11]。在末次给药24 h 后,称量大鼠体质量,随后将铅丝(大鼠体质量的8%)系于大鼠尾部,在水温30 ℃、水深30 cm 的自制水槽中进行力竭游泳试验。沉水后10 s 未上浮至水面为力竭判定标准,记录大鼠力竭游泳时间。
1.2 血清抗疲劳指标的测定
力竭游泳试验完成1 h 后,用乙醚麻醉大鼠,腹主动脉取血,5 000 r/min 离心10 min 制备血清,置于冰箱中储存备用。采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)按照试剂盒说明书检测血清睾酮(testosterone,TTS)、皮质酮(corticosterone,CTC)及尿素氮(urea nitrogen,BUN)水平;采用比色法按照试剂盒说明书检测血清乳酸(lactic acid,LA)水平。
1.3 肌糖原和肝糖原储备水平的测定
腹主动脉取血后,分离各组大鼠后腿骨骼肌及肝脏,根据试剂盒说明书要求分别制备5%肌糖原测定液和1%肝糖原测定液,通过比色法在620 nm 波长下测吸光度,依据标准曲线测定肌糖原和肝糖原储备水平。
1.4 骨骼肌病理检测
取部分分离的骨骼肌组织,石蜡包埋后制作4 μm 切片,经常规苏木精—伊红染色后[12],光学显微镜观察人参皂苷CK 对各组大鼠骨骼肌病理变化的影响。
1.5 骨骼肌氧化应激指标的测定
取部分分离的骨骼肌组织,用预冷的生理盐水洗涤,剪碎后12 000 r/min 离心15 min,收集组织上清液。采用钼酸铵法测定过氧化氢酶(catalase,CAT)活性;采用二硫代二硝基苯甲酸法测定谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性;采用嘌呤氧化酶法测定超氧化物歧化酶(superoxide dismutase,SOD)活性;采用硫代巴比妥酸法测定丙二醛(malondialdehyde,MDA)水平。测定步骤均按试剂盒说明书标准流程进行。
1.6 骨骼肌Nrf2 和HO-1 蛋白表达的测定
通过Western-blot 法测定骨骼肌核因子E2 相关因子2(nuclear factor-erythroid 2 related factor 2,Nrf2)和血红素氧合酶-1(heme oxygenase-1,HO-1)的蛋白表达[13]。取部分分离的骨骼肌组织,用预冷的生理盐水洗涤并剪碎,按1∶10(g∶mL)加入含有1%蛋白酶抑制剂的RIPA 裂解液,静置30 min 后12 000 r/min 离心15 min,保留上清液。每个泳道上样20 μg 蛋白,进行12% SDS-PAGE电泳。电泳完成后,取出凝胶,转移至硝酸纤维素膜上,并将硝酸纤维素膜放入5%牛血清白蛋白中,在37 ℃条件下封闭1.5 h。漂洗后,分别加入兔抗大鼠Nrf2(1∶1 500)、HO-1(1∶1 500)及β-肌动蛋白(β-actin,1∶2000)多克隆抗体,4 ℃条件下孵育过夜。漂洗后,再加入二抗(1∶5 000),室温下孵育1 h;再次漂洗后,加入ECL发光试剂反应液进行显色,以β-actin 为内参,用Image Lab 软件分析各条带灰度值,计算目的蛋白的相对表达量。
1.7 数据统计与分析
数据均用“平均值±标准差”表示,通过SPSS 18.0 软件进行统计学处理;采用单因素方差分析及LSD 检验进行组间的数据比较,P<0.05 为显著性水平。
2 结果与分析
2.1 人参皂苷CK 对大鼠力竭游泳时间的影响
由表1 可知:运动模型组大鼠的力竭游泳时间少于人参皂苷CK 低、中、高剂量组(P<0.05,P<0.01),且人参皂苷CK 对提高大鼠的力竭游泳时间具有剂量依赖性,提示人参皂苷CK 可以减轻力竭游泳大鼠的疲劳。

表1 人参皂苷CK 对大鼠力竭游泳时间的影响Tab.1 Effects of ginsenoside CK on the exhaustive swimming time of rats
2.2 人参皂苷CK 对大鼠血清抗疲劳指标的影响
由表2 可知:与安静对照组相比,运动模型组大鼠血清TTS 水平降低(P<0.01),而CTC、LA及BUN 水平增加(P<0.01),表明力竭游泳大鼠疲劳程度较重;与运动模型组相比,人参皂苷CK 低、中、高剂量组大鼠血清TTS 水平增加(P<0.01),而CTC、LA 及BUN 水平降低(P<0.05 或P<0.01)。以上结果进一步证实人参皂苷CK 可以减轻力竭游泳大鼠的疲劳。

表2 人参皂苷CK 对大鼠血清抗疲劳指标的影响Tab.2 Effects of ginsenoside CK on the serum anti-fatigue indexes of rats
2.3 人参皂苷CK 对大鼠肌糖原和肝糖原储备水平的影响
由表3 可知:与安静对照组相比,运动模型组大鼠肌糖原和肝糖原储备水平降低(P<0.01);与运动模型组比较,人参皂苷CK 低、中、高剂量组大鼠肌糖原和肝糖原储备水平增加(P<0.01)。

表3 人参皂苷CK 对大鼠肌糖原和肝糖原储备水平的影响Tab.3 Effects of ginsenoside CK on the muscle glycogen and liver glycogen reserve levels in rats
2.4 人参皂苷CK 对大鼠骨骼肌病理改变的影响
由图1 可知:安静对照组大鼠肌膜清晰,肌纤维排列整齐,细胞排列紧密;运动模型组大鼠肌间质水肿,骨骼肌纤维变形,炎性细胞浸润明显;人参皂苷CK 低、中、高剂量组大鼠炎性细胞浸润减少,骨骼肌纤维排列较为规则。

图1 人参皂苷CK 对大鼠骨骼肌病理改变的影响(200×)Fig.1 Effects of ginsenoside CK on the skeletal muscle pathological changes of rats
2.5 人参皂苷CK 对大鼠骨骼肌氧化应激指标的影响
由表4 可知:与安静对照组相比,运动模型组大鼠骨骼肌CAT、GSH-Px 及SOD 活性降低(P<0.01),而MDA 水平增加(P<0.01),表明力竭游泳大鼠骨骼肌存在氧化损伤;与运动模型组比较,人参皂苷CK 低、中、高剂量组大鼠骨骼肌CAT、GSH-Px 及SOD 活性增加(P<0.05 或P<0.01),而MDA 水平降低(P<0.01),表明人参皂苷CK 可以增强力竭游泳大鼠骨骼肌的抗氧化应激能力。
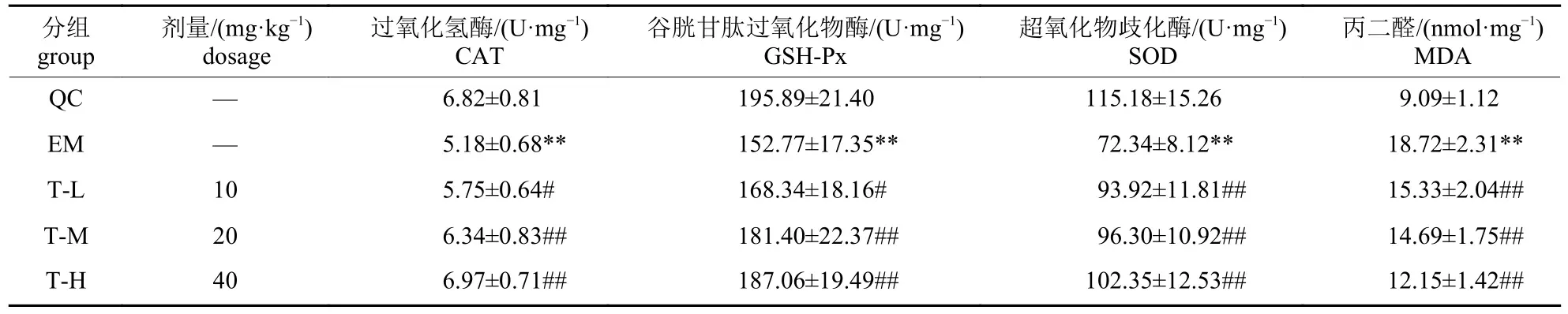
表4 人参皂苷CK 对大鼠骨骼肌氧化应激指标的影响Tab.4 Effects of ginsenoside CK on the oxidative stress index in skeletal muscle of rats
2.6 人参皂苷CK 对大鼠骨骼肌Nrf2 和HO-1 蛋白表达的影响
由图2 和表5 可知:与安静对照组相比,运动模型组大鼠骨骼肌Nrf2 和HO-1 蛋白表达降低(P<0.01);与运动模型组比较,人参皂苷CK低、中、高剂量组大鼠骨骼肌Nrf2 和HO-1 蛋白表达增加(P<0.05 或P<0.01),表明人参皂苷CK具有激活力竭游泳大鼠骨骼肌Nrf2/HO-1 信号通路的作用。

图2 大鼠骨骼肌Nrf2 和HO-1 蛋白表达的电泳图Fig.2 Electrophoretogram of Nrf2 and HO-1 protein expressions in skeletal muscle of rats

表5 人参皂苷CK 对大鼠骨骼肌Nrf2 和HO-1 蛋白表达的影响Tab.5 Effects of ginsenoside CK on the Nrf2 and HO-1 protein expressions in skeletal muscle of rats
3 讨论
疲劳是一种复杂的综合症状,当机体在脑力或体力劳动达到较高水平时就会出现疲劳,因而疲劳也被认为是一种自发的生理保护现象。运动性疲劳与人们的生活息息相关,长期的疲劳状态可以引起体内能量代谢方式的转变,增加有害代谢产物,导致早衰发生,同时疲劳也是脑血管疾病的高风险因素[14]。为了考察人参皂苷CK 在抗疲劳中的应用价值,本研究利用SD 大鼠进行游泳力竭运动,发现人参皂苷CK 组大鼠的力竭游泳时间显著高于运动模型组。相关研究表明:机体长期处于疲劳状态,会导致机体TTS、CTC、LA 及BUN 等血清抗疲劳指标异常[15]。本研究结果发现:与运动模型组相比,人参皂苷CK 组大鼠血清TTS 水平增加,而CTC、LA 及BUN 水平降低。持续高强度运动引起的机体能源物质消耗增加是运动性疲劳产生的原因,而肌糖原和肝糖原分解的葡萄糖是机体主要的供能方式,节省糖原的利用并增加糖原的储备量,可以有效缓解运动性疲劳[16]。本研究发现:与运动模型组相比,人参皂苷CK 组大鼠肌糖原和肝糖原储备水平增加;此外,HE 染色结果也证实人参皂苷CK可以减轻骨骼肌病理改变。上述结果表明:人参皂苷CK 具有减轻力竭游泳大鼠疲劳的作用。
机体氧化与抗氧化系统的平衡状态被打破是疲劳发生的重要因素,机体长期处于氧化应激状态可使自由基和活性氧等有害代谢产物的生成增加,进而损伤器官和组织,并影响细胞内的能量合成[17]。GSH-Px 与生物体的抗氧化能力密切相关,是过氧化氢与谷胱甘肽反应的催化剂;CAT和SOD 是机体内重要的抗氧化酶,SOD 使自由基转化为过氧化氢,过氧化氢再经CAT 催化生成水[18]。MDA 是脂质过氧化物代谢的终产物,其水平的高低可以反映细胞或组织氧化损伤的程度[19]。在Aβ 致阿尔茨海默病小鼠模型中,人参皂苷CK 能显著降低海马MDA 水平,升高SOD、CAT 和GSH 水平,表现出良好的抗氧化活性[20]。本研究结果也发现:人参皂苷CK 可以增加力竭游泳大鼠骨骼肌CAT、GSH-Px 及SOD 活性,降低MDA 水平,提示人参皂苷CK 减轻力竭游泳大鼠疲劳的作用与增强抗氧化应激能力有关。Nrf2/HO-1 信号通路在机体过度运动所致氧化应激及抗氧化进程中发挥关键作用[21]。在慢性疲劳小鼠模型中,五味子素A 可以通过上调Nrf2 和HO-1 蛋白表达发挥抗氧化作用,从而改善慢性疲劳小鼠学习记忆能力[22]。研究发现:人参皂苷CK可以通过促进Nrf2 信号通路的转导及调节Aβ聚集进而改善东莨菪碱损伤小鼠的记忆功能,从而减少神经元氧化损伤[23]。本研究结果也发现:人参皂苷CK 能够增加骨骼肌Nrf2 和HO-1 蛋白表达,提示激活Nrf2/HO-1 信号通路、增强骨骼肌抗氧化应激能力是其减轻力竭游泳大鼠疲劳的潜在机制,但具体的作用机制还有待于深入研究。
4 结论
人参皂苷CK 具有减轻力竭游泳大鼠疲劳的作用,且该作用与激活Nrf2/HO-1 信号通路、进而增强骨骼肌的抗氧化应激能力有关。
