3 种抗病诱导剂对宁夏枸杞生长、抗病性及相关酶活性的影响*
2022-05-28冯丽丹李永晖张生懂
张 煦,李 捷 ,冯丽丹,何 静,李永晖,孙 涛,张生懂
(1.甘肃农业大学 林学院,甘肃 兰州 730070;2.甘肃农业大学 食品科学与工程学院,甘肃 兰州 730070)
宁夏枸杞(Lycium bararum)作为西北地区特色农产品之一,在宁夏、青海及甘肃地方经济中有重要地位,但是枸杞在栽培过程中病害问题非常严重,种植户在种植过程中存在使用不安全农药、超量使用农药和违反农药安全间隔期等问题,从而导致部分枸杞产品农药残留高于国家规定标准及欧盟标准[1-2],严重制约枸杞产品生产,不利于西北地区经济的长远发展。
植物诱导抗性又称植物免疫,是指植物经外界激发子刺激后,对病原菌侵染表现出明显的防卫反应。大量研究表明:植物抗病诱导剂(以下简称“诱抗剂”)的使用能显著提高果蔬病害的防治效果,是一种很有前景的植物病害防治方法[3-5]。植株通过诱抗剂的刺激增强天然免疫力,提高其对病害的对抗作用,从而诱导植物自身产生抗病性[6-7]。乙酰水杨酸(acetylsalicylic acid,ASA)是水杨酸(salicylic acid,SA)的结构类似物,现已证实SA 能有效诱导多种植物产生系统获得性抗性,ASA 也表现出类似的生物活性[8];茉莉酸甲酯(methyl jasmonate,MeJA)作为一种与植物体损伤相关的信号分子,广泛地存在于植物体中,外源应用MeJA 能够激发植物防御基因的表达[9],诱导植物的化学防御[10];β-氨基丁酸(βaminobutyric acid,BABA)可通过特异性的BABA信号传导通路启动植物交联应答机制,诱导植物的超敏反应,从而激发宿主对病原真菌的广谱抗性[11],在植物诱导抗病性领域具有应用潜力。
植物诱导抗性具有预防性、系统性、稳定性、相对性和安全性等优点,利用植物免疫系统防治病害,可从源头上减少农药对环境和农产品的污染,更符合当今农业可持续发展的要求。目前,枸杞诱导抗病性相关研究鲜有报道,叶面喷施诱抗剂提高枸杞抗病能力可为防治枸杞病害提供新思路。因此,本研究选取西北地区种植面积最广的宁杞7 号为试验材料,检测分析不同诱抗剂对其生长、活性氧代谢途径相关指标、细胞膜氧化程度和苯丙烷代谢途径等指标的差异,为枸杞栽培管理及抗病机制研究提供理论依据。
1 材料与方法
1.1 试验地概况和试验材料
试验地点位于甘肃省古浪县大靖镇大墩村(N37°09′01″,E103°08′35″),海拔1 930 m,属温带大陆性气候。试验材料为6 年生、树势一致的宁杞7 号植株,正常修剪及水肥管理。
1.2 药剂及配置方法
参考胡彦江等[12]的研究,将ASA(Cas 50-78-2,分析纯)浓度设置为3 mmol/L;参考向妙莲等[13]的研究,将MeJA(Cas 33924-52-2,分析纯)浓度设置为0.3 mmol/L;参考王静等[14]的研究,将BABA(Cas 541-48-0,分析纯)质量浓度设置为1 mg/mL。以清水为溶剂配置对应药剂,同时加入0.5%的吐温-80 作为表面活性剂。对照组为0.5%的吐温-80 水溶液。
1.3 试验设计与取样方法
试验于2020 年实施。采用完全随机区组设计,设置试验株共120 株,每个处理10 株,3 次重复,随机分布在试验地块中。每处理间设置1~2 株隔离株,地块周边设隔离行。采用1.2 节的3 种药剂和对照水溶液于晴天无风时对试验地内选定的宁杞7 号植株进行喷施处理,保证整株喷施且喷洒均匀。于5 月底枸杞初花期开始喷施,间隔7 d 喷施1 次,共喷施5 次,喷施药剂量以均匀喷施整株叶片表面而不滴落为宜。具体喷施日期为5 月23 日、5 月30 日、6 月6 日、6 月14 日和6 月21 日。诱导处理前1个月内和处理过程中不喷施任何防病和防虫害药剂。
以1 次喷施后7 d 为1 个诱导周期,在第3次喷施后开始取样,共取3 次,具体时间为6 月13 日、6 月20 日和6 月27 日,分别对应诱导3、4、5 次。测定样品采用植株中上部完全展开发育充实的叶片,其中细胞膜相对透性、叶面积、叶片厚度和叶绿素含量测定样品于采摘后立即测定,其余生理生化指标按照每份0.5 g、每处理准备25 份混合样品,称量和编号后立即液氮速冻,带回实验室测定。
1.4 测定指标及测定方法
1.4.1 自然发病率的测定
于最后1 次取样时进行自然发病率调查,以枸杞叶斑病为病害调查对象,以叶片为单位,根据枸杞叶斑病发病程度进行分级调查。在每株树同一水平面的东、西、南、北面以及中心各取1 个点,以此点为中心调查周围的10 枚叶片,每株树共调查50 枚叶片,逐片记录病叶数和发病严重程度。病级划分标准为:0 级:无病斑;1 级:病斑占叶片面积的1%~10%;2 级:病斑占叶片面积的11%~25%;3 级:病斑占叶片面积的26%~50%;4 级:病斑占叶片面积的51%以上。计算枸杞叶斑病病叶率、病情指数及相对防治效果:
发病率=(发病叶片总数/调查叶片总数)×100%;
病情指数=∑(各级病叶数×相对级数值)/(调查总叶数×最高级数值);
相对防治效果=(对照病情指数-处理病情指数)/对照病情指数×100%。
1.4.2 叶片相关指标的测定
叶绿素含量的测定采用舒展等[15]的提取和测定方法。叶面积的测定采用照相后使用软件Adobe Photoshop 2020 进行分析统计的方法,每个处理随机选取1 株,采取枝条中部或中上部完全展开的成熟叶片,低温保湿带回拍照,所得图片使用Adobe Photoshop 2020 处理计算得到叶面积。叶片厚度采用厚度测量仪测定,每处理随机选取3 株进行测定,每株在东、西、南、北4 个方位随机抽取1 个枝条,测定并记录每枝条中部或中上部完全展开的成熟叶片5 片,每个叶片测定叶片中部两侧不包含主脉的边缘厚度。
1.4.3 生理生化指标的测定
H2O2和含量的测定参照REN 等[16]的方法;POD 和SOD 活性的测定参照YUAN 等[17]的方法;PAL 活性的测定参照ASSIS 等[18]的方法;总酚和类黄酮含量的测定参照PIRIE 等[19]的方法;细胞膜相对透性与丙二醛(MDA)含量分别采用电导法和硫代巴比妥酸法测定[20]。
1.5 数据处理方法
用GraphPad Prism 8.0.2 软件计算标准偏差并绘制图表,采用IBM SPSS Statistics 26 软件对数据进行单因素方差分析,采用Duncan’s 多重比较进行差异显著性分析。
2 结果与分析
2.1 诱抗剂对枸杞自然发病率的作用
由表1 可知:叶面喷施3 种诱抗剂处理的枸杞叶斑病发病率和病情指数以MeJA 处理最低,分别为3.06%和27.11,都显著低于其他处理(P<0.05),其次是ASA 处理,BABA 处理的病情指数与对照无显著差异;MeJA 处理相对于对照的防治效果为53.43%。这说明MeJA 相比其他处理更有利于降低枸杞叶斑病病叶率和病情指数。

表1 叶面喷施3 种诱抗剂对枸杞叶斑病的影响Tab.1 Effects of spraying three kinds of inducers on the leaf spot disease of Lycium barbarum
2.2 诱抗剂对枸杞叶片生长的影响
由图1 可知:3 种诱抗剂均能提高枸杞叶面积,在3 次诱导后,处理过的枸杞叶面积与对照无显著差异(P>0.05);4 次诱导后,MeJA 处理显著高于对照和其他处理(P<0.05),比对照高16.62%;而5 次诱导全部结束后7 d,ASA、MeJA 和BABA 处理的叶面积分别提高56.20%、59.26%和36.11%。

图1 叶面喷施3 种诱抗剂对枸杞叶面积的影响Fig.1 Effects of spraying three kinds of inducers on the leaf area of Lycium barbarum
由图2 可知:3 种诱抗剂会降低枸杞叶厚度,其中MeJA 处理于3 次诱导后即显著低于对照(P<0.05),较对照降低5.25%;在诱导4 次后7 d,ASA、MeJA 和BABA 等3 种诱抗剂处理均显著低于对照(P<0.05),分别降低9.14%、8.49%和9.94%;在5 次诱导结束后,ASA 和BABA 处理的抑制效果减弱,分别比对照低8.19%和6.56%,而MeJA 处理的叶片厚度进一步降低达11.32%。

图2 叶面喷施3 种诱抗剂对枸杞叶片厚度的影响Fig.2 Effects of spraying three kinds of inducers on the leaf thickness of L.barbarum
由图3 可知:3 次诱导后,3 种诱抗剂处理的枸杞叶片叶绿素含量均显著高于对照(P<0.05),但各处理之间无显著差异(P>0.05),ASA、MeJA 和BABA 处理过的叶片叶绿素含量分别高于对照14.67%、13.33%和16.88%;诱导4 次后,ASA 和BABA 处理的叶片叶绿素含量显著上升,分别高于对照32.05%和30.76%;5 次诱导结束后7 d,ASA 和MeJA 处理叶片的叶绿素含量低于BABA 处理而高于对照,此时BABA较对照高49.56%。

图3 叶面喷施3 种诱抗剂对枸杞叶片叶绿素含量的影响Fig.3 Effects of spraying three kinds of inducers on the chlorophyll content of L.barbarum
2.3 诱抗剂对枸杞叶片活性氧代谢的影响
由图4 可知:3 次诱导后,ASA、MeJA 和BABA 处理的SOD 活性均显著高于对照(P<0.05),其中MeJA 处理高于对照76.34%,ASA 和BABA分别比对照高65.85%和65.55%;ASA、MeJA和BABA 处理及对照的酶活在4 次诱导后均呈下降趋势,并在诱导5 次后开始上升,BABA 处理的SOD 活性在5 次诱导后处于最高水平,高于对照72.56%。
由图4 还可知:3 次诱导后,ASA 和BABA处理的H2O2含量分别显著低于对照6.61%和16.45%(P<0.05),而MeJA 处理比对照高3.24%;4 次诱导后,3 种诱抗剂处理的H2O2含量均显著高于对照(P<0.05),其中MeJA 处理的H2O2含量为304.97 μg/g,比对照高25.38%,ASA 和BABA处理分别高于对照8.55%和9.54%;诱导5 次后,BABA 处理的H2O2含量急剧升高,显著高于其他处理与对照(P<0.05),与对照相比高31.01%。

图4 叶面喷施3 种诱抗剂对枸杞叶片活性氧代谢的影响Fig.4 Effects of spraying three kinds of inducers on the active oxygen metabolism of L.barbarum
由图4 可知:ASA、MeJA 和BABA 诱导处理均可提高枸杞叶片中的POD 活性,但峰值出现时间有所不同。ASA 和MeJA 处理的POD 峰值在3 次诱导后,分别较对照高54.72%和20.38%;BABA 处理的峰值出现在5 次诱导后,比对照高72.34%,其峰值的出现虽晚于其他处理,但高于其他处理。
2.4 诱抗剂对枸杞细胞膜氧化程度的影响
由图5 可知:3 次诱导后,3 种诱抗剂均降低了枸杞叶片细胞膜透性,其中ASA 处理叶片的细胞膜相对透性虽低于对照,但仍高于其他处理,且在此之后与对照无显著差异(P>0.05);3 次诱导后,MeJA处理的细胞膜相对透性低于对照和ASA 处理,但高于BABA 处理,在总趋势上升的情况下,上升幅度较低,总体基本稳定;BABA 处理的细胞膜相对透性在第3 次施药后有上升趋势,但一直处于最低水平,最低水平比对照低48.21%。由图5 还可知:3 种诱抗剂处理的MDA 含量均显著低于对照(P<0.05)。在3、4 次诱导后各诱抗剂之间无显著差异;5 次诱导后,MeJA 和BABA 处理显著低于ASA 处理(P<0.05)。

图5 叶面喷施3 种诱抗剂对枸杞叶片细胞膜氧化程度的影响Fig.5 Effects of spraying three kinds of inducers on the cell membrane oxidation of L.barbarum
2.5 诱抗剂对枸杞叶片苯丙烷代谢的影响
由图6 可知:叶面喷施3 种诱抗剂均可显著提高枸杞叶片的PAL 活性(P<0.05)。诱导3、4次后,MeJA 处理的PAL 活性最高,而诱导5 次后BABA 处理达到最佳,其中MeJA 诱导3 次后的PAL 活性达到峰值。ASA 处理对PAL 活性的提高能力低于其他2 个处理,其峰值出现亦在3次诱导后。3 次诱导后,ASA 和MeJA 处理分别比对照高10.84%和38.28%。BABA 处理的PAL活性在3 次诱导时便有所提高,5 次诱导后达到峰值,此时较对照高41.76%。
3 种诱抗剂对总酚与类黄酮含量的影响基本一致(图6)。MeJA 处理的总酚和类黄酮含量在3、4 次诱导后均处于最高值,且显著高于对照(P<0.05);在5 次诱导后,BABA 处理的总酚与类黄酮含量高于其他处理和对照,分别比对照高48.32%和53.39%。MeJA 处理的总酚含量在诱导3 次后达到峰值,比对照高29.14%,4 次诱导后有所下降,但仍比对照高21.25%,5 次诱导后与对照无显著差异(P>0.05)。
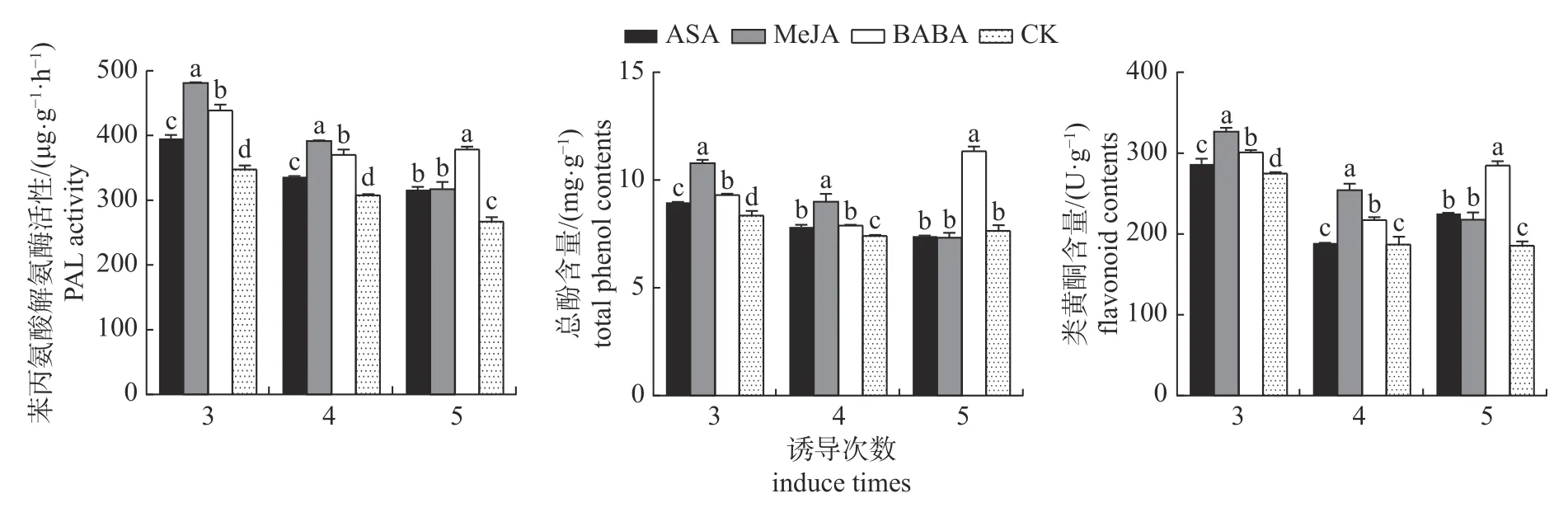
图6 叶面喷施3 种诱抗剂对枸杞叶片苯丙烷代谢的影响Fig.6 Effects of spraying three kinds of inducers on the phenylpropane metabolism of L.barbarum
3 讨论
大量研究表明:外源施用诱抗剂可增加植株抗病能力,降低其自然发病率和病情指数[13-14]。在本研究中,喷施MeJA 能显著降低枸杞叶斑病的发病率和病情指数,说明其能有效诱导枸杞产生抗病性。在生理生化指标的测定中发现:MeJA处理的活性氧代谢与苯丙烷途径相关指标均有一定变化,即MeJA 可能是通过激活活性氧代谢与苯丙烷途径从而使枸杞产生抗病性。BABA 处理的发病率高于对照而病情指数与对照无显著差异,是由于BABA 处理有更小的病斑面积,说明BABA 处理在叶斑病侵染前期尚未诱导枸杞叶片产生抗病性,甚至有负面效果使病原物更易侵染,在试验后期有效抑制了病斑扩张。
本研究发现:3 种诱抗剂均可提高枸杞叶面积、增加叶绿素含量,这是由于3 种诱抗剂具有多种生物功能,不仅能诱导植物提高对病原菌的抗性,也可以激发植物体内代谢调控过程,促进植物生长[21]。ASA 能通过调节植物活性氧(ROS)积累以促进细胞分裂,提高植物生物量[22];外源MeJA 能提高植物体内源茉莉酸含量,调节植物碳水化合物积累,从而调节植物生长[23];BABA可调节植物生理代谢,促进根系生长,进而促进植物地上部生长[24]。相关研究表明:叶面喷施100 mg/L ASA 可提高鹰嘴豆(Cicer arietinumL.)叶面积和叶绿素含量[25];施用3 mmol/L ASA 可显著提高菜豆(Phaseolus vulgarisL.)叶片光合色素及地上部生物量[26];叶面喷施2.5 μmol/L 外源MeJA 能提高Cd 胁迫下番茄(Solanum lycopersicumL.)幼苗的生物量[27]。本研究中,叶面喷施ASA、MeJA 和BABA 可提高枸杞叶面积和叶绿素含量,即能有效增加枸杞叶片光合能力。本研究还发现:诱抗剂的使用会减小叶片厚度,也有研究表明一些植物会采取增加叶片面积、降低叶片厚度的策略以提高光利用率[28]。光利用率的提升有利于产量的形成,但是这种生存策略会加剧叶片蒸腾作用,在种植地灌溉水源充沛的情况下有利于增产增收,但缺水条件下可能有负面影响。诱抗剂的使用能通过增强枸杞叶片细胞抗氧化能力改善其细胞稳定性。植物细胞抗氧化能力与细胞膜保护能力呈正相关[29]。病原物侵染植物时往往会使植物产生大量ROS,ROS 对病原物有抑制作用或杀伤力[30],且过量的ROS 会造成植物氧化损伤。植物体内的SOD 可催化转化为H2O2和O2,POD 可催化分解H2O2以维持植物体内ROS 平衡[31]。有研究显示:外源施加植物免疫诱抗剂可激活植物活性氧代谢途径以提高其抗病能力。喷施2.5 mmol/L MeJA 可提高紫花地丁(Viola philippica)叶片的CAT、POD 和SOD 活性,减少MDA 含量[32];叶面喷施2.5 μmol/L MeJA可提高番茄抗氧化酶活性,减轻氧化损伤[27];喷施500 mg/L BABA 可提高番茄幼苗CAT 和POD活性,增强抗番茄白粉病的能力[33]。本研究表明:3 种诱抗剂提高枸杞叶片中活性氧含量的同时可提高抗氧化酶活性,且降低MDA 含量和细胞膜透性。其中,MeJA 诱导3 次后可显著提高枸杞叶片SOD 活性,降低含量,提高H2O2含量,同时POD 活性显著提升,并且抑制细胞的氧化损伤,说明MeJA 诱导3 次后激活了枸杞活性氧代谢途径,可增强其自身抗病能力,与自然发病率和病情指数结果一致。
3 种诱抗剂提高了枸杞叶片PAL 活性,其总酚与类黄酮的积累均与之对应上升。PAL 是植物体内主要的抗性酶之一,其活性可代表植物的抗性高低,现已证明MeJA 可通过调节植物PAL 相关基因表达量来提高PAL 活性及苯丙烷代谢产物[34]。有研究显示:200 μmol/L MeJA 处理可极显著(P<0.01)上调苋菜(Amaranthus tricolorL.)PAL、F3H、CHI和CHS基因表达量,提高类黄酮含量[8];烟草(Nicotiana tabacumL.)幼苗喷施2 mmol/L SA 可显著提高其PAL 活性,有效抑制烟草花叶病毒(TMV)[35];5 g/L BABA浸泡巴西香蕉(Musa.AAA Group cv.Brazil)可提高PAL 活性和MaPAL1基因表达量,提高其抗病性[36]。MeJA 处理在3 次诱导后PAL 活性即达到峰值,说明MeJA可以较快地诱导枸杞产生抗性。植物体内总酚和类黄酮含量的积累与植物的耐逆性有关。PAL 催化L-苯丙氨酸形成肉桂酸是苯丙烷代谢的起点,总酚和类黄酮是苯丙烷代谢的下游分支产物[37],总酚和类黄酮含量与PAL 活性正相关。酚类和黄酮类化合物是一种强大的抗氧化剂,它们在清除自由基和对抗氧化损伤方面发挥着重要作用[25]。本研究中,3 种诱抗剂在一定程度上增加了枸杞总酚与类黄酮的积累,其中MeJA 处理的总酚与类黄酮含量在3、4 次诱导时均为最高,BABA处理在5 次诱导后处于最高。
枸杞对不同诱抗剂诱导次数的响应有差异。相关研究表明:诱导抗病效果与诱导次数呈正相关[38-39],而本研究中相关指标的测定发现:ASA与MeJA 处理的SOD、POD 和PAL 活性以及总酚和类黄酮含量在3 次诱导后达到峰值,持续诱导并无叠加效应。BABA 的诱导效果在5 次诱导中均呈现递增现象,在5 次诱导后达到最佳诱导效果。3 种诱抗剂在最佳诱导次数下均可提高SOD、POD 和PAL 活性,增加总酚和类黄酮含量。综上所述,MeJA 较BABA 可更快诱导枸杞产生抗病性,且效果优于ASA。因此,MeJA 在枸杞生产中的意义更为重要。
4 结论
叶面喷施乙酰水杨酸、茉莉酸甲酯和β-氨基丁酸可提高宁杞7 号叶绿素含量及叶面积,减小叶片厚度;3 种诱抗剂可激发枸杞叶片产生活性氧,同时可以提高抗氧化酶活性,并保护细胞膜完整性,提高苯丙氨酸解氨酶活性与总酚和类黄酮的积累,提高抗病性。叶面喷施0.3 mmol/L茉莉酸甲酯诱导3 次可显著降低宁杞7 号叶斑病的自然发病率和病情指数;乙酰水杨酸和茉莉酸甲酯诱导3 次后达到最佳诱导效果,且茉莉酸甲酯诱导效果优于乙酰水杨酸,β-氨基丁酸在诱导5 次后达到最佳诱导效果。
