尖形碘泡虫(黏体门: 碘泡虫科)的重描述及其分子系统学研究
2022-05-27石小威陈鸿真刘晓聪杨承忠赵元莙
石小威 王 茂 陈鸿真 高 磊 刘晓聪 杨承忠 赵元莙
(重庆师范大学生命科学学院, 重庆市动物生物学重点实验室, 重庆401331)
黏孢子虫(Myxosporeans)是一类个体微小、形态简单且分布广泛的后生动物寄生虫, 主要寄生于鱼类, 少数寄生于两栖类、爬行类、鸟类和哺乳类[1—3]。迄今已记录的黏孢子虫有2600余种[4]。碘泡虫科(Myxobolidae Thélohan, 1892)是黏孢子虫中最大的一科, 包含碘泡虫属(MyxobolusBütschli,1882)、单极虫属(ThelohanellusKudo, 1933)和尾孢虫属(HenneguyaThélohan, 1892)等, 其中碘泡虫属是该科中物种最丰富的属, 约有900种之多[5]。黏孢子虫早期的分类主要基于孢子形态, 然而后来大量的研究表明, 经典分类学很难对形态相似种进行有效区分, 特别是当其宿主特异性和组织趋向性极其相似的情况下, 鉴定工作尤为困难[6—9]。近30年来,分子生物学方法的介入, 为黏孢子虫分类学的发展起到了极大的促进作用, 解决了诸多经典分类学未能妥善处理的问题, 厘清了过去一些类群划分和物种鉴定的遗留问题[8,10,11]。然而在全世界所记录的黏孢子虫中, 仅有约23%的物种具有分子序列数据,因此仍有大量已知种的分子信息亟待补充和完善[4]。
鲫(Carassius auratusLinnaeus)具有生长速度快、繁殖能力强、肉质鲜美和营养价值高等特点,是我国重要的淡水养殖鱼类[12]。同时, 鲫也是黏孢子虫病发生率较高的经济鱼类之一, 据统计, 寄生于鲫的碘泡虫就达64种之多[13—15], 其中包含尖形碘泡虫Myxobolus acutusWu and Chen, 1987。尖形碘泡虫由吴灶和与陈启鎏在湖北五湖发现并命名, 其宿主为鲫, 寄生部位为肾和鳃[16]。因条件限制, 当时并未提供分子序列信息。本研究在嘉陵江重庆段检获尖形碘泡虫, 宿主为鲫, 寄生部位为鳃和胆囊, 这是续发现该物种30余年以来的第一次记录。本研究首次提供了尖形碘泡虫的18S rDNA及ITS1序列, 并基于形态和分子信息对其进行重描述的基础上, 开展了分子系统学研究, 以期为人们进一步了解该寄生虫的进化生物学特征及鱼类病原鉴定积累基础资料。
1 材料与方法
1.1 样本采集与物种鉴定
2015年4月、2018年4月和2019年5月在嘉陵江重庆段共采集鲫76尾。活体送往重庆市动物生物学重点实验室用过量的MS-222麻醉剂(350 mg/L)进行安乐死, 随后剖检, 用肉眼检查体表、鳃、肌肉、肝胰脏、肠、脾脏、心脏、胆囊、肾脏、膀胱等部位是否有明显病症及黏孢子虫孢囊, 镜检各组织器官涂片中分散孢子的存在。后对获取的黏孢子虫新鲜样本直接进行图像采集(图 1)及基因组DNA提取等工作, 对黏孢子虫样本的处理和种类鉴定参照文献[12]进行。
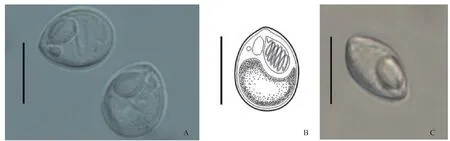
图1 尖形碘泡虫重庆株系孢子形态Fig. 1 Morphology of Myxoblus acutus of Chongqing strain
1.2 DNA提取与PCR反应
DNA提取将从宿主鲫的鳃部获得的黏孢子虫孢囊用镊子小心地剥离至1.5 mL离心管中, 用灭菌后的解剖针戳破后立即挑取部分孢子镜检, 显微拍照, 剩下的孢子分散于盛有灭菌双蒸水的离心管中, 离心富集, 悬浮洗2—3次以除去杂质。从宿主胆囊中检获的黏孢子虫立即镜检, 显微拍照, 剩余胆汁保存于1.5 mL离心管中, 从离心管中吸取10 μL含有孢子的胆汁, 用灭菌后的双蒸水清洗2—3次,除去杂质。按照DNeasy Tissue Kit(QIAGEN, Germany)试剂盒的使用说明书对黏孢子虫基因组DNA进行提取, 用1.5%琼脂糖凝胶电泳进行检测,将获得的基因组DNA溶液在-20℃条件下保存备用。另外, 按照海洋动物组织 DNA提取试剂盒(TIANGEN, China)的说明书对宿主鱼基因组DNA进行提取, 用1.5%琼脂糖凝胶电泳进行检测, 将获得的宿主鱼基因组DNA溶液在-20℃条件下保存备用。
PCR反应对提取成功的黏孢子虫样本基因组DNA进行18S rDNA序列片段扩增, 扩增引物为18E: 5′-CTGGTTGATCCTGCCAGT-3′和18R: 5′-CTACGGAAACCTTGTTACG-3′[17,18]。20 μL的PCR反应体系: 引物各0.5 μL, 模板DNA 5 μL, Mix(上海英潍捷基生物公司)5 μL, 然后添加超纯水补至20 μL; 反应程序为: 94℃预变性90s, 94℃变性20s, 56℃退火20s, 72℃延伸2min, 循环35次, 最后72℃再次延伸5min, 反应完成后于PCR仪12℃条件下保温。将PCR反应产物通过1.5%的琼脂糖凝胶电泳检测, 然后将有目的条带的PCR产物用胶回收试剂盒Gel Extraction Kit(OMEGA, America)纯化回收。将每个回收产物插入pMD18-T载体(TaKaRa,Japan), 随后导入大肠杆菌(Escherichia coli)中进行单克隆培养, 将2个克隆子送英潍捷基(上海)生物公司测序。黏孢子虫ITS1序列扩增引物为28S1R: 5′-GTGTTTCAAGACGGGTCG-3′和ERIB10-V: 5′-CCGTAGGTGAACCTGCGGAAG-3′, 采用上述相似的方法进行PCR扩增。宿主鱼的COI基因部分序列的PCR扩增参照文献[19]。
1.3 序列分析与系统发育
序列分析样本序列与相似度较高物种序列之间的遗传距离用MEGA6.0软件在K2P模型下计算获得。序列相似度借助在线软件Pairwise Sequence Alignment (网址: www.ebi.ac.uk/Tools/psa/)基于Global Alignment模式计算获得。序列间变异位点采用Bioedit软件分析。
系统发育分析用于构建系统发育树的黏孢子虫18S rDNA序列共有66条, 其中包括本研究得到的1条尖形碘泡虫代表序列和65条与尖形碘泡虫相似度较高的序列(通过NCBI在线BLAST结果),包括碘泡虫、单极虫、尾孢虫等。另外, 选用Tetracapsuloides bryosalmonae(KF731712)和Buddenbrockia plumatellae(AY074915)为外群。利用在线软件The CIPRES Science Gateway V.3.3 (网址: http://www.phylo.org/)中的RAxML-HPC2 XSEDE(8.2.12)模式构建最大似然树(Maximum likelihood,ML), 并选择1000次自举(Bootstrap)重复检测。利用MrBayes 3.1.2软件构建贝叶斯树(Bayesian inference, BI), 位点变异设置为invgamma分布, 序列最佳进化模型为GTR+I+G(通过Model test 3.7计算获得), 运行10000000代, 每200代抽样1次, 在舍弃25%的老化样本后, 根据剩余样本构建一致树。系统树的绘制由FigTree v1.4.2和Photoshop共同完成[20]。
1.4 主成分分析
基于成熟孢子的孢子长、孢子宽、大极囊长、大极囊宽、小极囊长和小极囊宽的测量值, 利用PAST3进行主成分分析(PCA), 以分析尖形碘泡虫7个株系间的形态差异。使用变量协变矩阵生成具有95.0%置信的散点图。
2 结果
基于形态及COI基因测序(GenBank登录号:MZ769123)鉴定宿主鱼为鲫。本实验共发现7尾鲫感染尖形碘泡虫(感染率为9.2%), 其中6尾感染部位为鳃, 均形成乳白色圆形孢囊(直径为1—2 mm),1尾感染部位为胆囊, 孢子游离于胆汁中, 未形成孢囊。本文将从上述感染宿主中获得的尖形碘泡虫分离株称为株系, 共得到7个分离株即S1—S7株系,整体称为重庆株系。
2.1 尖形碘泡虫Myxobolus acutus Wu and Chen,1987重庆株系形态学描述
尖形碘泡虫重庆株系成熟孢子壳面观呈梨形,前端稍尖, 后端钝圆, 缝面观呈宽纺锤形(图 1)。孢子长(13.6±0.9) μm [(11.4—15.3) μm](n=175), 宽(10.2±0.9) μm [(7.5—12.8) μm](n=175), 厚(7.6±0.6) μm[(6.9—8.3) μm](n=5)。两梨形极囊开口处紧靠并位于孢子前端, 极囊大小不等, 大极囊长(6.2±0.4) μm[(5.1—7.5) μm](n=175), 宽(3.8±0.4) μm [(2.8—4.7) μm](n=175), 极丝盘绕5—8圈, 小极囊长(2.7±0.4) μm[(1.7—3.7) μm](n=175), 宽(1.4±0.2) μm [(0.9—1.9) μm](n=175), 极丝盘绕2—3圈。尖形碘泡虫重庆7株系形态与原始描述相符(图 1和表 1)[16]。通过比较发现, 与尖形碘泡虫形态较相似的种有微孢碘泡虫(Myxobolus microsporesLi and Nie, 1973)、葡萄碘泡虫(Myxobolus acinosusNie and Li, 1973)和异样碘泡虫(Myxobolus diversusNie and Li, 1973)。与微孢碘泡虫相比, 尖形碘泡虫的孢子略大(11.3—15.5 μmvs.9.6—12.0 μm)。葡萄碘泡虫孢子呈茄形, 前端狭窄而稍弯, 这与尖形碘泡虫的梨形孢子前端略尖且不弯曲的形态有所不同。异样碘泡虫的孢子比尖形碘泡虫稍大(13.2—16.8 μmvs. 11.3—15.5 μm),且大极囊长约占孢子长的1/3, 而尖形碘泡虫的大极囊长约占孢子长的1/2(表 1)[21]。

表1 尖形碘泡虫与相似种的形态学比较Tab. 1 Morphological comparison of Myxobolus acutus with its similar species (μm)
主成分分析结果显示, 本研究所检获的尖形碘泡虫7株系间(S1—S7)孢子形态量度无显著差异(图 2)。

图2 尖形碘泡虫重庆各株系主成分分析Fig. 2 Principal component analysis (PCA) for Myxobolus acutus of Chongqing strains
2.2 尖形碘泡虫18S rDNA分子特征及系统发育分析
获得尖形碘泡虫S1—S7株系18S rDNA序列片段长度分别为1851 nt(GenBank登录号: MZ782721)、1932 nt(GenBank登录号: MZ782722)、1896 nt(GenBank登录号: MZ782723)、1871 nt(GenBank登录号: MZ782724)、1810 nt(GenBank登录号: MZ 782725)、1677 nt(GenBank登录号: MZ782726)和1839 nt(GenBank登录号: MZ782727)。7株系间序列相似度为100%, 遗传距离为0, 变异位点0个, 即7株系18S rDNA序列为同一基因型。尖形碘泡虫18S rDNA序列与GenBank数据库中的中华单极虫(Thelohanellus sinensis, KY469292)相似度最高(95.4%), 遗传距离最小(0.047), 其次为苍梧碘泡虫(Myxobolus tsangwuensis, KJ561441; 93.6%, 0.081)和贝壳碘泡虫(Myxobolus musseliusae, FJ710801;93.2%, 0.080)。
本研究获得株系S1、S5和S6的ITS1序列, 长度分别为298、318和318 nt。序列分析结果显示, 株系S5与株系S6共享同一基因型, 该基因型与株系S1的基因型序列差异较大, 差异位点数有168个(图 3)。
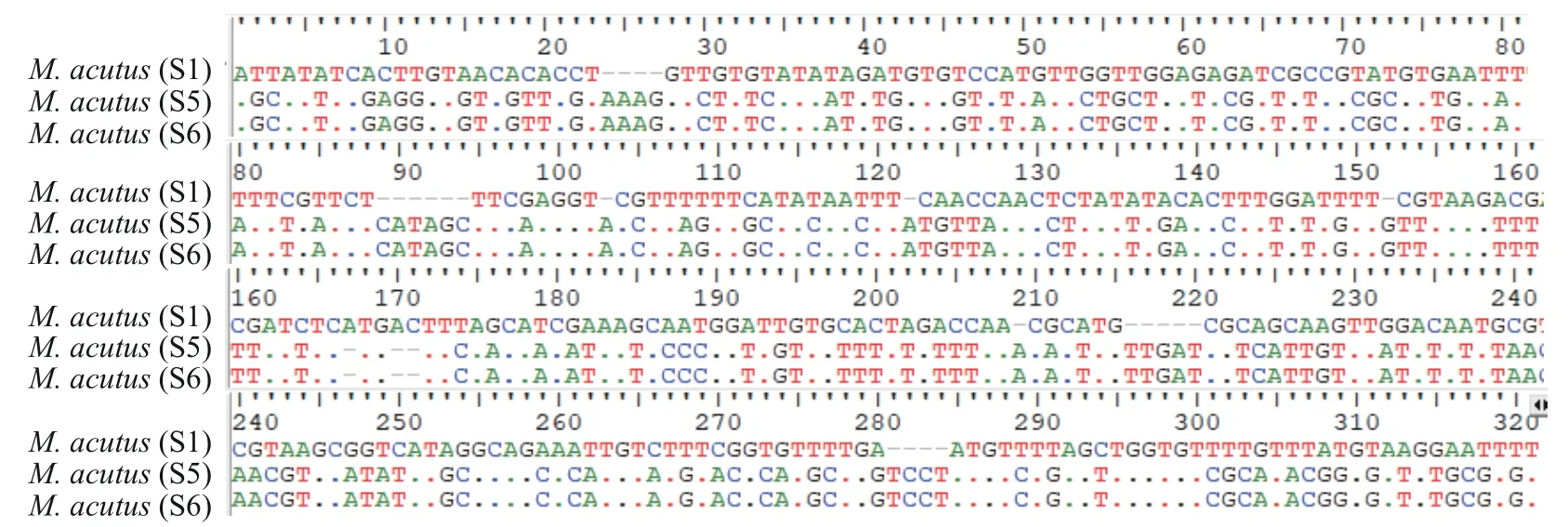
图3 尖形碘泡虫S1、S5、S6三株系间ITS1序列分析Fig. 3 The site variation analysis of ITS1 sequences for the three strains (S1, S5 and S6) of Myxobolus acutus
本研究构建的ML树和BI树拓扑结构一致(图 4)。系统树聚为三大支系, 其中进化支Clade Ⅰ处于系统树的基部位置, 后依次为Clade Ⅱ和Clade Ⅲ进化支。尖形碘泡虫位于Clade Ⅲ支系中Subclade A亚支: 尖形碘泡虫与中华单极虫(KY469292)聚为一支, 该支与贝壳碘泡虫(JQ040301)、苍梧碘泡虫(KJ561441)和鳃基碘泡虫(AF507971)形成的进化支呈姐妹群关系(图 4)。

图4 基于18S rDNA序列构建的ML/BI树Fig. 4 ML/BI phylogenetic tree based on the 18S rDNA sequences
3 讨论
本研究获得的尖形碘泡虫孢子形态符合原始描述。宿主鲫的胆囊为尖形碘泡虫的感染部位新记录, 重庆地区为地理新分布。原始报道的尖形碘泡虫仅以游离孢子的形式存在, 而本研究发现该物种可以形成孢囊。尖形碘泡虫重庆各株系间成熟孢子形态相似, 主成分分析结果进一步表明各株系间孢子形态量度无显著差异, 应为同一物种。同时,7株系间18S rDNA序列无差异, 进一步证实这些株系为同一物种。
以往的研究表明, ITS1是研究物种种内关系的理想分子标记, 在不同生物类群中得到了广泛应用[22—27], 而在黏孢子虫类群中的相关应用则很少[28—30]。本研究分别获得了尖形碘泡虫S1、S5和S6株系的ITS1序列。序列分析显示, S5和S6共享1个基因型, 该基因型与S1的序列存在很大差异(共有168个差异位点)。这表明尖形碘泡虫在嘉陵江重庆段江域具有一定程度的遗传多样性水平, 并且S1可能与S5和S6有着不同的遗传来源。
本研究系统发育分析显示, 处于分化较早支系的寄生虫其寄生部位表现出了较高的一致性, 如Clade Ⅰ物种的寄生部位均为肌肉, Clade Ⅱ物种的寄生部位均为鳃。而分化较晚的Clade Ⅲ支系, 虽然没有完全表现出寄生部位的高度一致性, 但在一些小的进化亚支中的物种仍有较为一致的寄生部位(图 4)。这表明, 碘泡虫科物种的系统发育与其寄生部位有着较为密切的关系。在碘泡虫科物种进化过程中, 逐渐由原来的寄生部位高度一致性向多寄生部位演化, 在分化最晚的Clade Ⅲ进化支中即出现了一些物种具有多寄生部位的现象(图 4)。从进化角度来看, 在一个支系中大多数物种共有的寄生部位应是初始寄生部位, 其他的则是后来适应的新寄生部位。如Subclade A进化亚支中, 物种均寄生于鳃部, 而其中的尖形碘泡虫不仅可寄生于鳃,还可寄生于胆囊(图 4), 从系统发育与寄生部位演化的角度推测, 尖形碘泡虫的初始寄生部位应为鳃,而胆囊则是其后来适应的新的寄生部位。
