siRNA干扰对鲤疱疹病毒Ⅱ型ORF57基因表达的影响
2022-05-27金李萍潘晓艺蔺凌云姚嘉赟尹文林赖迎迢陶家发刘忆瀚沈锦玉
金李萍 潘晓艺 蔺凌云 姚嘉赟 曹 铮 尹文林 赖迎迢 陶家发 刘忆瀚 沈锦玉, ,
(1. 上海海洋大学水产与生命学院, 上海 201200; 2. 浙江省淡水水产研究所, 农业农村部淡水渔业健康养殖重点实验室,浙江省鱼类健康与营养重点实验室, 湖州 313001; 3. 中国水产科学研究院珠江水产研究所,农业农村部渔用药物创制重点实验室, 广州 510380)
鲤疱疹病毒Ⅱ型(Cyprinid herpesvirus 2, Cy-HV-2)是一种能够感染金鱼和鲫及鲫变种的双链DNA病毒, 是鲤科鱼类中发现的第二种疱疹病毒,其属于疱疹病毒目(Herpesvirales)异源疱疹病毒科(Alloherpesviridae)鲤疱疹病毒属(Cyprinivirus)[1]。该病毒感染鲫可引起鲫造血器官坏死病(Crucian carp hematopoietic necrosis)[2], 患病鲫表现为食欲下降, 离群独游, 呼吸速率增加, 体表和鳍条基部出血,眼球突出, 鳃丝肿胀, 充血或出血; 脾和肾肿大、充血等症状。该病病程发展迅速, 死亡率高达90%—100%, 已成为影响中国鲫鱼养殖最为严重的疫病之一[3—5]。
RNAi(RNA interference, RNA干扰)[6,7]指通过双链RNA(dsRNA)的介导, 特异性降解对应序列的mRNA, 从而特异性抑制相对应基因的表达。目前RNAi技术已广泛运用于植物、线虫和果蝇等低等模式生物的基因表达、调控与功能的研究中, 在水生动物抗病毒研究中, RNA干扰技术也被广泛应用, 如用于对白斑综合症病毒、黄头病毒、草鱼出血病病毒和神经坏死病毒的抗病毒感染研究[8]。黄桂菊等[9]通过对融合了绿色荧光蛋白(EGFP)基因的石斑鱼神经坏死病毒(Nervous necrosis virus,NNV)衣壳蛋白(Major capsid protein, MCP)基因进行siRNA干扰试验, 表明不同剂量的siRNA均能干扰绿色荧光蛋白的表达。
本实验针对CyHV-2ORF57设计3组siRNA, 通过转染异育银鲫脊髓组织细胞系(Spinal cord tissue cell lines ofCarassius auratus gibelio, CSC)后, 进行CyHV-2感染, 通过对细胞病变和病毒含量的测定评估各组siRNA对病毒复制的抑制效率, 为分析CyHV-2的功能因子, 及通过RNA干扰技术防治Cy-HV-2提供研究基础。
1 材料与方法
1.1 材料
异育银鲫脊髓组织细胞系CSC[10]、CyHV-2病毒株CNTB2015由浙江省淡水水产研究所鱼病室保存。脂质体Lipofectamine 2000购自 Invitrogen公司;L-15培养基、双抗、胰蛋白酶-EDTA、Opti-MEMⅠ购自Gibco公司; 新生牛血清, 购自金源康公司; 培养细胞总RNA提取试剂盒(DP430)、FastKing cDNA第一链合成试剂盒、SuperReal荧光定量预混试剂购自天根生化科技 (北京) 有限公司。
1.2 siRNA的合成及引物设计
根据CyHV-2病毒株CNTB2015基因组(Gen-Bank: MN201961)的ORF57基因片段设计3条siRNA, 并设一组阴性siRNA(siRNA-control); 针对异育银鲫β-actin基因设计一条FAM修饰的siRNA,同时设计合成针对各条siRNA作用位点的检测用引物, 由生工生物工程(上海)公司合成, 序列信息如表 1。

表1 siRNA和PCR引物序列信息Tab. 1 Sequences of siRNA and primers
1.3 细胞的培养
CSC细胞用含10%新生牛血清和1%双抗的L-15培养基于24℃条件下培养。生长至单层后用0.25%胰酶-EDTA消化, 并按2×105cell/mL 100和500 μL分别接种于96孔板和24孔板中, 于24℃条件下培养。
1.4 病毒的培养及TCID50测定
取保存的CyHV-2 CNTB2015病毒液200 μL接种至CSC细胞生长良好的T25细胞瓶中, 孵育30min, 然后加入5 mL维持液(含2%新生牛血清和1%双抗的L-15培养基), 置于24℃培养。细胞病变达到70%左右, 吹落细胞制成病毒液, 冻融1次后,12000 r/min离心5min后取上清液, 作为感染用病毒液备用。
将制备的病毒液作连续10倍梯度稀释, 获得8个稀释度10-5、10-6、10-7、10-8、10-9、10-10、10-11和10-12的病毒液, 并设置空白对照组, 每组8个重复。在长满单层CSC细胞的96孔板中每孔接种各稀释度的病毒液100 μL, 孵育30min后弃去, 再加入100 μL维持液, 置于24℃培养箱中培养, 逐日观察细胞病变, 并记录细胞病变孔数。按Reed-Muench法[12]计算病毒滴度TCID50值。
1.5 siRNA转染量和转染液维持时间优化
siRNA采用脂质体(Lipofectamine 2000)包裹的方式转染, 其使用浓度为说明书的推荐浓度, 转染使用的培养基为Opti-MEMⅠ, 将FAM-β-actinsiRNA初始浓度配置成20 μmol/L。各取一定量FAM-β-actin-siRNA与Opti-MEMⅠ培养基配置成不同浓度(转染终浓度分别为40、80和120 nmol/L)的siRNA复合物50 μL, 将脂质体Lipofectamine 2000和Opti-MEMⅠ培养基配置成Lipofectamine 2000复合物50 μL, 分别混合静置5min, 再将siRNA复合物加入Lipofectamine 2000复合物中, 轻轻混匀, 避光静置25min, 然后加入400 μL Opti-MEMⅠ培养基, 轻轻混匀, 获得 500 μL的FAM-βactin-siRNA-脂质体复合物溶液, 配制比例见表 2。
在CSC细胞长至80%时进行siRNA的转染。首先, 弃尽24孔板中培养液, 再将上述siRNA-脂质体复合物加入24孔板中, 共5组: 3个不同浓度的siRNA组、阴性siRNA对照组和Mock对照组; 每组设6重复。在转染6h后每组选3个重复孔弃尽转染液, 换成含10 %新生牛血清和1%双抗的L-15继续培养。在转染24h后, 将所有孔中的培养液吸弃, 并用维持液清洗一次, 再加入维持液后, 在荧光显微镜下拍照观察荧光信号。并在优化的转染条件下转染, 在不同时间(24h、48h、72h和120h)进行转染效果的观察。每组选取3张荧光照片通过软件Image J计算图片中荧光点数量, 首先将图像转为8-bit,调整阈值后, 进行自动分析和颗粒计数(Image-Adjust-Threshold-Analyze-Analyze Particles), 可选步骤: 填补细胞核的空隙(Process-Binary-Fill Holes)打断细胞核的重叠部分(Process-Binary-Watershed),计算各组荧光点平均值; 同时提取各组细胞RNA,以标定基因拷贝数浓度的β-actin基因PCR纯化产物为参考, 通过荧光定量PCR测定各组β-actin基因表达量, 选择转染抑制效果最优组的转染条件作为后期试验转染条件。
1.6 CyHV-2 ORF57 siRNA对CyHV-2病毒的抑制作用
按1.5中优化后的条件, siRNA浓度80 nmol/L、转染液维持24h, 转染三组CyHV-2ORF57的siRNA(ORF57-siRNA-1、ORF57-siRNA-2、ORF57-siRNA-3), 同时设置阴性对照组(阴性siRNA)、阳性对照组(β-actinsiRNA)、MOCK对照组和空白对照组。每组设立3个重复孔。
在siRNA转染液维持24h后, 洗去转染液, 加入200 μL CyHV-2病毒液(TCID50为108.325/mL), 孵育30min后, 吸弃病毒液, 加入维持液, 于24℃培养, 分别在第24h、48h、72h和120h进行细胞状态观察,并采集样品提取RNA用于转录基因的定量检测, 对其中维持至第120h的细胞样品进行TCID50测定(方法同1.4), 分组情况如表 3所示。
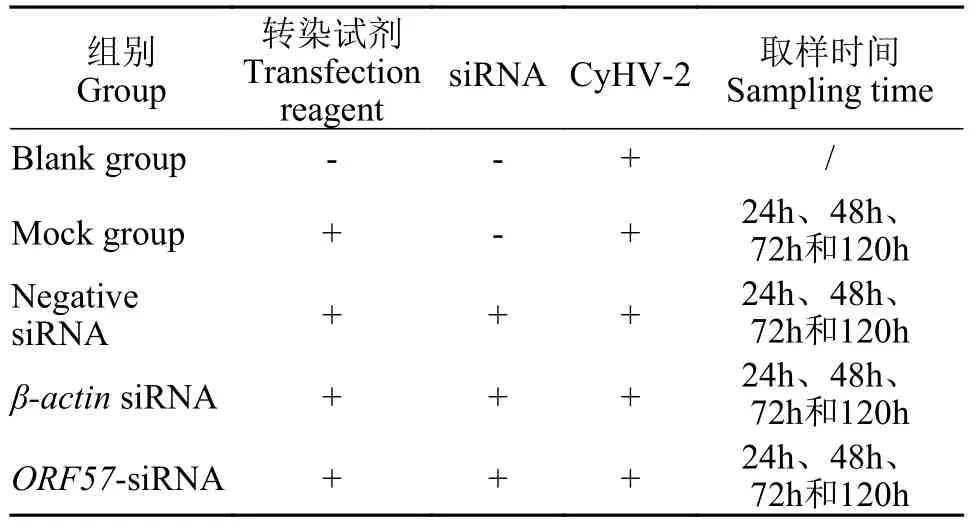
表3 siRNA抑制试验分组Tab. 3 Grouping of transfection inhibition test
1.7 总RNA的提取及ORF57转录检测
对1.6中采集的细胞样品按试剂盒说明书进行总RNA的提取, 取80 ng RNA进行cDNA合成(FastKing cDNA 第一链合成试剂盒)。按表 2中的引物进行荧光定量PCR, 每组共3个平行样品, 每个样品设立2个重复, qPCR采用SuperReal PreMix Plus(SYBR Green)试剂盒, 据说明书的25 μL反应体系进行配制, 反应程序为: 95℃ 15min; 95℃ 10s、60℃ 32s, 40个循环。选择鲫β-actin作为内参基因进行校准, 采用2-ΔΔCt法计算ORF57的相对表达量,ΔΔCt=(Cttarget-Ctβ-actin)待测样本-(Cttarget-Ctβ-actin)校准样本。
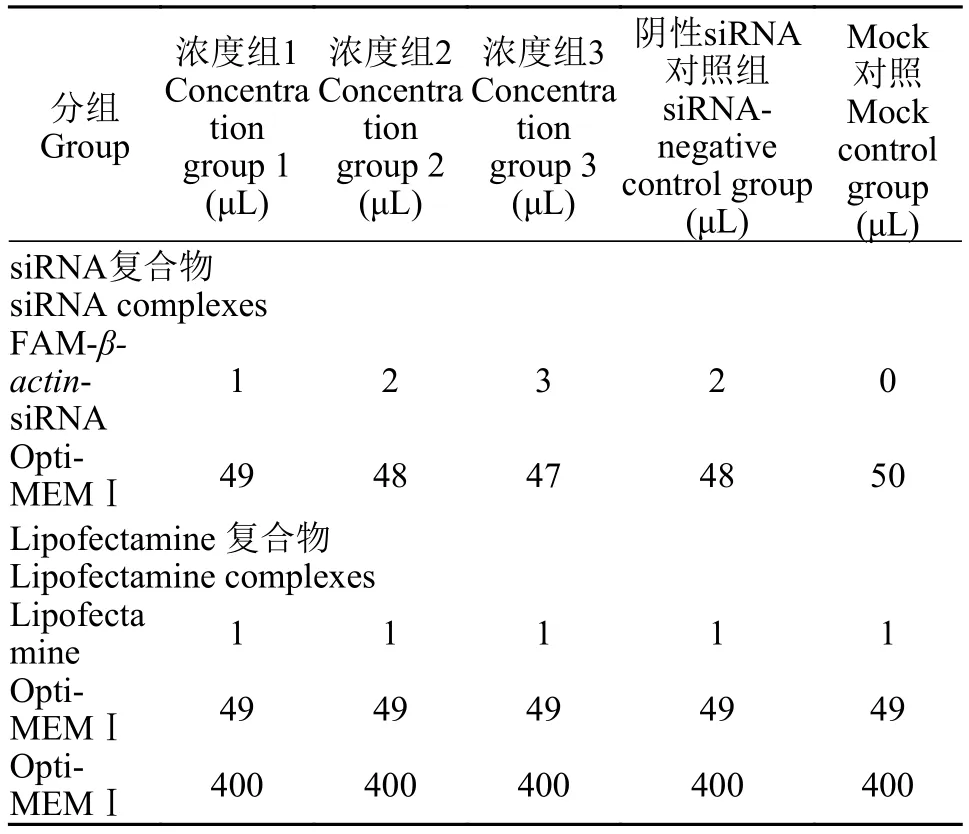
表2 加样配比表Tab. 2 Sampling ratio table
1.8 数据分析
实验数据均以平均值±标准差表示。其中,ORF57在不同组的相对表达量采用T检验分析, 统计学显著性水平设定P<0.05表示差异显著。
2 结果
2.1 病毒培养及病毒滴度的测定
CyHV-2病毒接种至CSC细胞中培养, 至第5天出现80%的细胞病变(图 1), 收获病毒液。于长满至80%单层的CSC细胞的96孔板中进行TCID50测定,记录每个稀释度的细胞病变孔数(表 4), 按Reed-Muench法计算, 获得TCID50为108.325/mL。
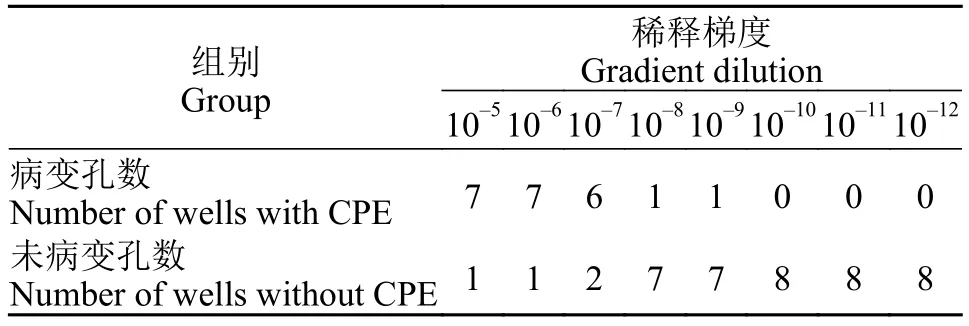
表4 TCID50病毒滴度测定Tab. 4 Detection of TCID50 in different virus dilutions

图1 正常细胞与病变细胞状态图Fig. 1 Normal cells and pathological cells
2.2 siRNA 转染条件优化
采用针对β-actin基因的FAM-siRNA在24孔板培养的CSC细胞上进行转染条件优化。采用荧光显微镜在相同放大倍数和相同发射光强度下, 采集各组别的荧光图片(图 2), 通过图片处理软件Image J分析各组3张图片的荧光点数量。各组荧光点平均值见表 5。结果显示: 转染液体维持6h后, 荧光信号与siRNA终浓度呈正相关; 而维持24h后, 80 nmol/L转染浓度组荧光点数最高, 平均1366个, 40 nmol/L浓度组平均荧光点数700个。

表5 Image J 统计荧光点数量Tab. 5 Number of fluorescent spots counted by Image J
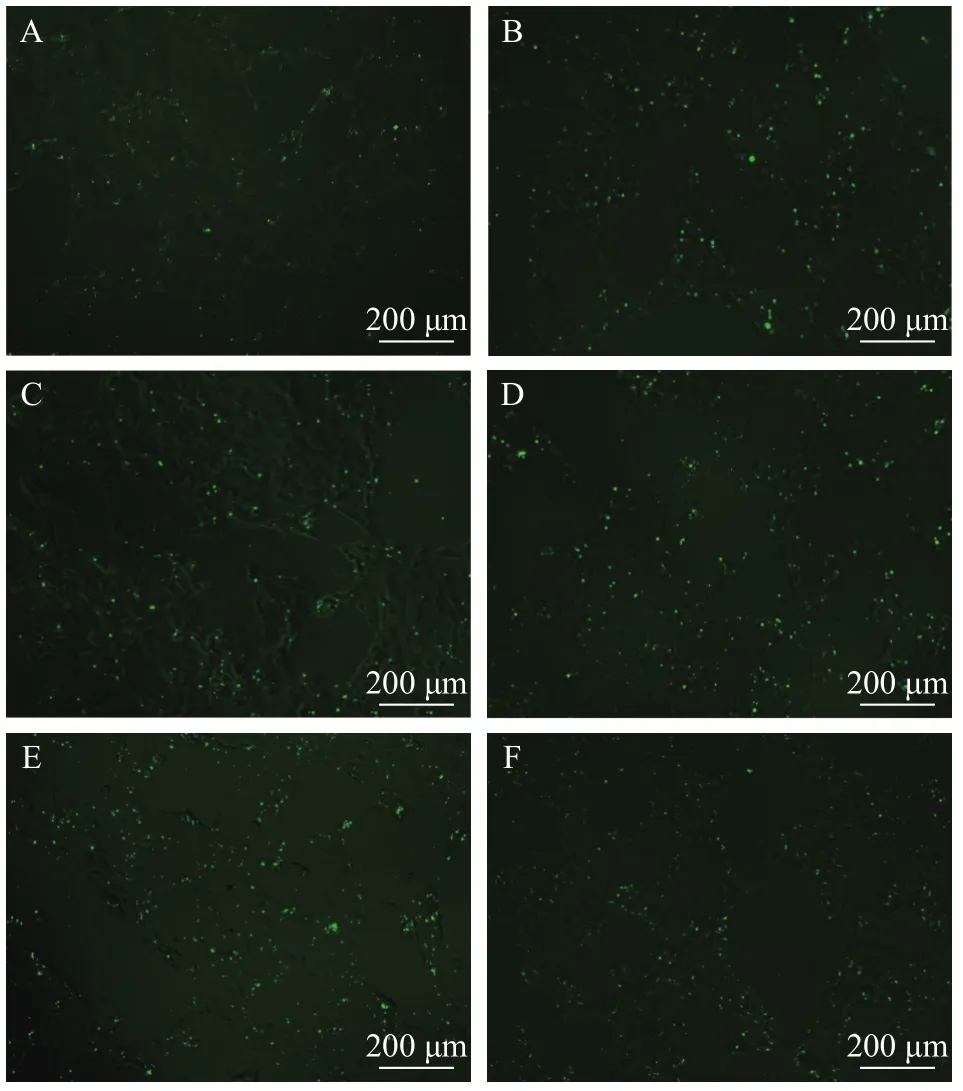
图2 在不同条件下FAM-β-actin-siRNA转染效果Fig. 2 Effect of different concentrations of FAM-β-actin- siRNA transfection
提取各组样品RNA, 通过荧光定量PCR检测各组β-actin基因拷贝数, 结果显示, 当转染浓度为80 nmol/L, 转染时间为24h时,β-actin基因表达量最低(表 6),表明该组转染后, siRNA的干扰效果相对较好。

表6 在各转染方案下β-actin基因拷贝数Tab. 6 Copy number of β-actin gene under each transfection scheme(copies/ng)
结合荧光照片荧光点数量和β-actin基因表达量的分析结果, 以80 nmol/L浓度的FAM-β-actin-siRNA转染CSC细胞, 转染后维持时间为24h时, siRNA的抑制效率最高。因此, 选择以80 nmol/L浓度的siRNA转染CSC细胞后维持24h作为后期转染试验方案。
在优化后的条件下转染FAM-β-actin-siRNA后,吸弃转染液, 加入维持液, 在第24、第48、第72和第120h在荧光倒置显微镜(Leica DMI 3000B)下进行荧光信号观察(图 3)。结果表明, 在24—72h内荧光信号数量无显著差异; 在第120h时, 观察到荧光点的数量和细胞数量都显著减少。通过荧光定量PCR检测各组β-actin基因转录拷贝数, 结果显示(表 7),FAM-β-actin-siRNA在120h内对细胞β-actin基因转录的抑制效果存在小幅波动, 在第72h时抑制效率最高, 第24和第120h两个时间点抑制效率无显著差异。

表7 转染后24h、48h、72h和120h β-actin基因表达情况Tab. 7 Expression of β-actin gene at 24h, 48h, 72h and 120h after transfection (copies/ng)
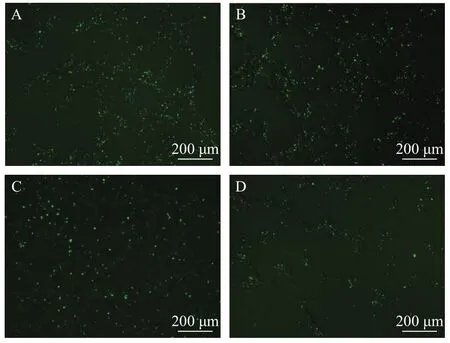
图3 转染后24h、48h、72h和120h荧光信号Fig. 3 Observation of fluorescence effect at 24h, 48h, 72h and 120h
2.3 ORF57-siRNA对CyHV-2病毒致细胞病变的抑制作用
对转染不同ORF57-siRNA的CSC细胞进行病毒感染, 并对感染病毒后的细胞进行观察, 结果显示: 在感染病毒后第24和第48h, 各组无明显细胞病变, 第72h各组细胞出现部分聚集, 在第120h各组观察到明显的细胞病变(图 4)。在第120h时, 相较对照组,ORF57-siRNA-2组细胞病变最少,ORF57-siRNA-3组次之,ORF57-siRNA-1组略轻于对照组,表明在3组siRNA中ORF57-siRNA-2抑制病毒致细胞病变效果最好。
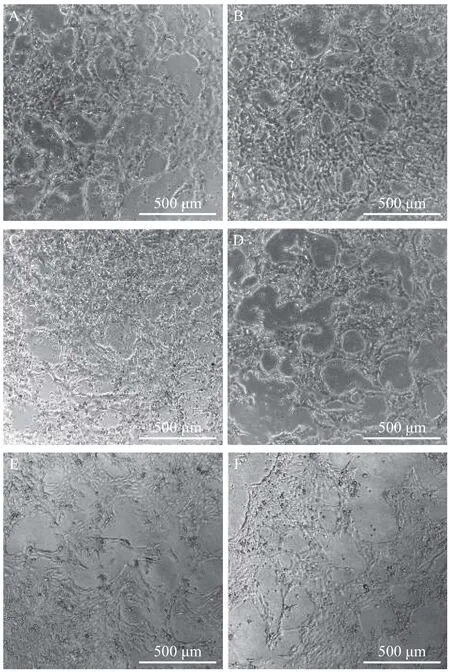
图4 ORF57-siRNAs在120h干扰CyHV-2致CSC细胞病变效果Fig. 4 Effect of ORF57-siRNAs on CyHV-2-induced CSC CPE at 120h
2.4 ORF57-siRNA对CyHV-2 ORF57转录的抑制效率测定
ORF57-siRNA处理后的CSC细胞感染病毒后,提取总RNA进行逆转录, 以β-actin为内参基因, 进行ORF57表达差异相对定量分析。结果显示: 在48h内, 各siRNA组对病毒ORF57基因表达都有一定的抑制作用; 与MOCK组相比,ORF57-siRNA-2抑制效率最高, 表达量降低至33.55%(P<0.01),ORF57-siRNA-1组降低至50.59%(P<0.05),ORF57-siRNA-3组降低至70.72%(P<0.05; 图 5)。ORF57-siRNA -2组, 第48h时处于最低的33.55%, 之后缓慢升高, 至120h表达量上升至41.61%(P<0.05), 而阴性siRNA组的表达量接近于Mock对照组(图 6)。结果表明,ORF57-siRNA-2对CyHV-2ORF57转录具有较强的、较持久的抑制作用。
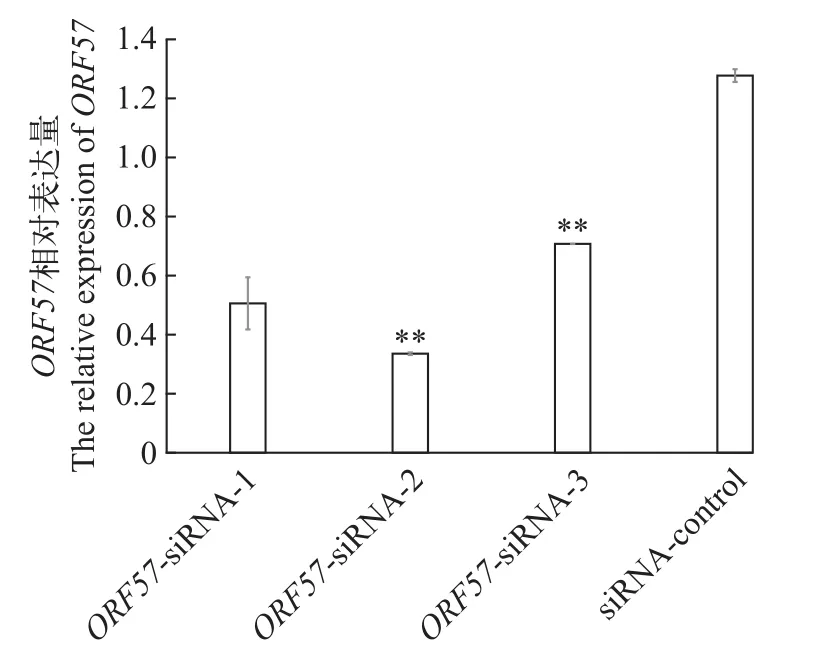
图5 ORF57-siRNAs处理后48h ORF57相对表达量Fig. 5 Relative expression of ORF57 at 48h after treatment withORF57-siRNAs
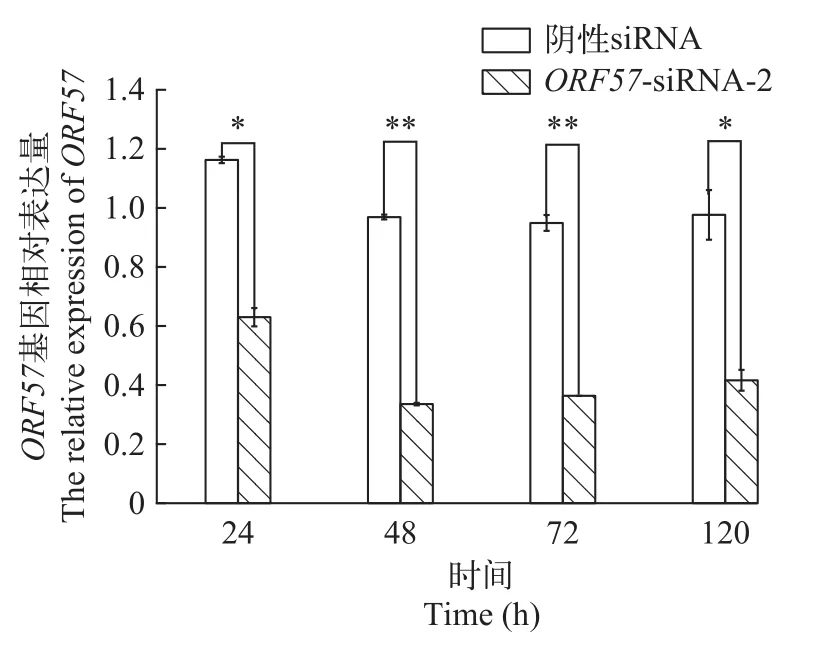
图6 不同时间点ORF57-siRNA-2对ORF57转录的抑制作用Fig. 6 Inhibitory effect of ORF57-siRNA-2 on transcription of ORF57 at different times
2.5 ORF57-siRNA对CyHV-2 TCID50的影响
取1.6收集的各组维持至第120h的病毒培养液,分别接种于长满至80%单层的CSC细胞的96孔板中进行TCID50测定, 按Reed-Muench法计算CyHV-2-ORF57-1组、CyHV-2-ORF57-2组、CyHV-2-ORF57-3组、阴性siRNA组和Mock组的TCID50。TCID50测定结果表明(表 8),ORF57-siRNAs对Cy-HV-2的复制具有一定的减弱作用, 其中CyHV-2-ORF57-2组的抑制作用最强, 与Mock相比TCID50降低了94%, 与阴性siRNA组相比降低了98.1%。
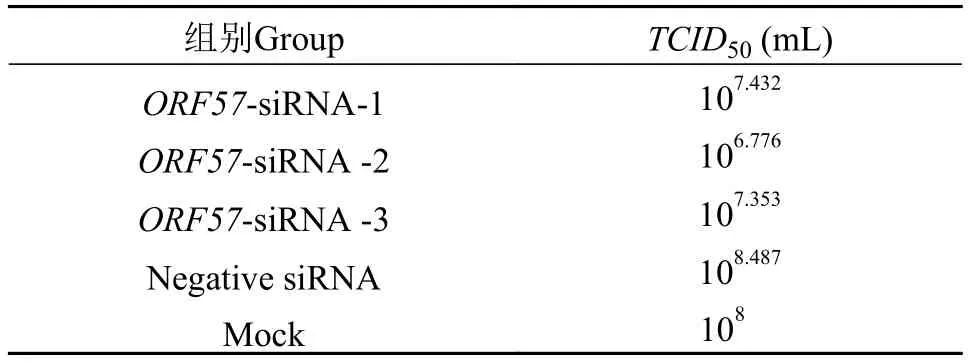
表8 ORF57-siRNAs对CyHV-2 TCID50的影响Tab. 8 Effect of ORF57-siRNA on CyHV-2 TCID50
3 讨论
3.1 siRNA对病毒复制的抑制作用
siRNA作为RNA干扰方式之一, 已被广泛用于抑制水生动物病毒复制方面的研究[13]。陈芸[14]通过将针对草鱼出血病病毒(Grass carp reovirus,GCRV)VP7的siRNA注射稀有鲫, 降低了实验组的死亡率, 并延缓了病程; 马杰等[15]设计并构建了同时靶向GCRV JX09-01(GCRVⅠ型)及GCRV 104(GCRVⅢ型)VP2蛋白基因的双siRNA表达载体,转染CIK细胞后, 可以同时抑制GCRV JX09-01和GCRV 104的复制, 说明多条siRNA可同时作用, 抑制多种病毒的复制。此外, siRNA还被用于包括白斑综合征病毒[16]、鲤春病毒血症病毒[17]、条石鲷虹彩病毒[18]和大鲵蛙病毒[19]等病毒的干扰研究。本研究针对DNA病毒CyHV-2的ORF57设计了3组siRNA, 通过脂质体转染CSC细胞后, 评估siRNA对CyHV-2病毒复制的干扰作用。结果也显示了siRNA在mRNA水平上抑制了CyHV-2ORF57的表达, 将ORF57mRNA拷贝数下降为33.55%, 进而延缓或减少细胞病变。以上研究结果表明, 利用siRNA抑制病毒的结构蛋白和非结构蛋白的表达都可以有效抑制病毒的复制, 这为水产动物病毒病的控制与治疗提供了有力工具。
3.2 ORF57的转录对CyHV-2复制的影响
鲤疱疹病毒包括鲤疱疹病毒Ⅰ型(CyHV-1)、鲤疱疹病毒Ⅱ型(CyHV-2)和鲤疱疹病毒Ⅲ型(Cy-HV-3), 3种类型鲤疱疹病毒ORF57编码的氨基酸序列之间的相似性在50.61%—54.1%, 表明该基因鲤疱疹病毒属中较为保守。在鳗疱疹病毒1(AngHV-1)和遗传关系更远的鳄痘病毒(CRV)中也存在ORF57的同源基因, 表明该基因可能存在相同的祖先[20,21], 但其具体功能还未有报道。Boutier等[22]构建缺失ORF57基因的CyHV-3, 通过攻毒试验, 表明缺失ORF57的CyHV-3失去了对锦鲤的致病力, 并且ORF57蛋白在CyHV-3病毒粒子中含量最丰富的蛋白之一[23]。作为在中国新发的病原CyHV-2, 其同源基因ORF57的编码蛋白是其八大主要免疫原蛋白之一[24], 作为早期基因在感染细胞2—4h后被转录[25]。但其对CyHV-2毒力的影响, 未有人报道。本研究通过ORF57siRNA的干扰, 将ORF57的转录拷贝数下降50%以上, 相对于未干扰组,siRNA干扰后的病毒TCID50从108.487/mL降低至106.776/mL, 这表明,ORF57的转录影响着CyHV-2的复制。通常体内病毒滴度的高低与病毒致病性存在着较大相关性, 因此,ORF57对CyHV-2在体内致病力的表现具有潜在的影响作用。
3.3 转染时机对siRNA转染效率的影响
阳离子脂质体转染法已广泛被用于细胞DNA/RNA的转染, 但也存在有细胞毒性的缺陷[26]。本研究在使用高浓度Lipofectamine 2000及转染高浓度siRNA(120 nmol/L)时, 转染后都出现细胞脱落以及细胞状态不佳的情况。根据荧光强度, siRNA转染终浓度为80 nmol/L、维持24h时, 荧光信号最强, 高于40和120 nmol/L两组; 测定鲫β-actin基因表达量,转染终浓度为80 nmol/L时, 在第72h时抑制效率达到最大值。本研究选择80 nmol/L浓度的siRNA进行转染, 既能保证一定的转染效率, 也能让细胞处在良好的实验状态。转染后120h内CSC细胞在siRNA作用下能够被稳定的抑制基因的表达, 在siRNA转染后的第72h表现出最佳的转染抑制效果,这与转染24h接种病毒后第48h抑制效果最佳的结果相符。在细胞生长旺盛阶段进行siRNA的转染能够提高转染效率, 在实际操作中, 常选择铺满程度为80%的细胞用于转染。在研究过程中, 病毒感染时机的选择上, 不同学者采取的方法各异, 杨光等[27]就比较了感染病毒与转染siRNA的顺序对病毒干扰结果的影响, 结果表明, 先感染病毒后进行siRNA干扰组的细胞存活率要优于先转染siRNA后感染病毒组。而李兵[28]研究的RNA干扰抑制草鱼呼肠孤病毒复制的细胞模型实验中, 则是选择了先转染siRNA, 再进行病毒感染的程序, 对病毒的抑制率达到80%以上。本研究选择了先转染siRNA,后感染病毒的程序进行siRNA的研究。
4 结论
在本研究中, 利用RNA干扰技术针对CyHV-2重要基因ORF57进行干扰, 在CSC细胞上对病毒复制获得了较好的抑制效果, 对病毒mRNA转录的抑制率最高达66.45%, 对病毒滴度最高降低98.1%。该结果表明,ORF57在CyHV-2的毒力表现中起到重要作用, 其具体生物学功能有待进一步研究。这为CyHV-2毒力相关基因研究提供借鉴, 也为Cy-HV-2弱毒株的改造和基于siRNA技术的抗CyHV-2防治提供思路。
