lncRNA-KAT7对肺癌细胞侵袭迁移能力的影响*
2022-05-27王晴美龚永禄罗迪贤
雷 鸣,王晴美,龚永禄,杜 维,邓 毅,罗迪贤△
1.湖南省常德市第一人民医院检验科,湖南常德 415003;2.南华大学转化医学研究所,湖南衡阳 421000
肺癌是全球发病率最高、生命危害最大的恶性肿瘤之一[1]。由于肺癌早期没有明显的临床症状,在确诊时癌细胞就已经不受控制的增殖、侵袭和转移,大多数患者的中位生存期不足1年,5年生存率仅在17%左右[2]。因此,在分子层面对肺癌的发生发展和转移机制进行更深入的研究,对肺癌的早期诊断和精准治疗具有重要意义[3]。长链非编码RNA(lncRNA)是一类转录本长度大于200 nt,但不具备编码蛋白质功能的RNA分子[4],其以RNA形式在多种层面上参与调节转录或转录后水平基因的表达,影响细胞的生长、发育、凋亡和分化[5],并且与物种进化、胚胎发育及肿瘤的发生发展等有着密切的联系[6]。目前已有多个lncRNA被证实与肿瘤的侵袭迁移及预后有关。lncRNA-KAT7是本课题组前期应用lncRNA表达谱芯片分析技术在肺癌组织及癌旁组织中筛选到的具有明显差异表达的lncRNA。lncRNA-KAT7位于人17号染色体的hg19区域正链上,GC水平为58%,转录子长度为575 bp,无编码蛋白的开放阅读框。有研究发现,lncRNA-KAT7在结直肠癌癌组织内低表达,其可能通过抑制NF-κB磷酸化及肿瘤细胞上皮间质转化过程来抑制结直肠癌细胞增殖、迁移和侵袭[7]。而目前关于lncRNA-KAT7在肺癌中的表达及相关功能的报道较少。本研究旨在分析lncRNA-KAT7基因在肺癌组织及癌旁组织标本中的表达情况,并了解其与肺癌患者临床病理参数的关系,同时通过Transwell实验在体外条件下检测lncRNA-KAT7过表达对肺癌细胞迁移和侵袭能力的影响,为临床治疗肺癌寻找新的靶点。
1 材料与方法
1.1组织标本 收集2018年1—6月于常德市第一人民医院胸外科行肺癌切除术的38例患者的原发病灶癌组织标本及其癌旁组织标本(距离癌灶边缘5 cm以上),并保存于液氮中。本研究经常德市第一人民医院医学伦理委员会批准,入选患者均知情同意。
1.2仪器与试剂 人肺癌细胞株(A549)购自上海细胞库;通用细胞冻存液、DMEM培养基、胎牛血清(FBS)、RNA提取试剂盒、实时荧光定量PCR(q-PCR)、Lipofectamine®2000 Reagent试剂均购自美国Thermo Fisher Scientific公司;质粒小抽提试剂盒购自北京天根生化科技有限公司;康宁Transwell板、Matrigel基质胶购自北京拜尔迪生物技术有限公司。
1.3方法
1.3.1q-PCR检测 采用Trizol试剂盒提取肺癌组织及癌旁组织、肺癌A549细胞的总RNA,测定其纯度和浓度。将得到的RNA反转录为cDNA,以cDNA为模板,GAPDH作为内参,采用q-PCR测定肺癌组织、癌旁组织及各组A549细胞中lncRNA-KAT7的表达水平。lncRNA-KAT7引物序列如下,上游引物:5′-AGCTCTTGGTTGAGCCCTTC-3′;下游引物:5′-GGGGCTGTGTGTGATTTTGTC-3′;GAPDH的引物序列如下,上游引物:5′-ACCACAGTCCATGCCATCAC-3′;下游引物:5′-TCCACCCTGTTGGTGTA-3′。q-PCR反应条件:50 ℃ 2 min;95 ℃ 5 min;95 ℃ 15 s,60 ℃ 60 s,共40个循环;使用2-ΔΔCt公式计算lncRNA-KAT7的相对表达水平。实验重复3次。
1.3.2质粒载体构建和细胞转染 空载体pcDNA-3.1为本实验室自备,采用分子克隆方法构建lncRNA-KAT7表达质粒pcDNA-lncRNA-KAT7;选取生长状态良好的A549细胞悬液,将其稀释为每毫升DMEM培养基中含1×106个A549细胞后,接种于六孔板进行细胞培养,当细胞融合度达到70%~80%时根据基因转染操作手册进行瞬时转染。根据实验设计将A549细胞分为pcDNA-3.1组和pcDNA-lncRNA-KAT7组,分别将空载体pcDNA-3.1和pcDNA-lncRNA-KAT7质粒瞬时转染至A549细胞,同时将绿色荧光蛋白GFP瞬时转染至A549细胞,q-PCR检测lncRNA-KAT7的转染效果。
1.3.3细胞迁移和侵袭实验 迁移实验:将瞬时转染24 h后的A549细胞重悬于无血清培养液中过夜饥饿培养,在Transwell上层小室中按每孔100 μL加入无血清A549细胞悬液(1×105个细胞),同时将800 μL含10%FBS的培养基作为化学引诱剂加入Transwell下层小室中,将其放置于5% CO2、37 ℃培养箱中继续培养24 h。取出小室,在上室中加入多聚甲醛固定迁移细胞,采用结晶紫染色试剂染色后用显微镜观察和捕获图像,取8个视野,进行细胞计数并计算平均值。细胞侵袭实验:需在Transwell小室上室包被Matrigel基质胶再孵育2 h水化后备用,其余步骤同迁移实验。

2 结 果
2.1肺癌组织及癌旁组织中lncRNA-KAT7基因的表达比较 肺癌组织中lncRNA-KAT7的表达水平明显低于癌旁组织(P<0.05);选取的38份肺癌组织及癌旁组织标本中,84.2%(32/38)的肺癌组织标本中lncRNA-KAT7的表达水平明显低于癌旁组织。见图1。
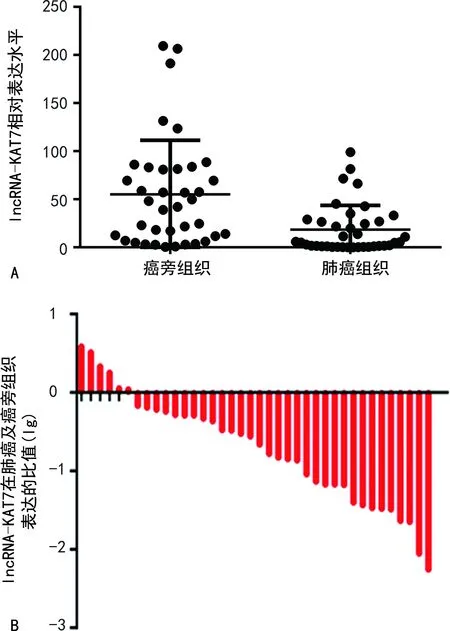
注:A为lncRNA-KAT7在肺癌组织及癌旁组织中的表达;B为lncRNA-KAT7在肺癌及癌旁组织表达的比值图。图1 lncRNA-KAT7在肺癌组织及癌旁组织中的表达比较
2.2lncRNA-KAT7的表达水平与临床病理特征的关系 lncRNA-KAT7的表达水平与患者的淋巴结转移(P=0.043)、肺癌组织学类型(P=0.001)及年龄(P=0.027)有关,但与患者的肿瘤分化程度、肿瘤最大径、TNM分期、T分级及性别无关(P>0.05)。见表1。

表1 lncRNA-KAT7表达水平与临床病理特征的关系[n(%)]
2.3A549细胞瞬时转染pcDNA-lncRNA-KAT7质粒后的结果检测 A549细胞瞬时转染pcDNA-lncRNA-KAT7质粒后,pcDNA-lncRNA-KAT7组lncRNA-KAT7表达水平明显高于pcDNA-3.1组,差异有统计学意义(P<0.05);采用倒置荧光显微镜检测A549细胞的转染效率在40%~50%。见图2。

注:A为瞬时转染后A549细胞中lncRNA-KAT7的平均荧光强度(MFZ);B为瞬时转染绿色荧光蛋白GFP的前后对比效果图。图2 A549细胞瞬时转染pcDNA-lncRNA-KAT7质粒后的结果
2.4Transwell实验检测lncRNA-KAT7对肺癌A549细胞迁移和侵袭能力的影响 Transwell实验结果显示,与pcDNA-3.1组比较,pcDNA-lncRNA-KAT7组平均每个视野穿至小室外的迁移细胞数和侵袭细胞数均明显减少(P<0.05)。见图3。
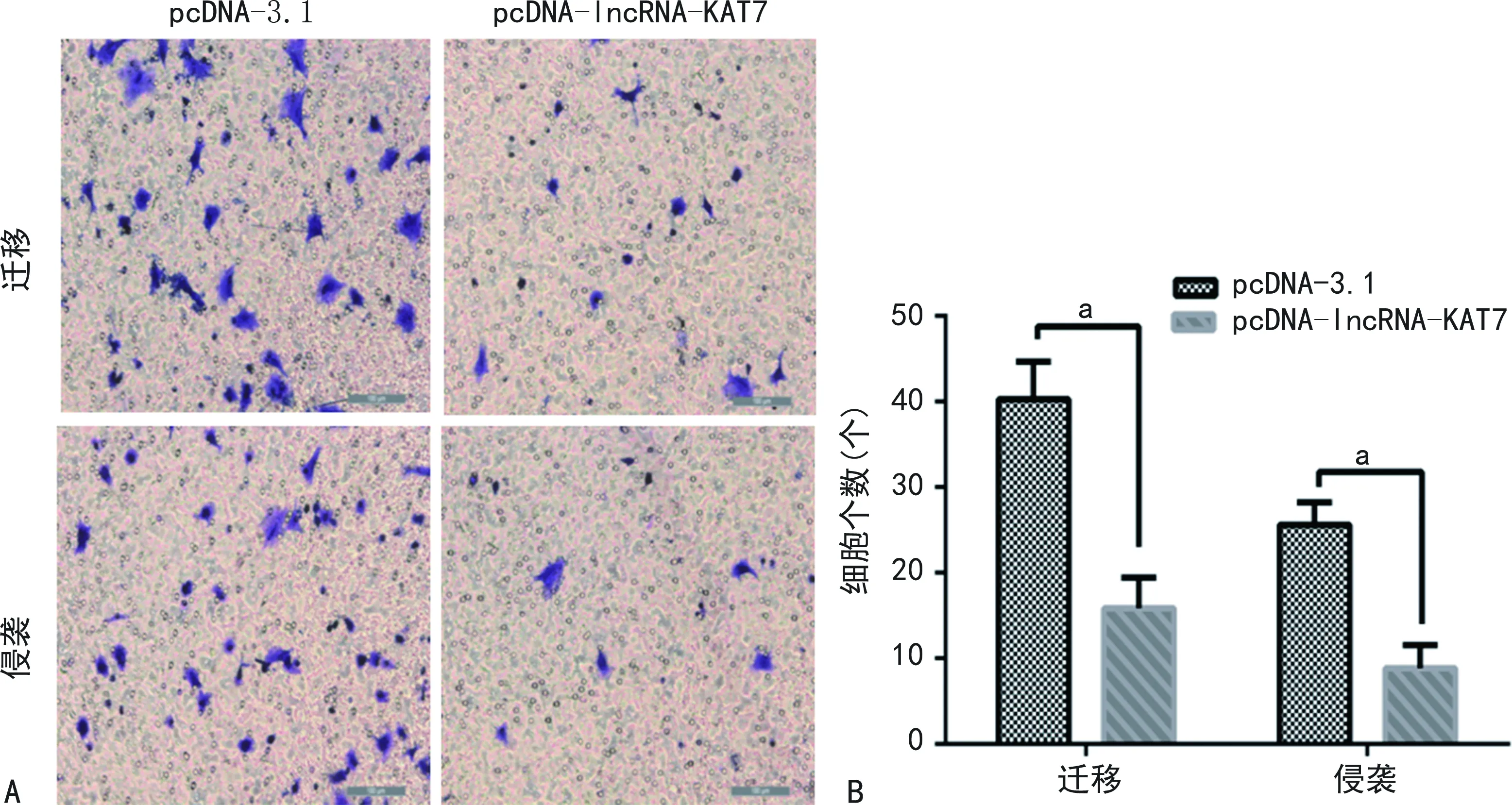
注:A为Transwell实验结果图;B为Transwell实验结果统计图;aP<0.05。图3 Transwell实验检测lncRNA-KAT7对肺癌A549细胞迁移和侵袭能力的影响
3 讨 论
lncRNA定位于细胞核和细胞质,曾被认为是基因转录的“噪音”或“暗物质”,并未受到重视[8]。但后来的研究发现,lncRNA可通过表观遗传学调控、转录调控及转录后调控机制调控基因表达,从而参与细胞的生理过程[9]。lncRNA的异常表达与肿瘤的形成、浸润、转移过程相关,其参与细胞分化、细胞内物质交换、核内运输、细胞周期、染色质修饰、干细胞重组、转录激活、转录干扰等多种重要的调控过程[10]。抑制肿瘤进展的关键在于抑制肿瘤细胞的迁移和侵袭,而lncRNA既可对肿瘤细胞的周期、凋亡、转移等产生影响[11],又可在表观遗传的层面上宏观调控肿瘤细胞的很多特征,从而在肿瘤发生和发展过程中发挥重要作用[12]。
随着精准医学的快速发展,肿瘤基因诊断和分子靶向治疗成为肿瘤诊断和治疗的重要发展方向[13]。在对lncRNA深入研究的过程中,人们发现了一些新的在肺癌中发挥促癌或抑癌作用的lncRNA[14],这些肺癌相关基因的异常表达对肺癌细胞的侵袭、迁移及增殖能力起到了重要的调控作用[15],并与患者预后及对化疗药物的耐药有密切关系[16]。研究发现lncRNA-ATB在肺癌组织和肺癌细胞中高表达,利用siRNA外源性沉默lncRNA-ATB,能够抑制肺癌细胞的增殖和迁移能力,以及促进肺癌细胞凋亡[17]。YANG等[18]的研究发现,lncRNA-BANCR在非小细胞肺癌(NSCLC)组织和细胞中表达缺失,其作为分子表达途径的重要调控因子对肺癌细胞活性、迁移、侵袭和凋亡发挥抑制作用,体内实验表明,为NSCLC模型小鼠注射lncRNA-BANCR表达细胞,对NSCLC肿瘤生长有一定的抑制作用。
lncRNA-KAT7是新近发现的一种结直肠癌抑制因子,但其在其他恶性肿瘤中的作用尚不清楚。本研究结果显示,lncRNA-KAT7在肺癌组织中的表达水平明显低于癌旁组织(P<0.05),提示lncRNA-KAT7可能是与肺癌发生发展相关的癌基因。为了进一步探讨lncRNA-KAT7表达与肺癌的关系,本研究对lncRNA-KAT7表达与肺癌患者临床病理特征进行了分析,结果显示lncRNA-KAT7的表达水平与患者的年龄、淋巴结转移有关,差异有统计学意义(P<0.05),但与患者的肿瘤分化程度、肿瘤最大径、TNM分期、T分级及性别无关(P>0.05),提示肺癌组织中lncRNA-KAT7参与肺癌淋巴结转移。本研究结果同时显示,lncRNA-KAT7表达水平与肺癌组织学类型有一定关系,其在肺鳞癌组织中的表达水平明显低于肺腺癌组织,提示lncRNA-KAT7在肺鳞癌中发挥的抑癌作用可能更强一些。由此笔者认为,lncRNA-KAT7有望成为肺癌诊断和预后判断的潜在肿瘤分子标志物。肿瘤的侵袭和转移被认为是肺癌死亡的重要原因之一。研究表明lncRNA可通过与miRNA竞争性结合、细胞内的剪切作用形成miRNA的前体,通过发挥内源性miRNA海绵作用的方式抑制miRNA的表达,从而促进或抑制肿瘤的发生发展[16,19]。GAO等[19]在研究中发现,过表达lncRNA-KAT7可以通过正向调节miR-10a基因的甲基化,负向调节miR-10a的表达来抑制肺癌细胞的增殖和转移。有研究表明,lncRNA-KAT7在结直肠癌癌组织和细胞内低表达,与pcDNA-3.1组比较,过表达lncRNA-KAT7的HCT116细胞中E-钙黏蛋白(与上皮间质转移相关)的表达水平明显增加,β-连环蛋白(与增殖相关)和MMP-2蛋白(与侵袭相关)的表达水平相对降低,从而推测lncRNA-KAT7可能通过调控EMT途径抑制肿瘤细胞的侵袭和转移[20]。本研究采用Transwell实验进一步验证lncRNA-KAT7与肺癌细胞侵袭迁移的关系,实验结果表明,过表达lncRNA-KAT7可以抑制肺癌A549细胞的迁移和侵袭。然而本研究对lncRNA-KAT7与肺癌的发生发展关系的研究仅处于功能解析的初始阶段,更深层面对lncRNA-KAT7参与的信号通路及其对肺癌具体作用机制的探索,有待后续进一步开展。
综上所述,lncRNA-KAT7在肺癌的发生发展过程中具有调控肿瘤细胞迁移和侵袭能力的作用,并有望成为肺癌分子靶向治疗中的潜在靶点。
