传染性支气管炎病毒山西分离株的分离鉴定及其S1基因分子特征分析
2022-05-26王旭贞谭仕明马海利梁立滨
王旭贞,程 宇,谭仕明,马海利*,梁立滨*
(1.山西省畜牧兽医学校,山西 太原 030024;2.山西农业大学动物医学学院,山西 太谷 030801)
禽传染性支气管炎(Infectious bronchitis,IB)是由IB 病毒(IBV)引起的一种鸡急性、高度传染性疾病。IB 临床表现为产蛋率及产蛋品质下降、上呼吸道症状、肾炎等,对养鸡业的危害较大。该病最早于1931 年在美国北达科他州发现[1],1972 年我国广东地区首次报道该病,目前该病在全世界广泛流行[2-3]。
IBV为冠状病毒科γ-冠状病毒属单股正链RNA病毒,基因组全长约27.6 kb,基因组3'端编码的结构蛋白包括刺突蛋白(S)、包膜蛋白(E)、膜蛋白(M)及核衣壳蛋白(N);编码的非结构蛋白包括3a、3b、5a 和5b 蛋白。其中刺突S 蛋白全长1 145 个氨基酸,在感染的宿主细胞内可以被切割成S1 和S2 两个亚基, S1 蛋白含有病毒特异性中和表位,是病毒的主要免疫原性蛋白,目前研究表明在全病毒基因组中S1 基因的变异率最高,发生在S1 基因的突变及重组事件对于IBV 新的基因型、血清型及突变株的出现起决定性作用[4-5]。目前,基于全长S1 基因的进化分析,IBV 可以分为7 个不同基因型,36 个分支,包括GI-1~GI-29、GII-1、GII-2 及GIII-1~GVII-1[6-8]。IB 的防控主要依赖于疫苗的应用(包括减毒苗及灭活苗),但由于IBV 极易发生变异及重组产生抗原变异株,从而常引起疫苗免疫失败。
2021 年5 月山西省晋中市某肉鸡养殖场22 日龄肉鸡突然大量发病,肉鸡采食量降低、咳嗽、甩头、弓背扎堆并排白色水样稀粪,发生疑似鸡IB 疫情,本研究采集发病鸡气管、肺脏及肾脏等病料样品接种SPF 鸡胚进行病毒的分离与鉴定,并对其S1基因序列进行测序与分析,以期为本地区IBV 疫苗选择及IB 疫情防控提供科学依据。
1 材料与方法
1.1 主要实验材料 疑似感染IBV 鸡的气管、肺脏、肾脏等脏器样品采集自山西省晋中市某肉鸡场。SPF 鸡胚购自北京勃林格殷格翰维通生物技术(北京)有限公司。病毒RNA 提取试剂盒购自天根生化科技有限公司;ReverTra Ace®qPCR RT Kit 购自东洋纺(上海)生物科技有限公司;2×RapidTaqMaster Mix 购自南京诺唯赞生物科技股份有限公司;核酸纯化及胶回收试剂盒购自Axygen 公司;DL 2000 DNA Marker 购自TaKaRa 有限公司。
1.2 病鸡剖检观察与病毒分离 将发病鸡及死亡鸡剖检,观察各器官病变情况。将采集的发病鸡气管、肺脏及肾脏加入无菌PBS 研磨,将研磨液4 ℃,8 000 r/min 离心10 min 后的上清用0.22 μm 滤器过滤除菌,以0.2 mL/枚接种SPF 鸡胚尿囊腔,每个脏器研磨液接种3 枚SPF 胚。接种后的鸡胚于37 ℃孵育,弃去24 h 内死亡的鸡胚,无菌收取72 h 死亡鸡胚的尿囊液进行后续鉴定。
1.3 禽呼吸道病毒RT-PCR 鉴定及血凝试验 利用病毒RNA 提取试剂盒提取1.2 中尿囊液RNA,反转录制备cDNA 并作为模板,采用文献[9]中RT-PCR 方法鉴定几种常见禽呼吸道病毒,包括禽流感病毒(AIV)、新城疫病毒(NDV)及IBV。同时将收集的尿囊液在SPF 鸡胚上传代。以常规方法制备1% 的SPF鸡外周血红细胞,将收集的鸡胚尿囊液进行血凝试验(HA),检测尿囊液中是否含有可以凝集鸡红细胞的病原微生物。
1.4 分离病毒S1 基因的PCR 扩增及序列分析 以1.3 中IBV 鉴 定 阳 性 尿 囊 液 制 备 的cDNA 为 模 板,参考文献[10]中并优化PCR 方法扩增S1 基因,回收扩增片段由上海生工工程技术服务生物有限公司测序。自GenBank 中选取不同基因型IBV 70 株参考毒株,包括GI-1 至GI-29 基因型、GII-1、GIII-1、GIV-1、GV-1 及GVI-1 等基因型,及目前应用的H120、4/91、M41、H52、LDT-3A等疫苗株,首先利用MAFFT 程序进行多重序列比对,进而利用Mega-X软件Maximun Likelihood 方法中的Tamura-Nei model 进行遗传演化分析;将分离株S1 基因序列与常用疫苗株S1 基因序列利用DNAStar 软件中MegAlign 程序进行氨基酸序列比对及同源性分析;将全长S1 基因利用RDP4 软件进行重组分析,检测S1 基因是否存在重组。
2 结果与讨论
2.1 发病商品肉鸡剖检变化 在此次疑似暴发IB 疫情的肉鸡场,随机剖检不同饲养区的10 只鸡(5 只病死鸡、5 只发病鸡),发现主要组织病变损伤位于气管和肾脏,可见气管、支气管内有卡他性分泌物,并且气管黏膜充血,肾脏肿大且小叶突出,符合近年流行的肾型IB 临床病理特征。
感染的IBV 病毒株不同,侵害的器官不同,包括侵害呼吸道(引起咳嗽、气管啰音等)、消化道(引起腺胃病变)、泌尿生殖道(引起肾脏肿大、产蛋率下降)等,从而引起不同的临床症状[9-10]。其中肾型IB可以引起鸡咳嗽、肾脏尿酸盐沉积(“花斑肾”)、产蛋鸡产蛋下降,近年来流行较广。
2.2 禽呼吸道相关病毒RT-PCR 鉴定及血凝试验为了快速鉴定本次疫情的病原,将采集的气管、肺脏、肾脏组织样品接种鸡胚后提取尿囊液RNA,利用RT-PCR 方法鉴定结果显示,除检测到IBV N 基因目的条带(386 bp)外,AIV 及NDV 扩增结果均为阴性(图1);进一步将上述尿囊液进行血凝试验,结果显示所收集的尿囊液均不能凝集红细胞,进一步排除了NDV、AIV等具有凝血活性的病原。
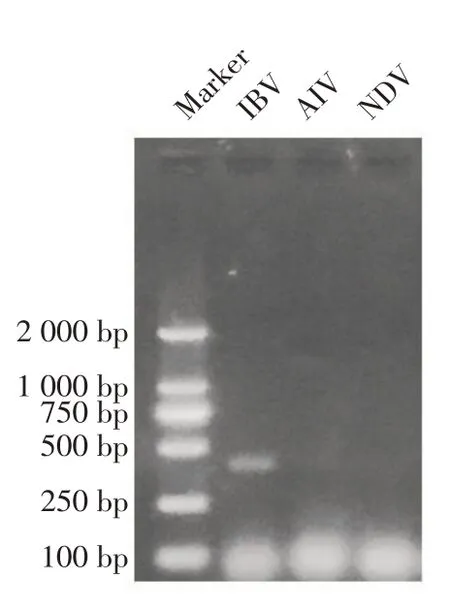
图1 禽呼吸道疾病相关病原RT-PCR鉴定Fig.1 Identification of potential causative agent of avian severe respiratory disease by RT-PCR
呼吸道病是目前养禽业临床上常见的一种疾病,对养禽业危害严重。多种病原可以引起鸡的呼吸道症状,包括AIV、NDV、IBV 及支原体等,快速鉴定引起呼吸道疾病的病原对疫病的迅速防控具有重要意义,目前临床上广泛应用PCR方法对禽呼吸道疾病的快速诊断[7,10],其具有快速、准确、灵敏等优点。
2.3 分离株全长S1 基因扩增及遗传演化分析 将鉴定为IBV阳性的样品RNA反转录后为模板,利用S1基因全长引物进行PCR扩增,结果显示扩增出预期大小的全长S1 基因片段(图2)。测序分析结果进一步证实本研究分离到的病原为IBV,命名为CK/Shanxi-01/2021株。
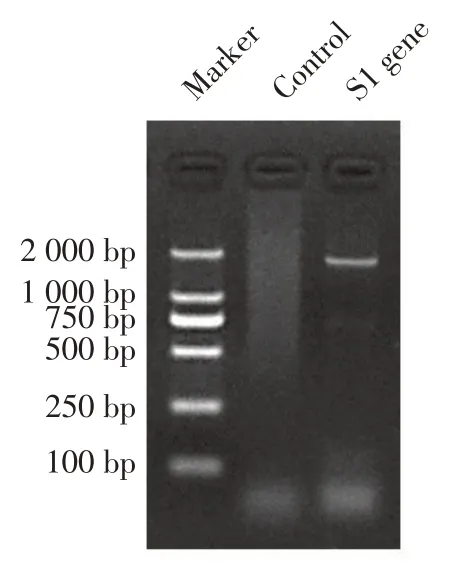
图2 分离病毒全长S1基因的PCR扩增Fig.2 Amplification of full-length S1 gene by PCR
为了进一步研究所分离IBV 的遗传进化关系,将CK/Shanxi-01/2021株和其他基因型代表性株的全长S1基因序列比对及遗传演化分析。Blast 分析结果显示CK/Shanxi-01/2021 与2011 年分离自鸡的一株ck/CH/LHB/111190的同源性最近,为98.97%;序列比对发现分离株与GI-19基因型中LX4及QX两株代表株的同源性分别为95.8%及96.1%;而与目前国内市售疫苗株H120 的 同 源 性 仅 为78.1%, 与 疫 苗 株4/91 同 源 性 为78.7%,与疫苗株LDT3-A 同源性为85.2%。为了系统研究分离株的进化关系及分支类型,参考已发表文献的基因分型[6-7,11],利用MAFFT 软件进行多重比对,并进行遗传演化分析,构建系统进化树,结果显示,分离株CK/Shanxi-01/2021 与LX4 及QX 株 等IBV 毒株 亲缘关系较近,且均为GI-19 基因型(图3),而与H120、M41、H52、LDT-3A等市售疫苗株亲缘关系较远。将分离株S1 基因与不同基因型代表株序列利用RDP4软件进行重组分析,未发现显著重组现象。

图3 2021年山西IBV分离株全长S1基因与不同基因型参考株相应基因序列的遗传进化分析Fig.3 Phylogenetic analysis of full-length S1 gene of Shanxi/2021 IBV isolate and reference strains from different genotypes
多篇文献报道GI-19基因型(QX-like株)逐渐成为我国目前IBV 流行的主要基因型之一,其他基因型如GI-7(TW-like)、GI-13(4/91-like)及GI-22(YN-like)也经常被分离到[7-8,12-14]。可见在我国流行的IBV株具有基因多样性,多种不同基因型同时流行以及目前IBV弱毒疫苗株的普遍应用,进一步增加了不同IBV 之间发生重组的可能性。这也可能是近年来IB的防控难度加大,导致IB疫情不断出现的原因。
2.4 分离病毒S1 基因高变区(HVR)氨基酸多态性分析 由于IBV 本身基因组特点,在流行过程中极易发生突变或与其他病毒株发生重组产生变异株,从而导致发生新的疫情。其中S1 基因的高变异区突变率较高[7,10,15],为了进一步分析IBV 分离株CK/Shanxi-01/2021 的分子特征,本研究对其S1 蛋白氨基酸多态性进行了分析,结果显示,该分离株S1 蛋白HVR 区存在多个氨基酸突变,其与原来经典GI-19 基因型病毒株氨基酸序列相比,在高变异区存在V68I、S120A、A271T、N282T、N291S 等突变。
将该分离株S1 基因与目前国内市售IBV 疫苗株H120、4/91、M41、H52 及LDT3-A 株序列比对分析发现,山西分离株S1 基因与IBV 常用疫苗株S1 基因的核苷酸序列同源性为78.1%~85.2%,氨基酸序列的同源性仅为75.2%~78.4%,S1 蛋白已经发生明显变异。与H120 疫苗株相比,分离株S1 蛋白发生S54T、S57T、V68I、H120A、T157R 等突变,这些突变位于S1 蛋白主要受体结合区[16]。该发病肉鸡场中尽管已经免疫H120 疫苗,依然发生IB 疫情,推测是由于流行株抗原变异,而疫苗株免疫保护力不够所致。因此,为有效防控IB 疫情,必须进一步加强IBV 流行病学监测工作,及早发现IBV 变异株,为科学合理防控策略的制定提供参考依据。
