非洲猪瘟病毒抗体时间分辨免疫荧光方法的建立及初步应用
2022-05-26陈翠翠钟树海赖宏锐梁焕坤郭桂玲李来庆
陈翠翠,钟树海,赖宏锐,梁焕坤,郭桂玲,李来庆
(广州优迪生物科技股份有限公司,广东 广州 510663)
非洲猪瘟(Infection with African swine fever virus,ASF)是由ASF 病毒(ASFV)引起猪的一种高度接触性传染病,所有品种和年龄的家猪和野猪均易感,临床表现为皮肤发绀、发热、淋巴结、肾及胃肠黏膜出血等[1]。ASF 发病过程短,死亡率高达100%,对养猪业造成巨大危害[2]。ASF 首先暴发于非洲大陆,并逐渐向欧洲、亚洲等国家蔓延。由于该病毒特殊的免疫逃避机制,目前尚无有效治疗手段和商品化疫苗[3-4],我国农业农村部将其定为一类疫病,世界动物卫生组织(OIE)将其列为必须通报动物疫病[5]。及时准确发现ASF 疫情,采用严格的生物安全措施,防止疫情蔓延,是防控ASF 疫情的主要措施。因此,建立一种高效灵敏、简便快捷的ASF 检测技术具有重要的现实意义。
ASFV 基因组庞大,有150 多个主要开放阅读框,可编码约200 种蛋白。作为ASFV 的主要结构蛋白,P54 蛋白由ASFV El83L 编码,最早出现在病毒复制早期,是血清抗体的主要结合位点,具有良好的免疫原性,在ASFV 进入机体后可产生针对该蛋白的特异性抗体[6]。以P54 蛋白为检测抗原对欧洲和西非类型ASFV 的检测方法具有高度敏感性和特异性[7]。
时间分辨荧光免疫法(Time-resolved fluorescence immunoassay,TRFIA)是一种建立在免疫吸附分离和时间分辨荧光技术基础上的超灵敏检测方法,具有高精度、自动化大样本快速测定(1 h~2 h 就能出结果)等优点,其敏感性和准确性明显高于ELISA 方法,特异性又明显高于常规PCR[8]。TRFIA 发展迅速,已广泛应用于临床疫病、食品安全快速检测等领域[9]。目前,尚无ASFV 抗体检测的TRFIA 的报道。基于此,本实验利用ASFV 重组P54 蛋白(rP54)作为包被原、Eu3+标记的rP54 抗原作为检测抗原,建立一种ASFV 抗体的双抗原夹心TRFIA,为ASF 的快速、精准检测提供新的技术手段。
1 材料与方法
1.1 主要实验材料 ASFV rP54(原核表达)及其单克隆抗体(MAb)由广州优迪生物科技股份有限公司制备。96 孔板购自Costar 公司;铕(Eu3+)标记试剂盒和Victor 1420 全自动TRFIA 检测仪购自PerkinEl⁃mer 公司;Sephades-G50 填料购自GE 公司;包被缓冲液、洗涤液、封闭液、分析缓冲液、增强液均为广州优迪生物科技股份有限公司制备。23 份疑似ASF 患病猪的口鼻咽拭子/血清,100 份健康猪ASFV阴性口鼻咽拭子/血清样品、猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)、猪呼吸道冠状病毒(Porcine respiratory coronavirus,PRCV)和猪凝血性脑脊髓炎病毒(Porcine hemagglutinating en⁃cephalomyelitis virus,PHEV)阳性猪血清均由华南农业大学提供。
1.2 抗原的制备
1.2.1 固相包被抗原的制备 利用50 mmol/L、pH 9.6 的 包 被 缓 冲 液 将rP54 分 别 稀 释 为2 μg/mL、4 μg/mL 和8 μg/mL,加入96 孔板中包被,利用方阵法优化包被浓度。4 ℃包被过夜,弃包被液,加入200 μL 封闭液(5% BSA 的PBS 溶液,pH7.4),37 ℃封闭2 h,弃封闭液,PBST 洗涤2 次,于-20 ℃封闭保存备用。
1.2.2 Eu3+标记抗原的制备 将1 mg rP54 加到带有滤膜的离心管中,以8 000 r/min 离心5 min,标记缓冲液洗涤5 次。利用方阵法优化Eu3+标记试剂与rP54 的标记比例,即1 mg rP54 中分别加入100 μL、125 μL、150 μL、200 μL 的Eu3+标记试剂。分别充分混匀后,25 ℃振荡过夜。标记完成后加入到Sep⁃hadex G-50 层析柱中纯化,用含9 g/L NaCl 的50 mmol/L Tris-HCl 的洗脱液洗脱。收集流出液保存备用。
1.3 TRFIA 各反应条件的优化 向已包被rP54 的96孔酶联板中依次加入不同体积(20 μL、30 μL、40 μL 和50 μL)的标准品或待测样品,再加入200 μL分析缓冲液,室温振动孵育1 h,洗涤4 次后,加入不同体积(100 μL、150 μL、200 μL、250 μL)Eu3+标记的rP54,室温孵育30 min。洗涤液洗涤6 次后每孔加入不同体积(150 μL、200 μL、250 μL)增强液,振摇5 min 后,在Victor 1420 荧光检测仪上检测荧光值。采用方阵法分别优化待测样品体积、Eu3+标记抗原及增强液加入量。
1.4 标准曲线的绘制 将本公司制备并纯化的ASFV rP54 MAb 分别配制成浓度为0、0.1 ng/mL、1 ng/mL、10 ng/mL、100 ng/mL、500 ng/mL、1 000 ng/mL 的系列标准品溶液。每个浓度测定3 个复孔,共测定3次,利用双对数数学模型(Log-Logit)进行标准曲线的拟合得出标准曲线方程。
1.5 cut off 值的确定 利用该TRFIA 检测100 份健康猪血清样品中的ASFV 抗体浓度。利用SPSS 17.0软件进行数据统计分析。结果属于正态分布的,用正态分布法计算参考区间范围,其95%参考区间范围分别用下式计算:cut off=+1.96s。
1.6 特异性试验 利用本研究建立的TRFIA 同时检测ASFV rP54 MAb 标 准 品(100 ng/mL)、 TGEV、PRCV 和PHEV 阳性猪血清,评估该方法的特异性。
1.7 敏感性试验 利用本研究建立的TRFIA 检测不含ASFV MAb 标准品的溶液,重复检测10 次。以不含ASFV MAb 标准品的溶液为检测对象,将测定的10 次荧光值平均值加上2 倍的标准差代入标准曲线方程,计算TRFIA 的敏感性。
1.8 重复性试验 将已知浓度的ASFV rP54 MAb 标准品加入到不含ASFV 抗体的健康猪血清中,制备成高、中、低3 个浓度(浓度分别为10 ng/mL、100 ng/mL、500 ng/mL)。同一时间点重复检测10次高、中、低浓度样品,计算平均数(-x)、标准差(s)、回收率(测定浓度/加入浓度×100)及变异系数(CV),评价该方法批内重复性。在3 个不同时间点重复检测10 次上述高、中、低浓度样品,获得平均数、标准差、回收率及CV,评价该方法批间重复性。
1.9 稳定性试验 制备TRFIA 试剂盒并置于37 ℃7 d 后,对试剂盒的物理外观,剂量-反应曲线的线性、敏感性、准确性、特异性等指标进行测定,具体检测方法同上,检测试剂盒的稳定性。
1.10 临床样品的检测 采集23 份疑似ASF 患病猪、20 份健康猪口鼻咽拭子/血清样品,采用本研究建立的TRFIA(检测血清样品)、PCR[10](检测口鼻咽拭子)和ELISA 方法[11](检测血清样品)分别检测,对结果进行配对卡方检验(McNemar test)和一致性检验(Kappa test),以评估该TRFIA 的临床检测效果。
1.11 统计学分析 采用SPSS 17.0 统计软件分析实验数据,结果以±s表示,利用GraphPad Prism 5 软件绘制标准曲线并拟合得到标准曲线方程。
2 结 果
2.1 TRFIA 反应条件的优化结果 对包被浓度、Eu3+标记试剂使用量、反应体系的体积等条件进行优化,确定了TRFIA 最佳反应条件为:rP54 包被浓度为4 μg/mL,100 μL/孔;使用150 μL Eu3+标记试剂标记1 mg rP54;反应体系为30 μL 标准品或待测样品+ 200 μL/孔Eu3+标记抗原+ 200 μL/孔增强液。
2.2 标准曲线的绘制 以不同浓度ASFV rP54 MAb的标准品为横坐标,其对应的荧光值为纵坐标,利用双对数数学模型(Log-Logit)进行标准曲线的拟合后得到的标准曲线(图1),方程为:Y=0.2875x+3.1517,MAb 线 性 范 围 为0.1 ng/mL~1 000 ng/mL,R2=0.9930,表明该检测方法具有良好的剂量-反应效应。
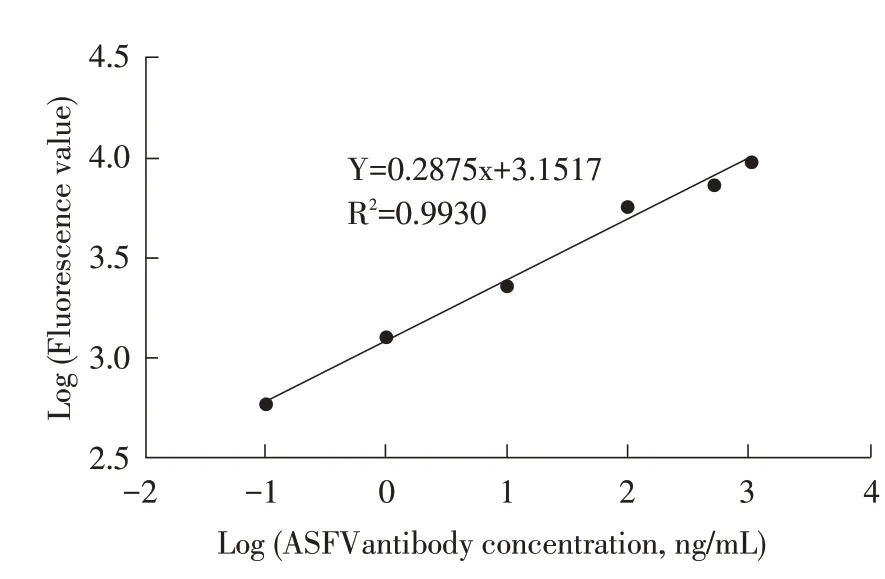
图1 TRFIA的标准曲线Fig.1 Standard curve of TRFIA for detection of ASFV antibodies
2.3 cut-off 值的确定 将100 份健康猪血清样品经该TRFIA 检测,经标准曲线方程计算得到的抗体浓度使用SPSS 19.0 进行正态性检验,结果显示,抗体浓度呈正态分布(图2),因此采用95%参考区间范围 计 算cut off 值(cut off=+1.96s)。100 份 健 康 猪ASFV 抗体平均浓度为1.95 ng/mL,s为0.29,计算得到cut off 值为2.52 ng/mL。即检测样品的抗体浓度值大于2.52 ng/mL 时,为ASFV 阳性样品;抗体浓度值小于2.52 ng/mL 时,为ASFV 阴性样品。

图2 100份健康猪血清ASFV抗体浓度正态分布图Fig.2 Normal distribution(Bell Curve)of antibodies against ASFV in 100 serum samples of healthy pigs
2.4 特异性试验结果 利用本研究制备的TRFIA 检测100 ng/mL ASFV MAb 标准品的浓度为98.93 ng/mL,为阳性;而同步检测TGEV、PRC 和PHEV 阳性猪血清,经计算抗体浓度分别为1.26 ng/mL、2.02 ng/mL、1.95 ng/mL,均为阴性,该方法与这些相关病毒抗体均无明显交叉反应,表明该方法特异性较强。
2.5 敏感性试验结果 平行测定10 次不含MAb 的标准品的荧光值,并计算其及s值,用+2s代入标准曲线方程,计算得出该TRFIA 的检测下限为0.067 ng/mL,表明该方法敏感性较高。
2.6 重复性试验结果 重复性试验结果显示,高、中、低3个浓度ASFV rP54 MAb标准品批内重复性试验的 回 收 率 在95.80%~105.62%,批 内CV 在3.11%~8.77%;3 个浓度ASFV rP54 MAb 标准品批间重复性试验的回收率在92.50%~108.97%,批间CV在4.28%~10.59%。批内变异系数小于10%,批间变异系数小于15%(表1)。表明该TRFIA 的重复性较好。

表1 TRFIA的重复性试验结果Table 1 The accuracy and repeatability of TRFIA kit
2.7 稳定性试验结果 将本研究制备的ASFV 抗体TRFIA 试剂盒置于37 ℃7 d,进行加速热稳定性试验。结果显示,37 ℃保存7 d,ASFV MAb 标准品的各点荧光值并未随着条件的改变而发生明显变化,试剂盒的检测性能也无明显改变。表明该TRFIA 试剂盒稳定性较好。
2.8 临床样品的检测结果 利用本研究制备的AS⁃FV 抗体TRFIA 与PCR 法、ELISA 法同时检测23 份疑似患病猪和20 只健康猪的口鼻咽拭子/血清样品。检测结果显示,TRFIA 和PCR 法同时检测出4 份AS⁃FV 阳性样品,其余均为阴性样品,两种检测方法的检测结果一一对应、完全一致。ELISA 法检测出2只健康猪血清样品为阳性,其余样品检测结果与PCR 法一一对应、完全一致。利用SPSS 软件进行TRFIA 与PCR 法的配对卡方检验(McNemar test)的P值为1.00,一致性检验(Kappa test)的Kappa 值为1.00,提示这两种方法检测结果的一致性较高(符合率100%),且准确性均高于ELISA 法(表2)。表明,本研究建立的TRFIA 准确性较好,可用于猪临床样品的检测。

表2 3种方法对临床样品的检测结果Table 2 McNemar test results of the TRFIA,PCR and ELISA
3 讨 论
ASFV 自1921 年首次在肯尼亚发现后已蔓延至全球,中国于2018 年8 月首次发现该病[12]。我国作为一个养猪大国,近年来ASF 频繁暴发,给我国的养猪业带来了严重危害。目前,ASF 诊断技术的国家标准已于2020 年12 月14 日发布并实施,主要有分子生物学检测法、荧光免疫分析法、ELISA 抗原和抗体检测法等[13]。针对ASFV 的特点,研制出特异性强、敏感性高的检测新方法对于预防ASF 的传播至关重要。基于P54 蛋白的结构特点和重要作用,我国研究者已利用P54 蛋白建立了ASFV 抗体检测方法,敏感性为200 ng/mL,且与猪其他病毒阳性血清无交叉反应,特异性较强,可用于ASFV 感染动物血清抗体的监测[14-15]。
然而,目前对ASFV 抗原、抗体的检测方法均为定性检测[14-18],仅可确定是否感染ASFV,对于感染程度、机体免疫反应情况等均无法判断。本研究利用rP54 包被酶联板、Eu3+标记rP54 抗原,建立了一种既可定性又可定量检测ASFV 抗体的新方法。该方法对ASFV 抗体检测的敏感性为0.067 ng/mL,cut off 值为2.52 ng/mL,可同时实现ASFV 抗体的定量和定性分析,弥补了现有ELISA 法只能定性检测的缺陷。对不同浓度ASFV P54 MAb 标准品的批内和批间回收率在92.50%~108.97%,批内和批间CV均小于15%,达到临床检测对准确性和重复性的要求,可用于临床样品的检测;临床样品比较检测中,该TRFIA 与传统的PCR 法检测结果的一致性较高(符合率100%),准确性高于存在假阳性结果的ELISA 法,表明该方法检测结果准确性较高,可替代传统的PCR 法和ELISA 法。
TRFIA 作为一种超微量检测方法,具有定量、准确、特异性强、敏感性高等优点,不仅可为ASF的快速、精准检测提供一种新的技术手段,也为其他动物类病毒传染病的检测发挥重要作用[19-20]。
