免疫组织化学检测p63、α-SMA对乳腺癌的临床诊断价值
2022-05-26邸静,王力
邸 静,王 力
商洛国际医学中心医院病理科,陕西商洛 726000
乳腺癌是女性常见的妇科肿瘤之一,在过去的50年乳腺癌的发病率逐年升高,已占据女性恶性肿瘤发病率的31%,死亡率排列第三,仅次于胃癌及肺癌,已经严重威胁患者生命安全[1]。在乳腺癌的早期诊断中,病理学证据具有关键作用。乳腺导管是乳房重要组织成分之一,肌上皮细胞主要分布在乳腺导管外层,与肌细胞作用相似,具有收缩潜能。α-平滑肌肌动蛋白(α-SMA)由377个氨基酸残基组成,是细胞中6种肌动蛋白之一,也是肌上皮细胞中表达的一种细胞骨架蛋白。肌上皮细胞在乳腺良性病变中可以被检测到,但是当发生乳腺恶性上皮病变时几乎找不到肌上皮细胞,因此肌上皮细胞是否存在是区别乳腺良性病变和恶性病变的重要依据[2]。a-SMA属于肌纤维母细胞的标志蛋白,能够参与细胞增殖、迁移等运动。肌纤维母细胞是肿瘤间质的重要组成部分,可参与乳腺癌疾病的发生、发展。p63基因是1997年被发现的一种新基因,因与p53具有较强的同源性而被认为是p53家族的新成员。p63蛋白可激活p53相关基因而诱发细胞凋亡,故被称为肿瘤抑制基因[3]。相关研究显示,病理学标志物能够明显提高乳腺癌疾病诊断效能,其表达水平在一定程度上对患者预后有较高的预测价值[4]。本研究收集2017年1月至2019年5月在本院行乳腺癌根治术的80例患者肿瘤组织及癌旁组织,观察p63、SMA表达对乳腺癌诊断及预后的影响,以期为乳腺癌病理诊断提供新的指标。
1 资料与方法
1.1一般资料 80例乳腺癌组织及癌旁组织标本均来自2017年1月至2019年5月在本院行乳腺癌根治术的患者。所有组织标本经10%的甲醛固定包埋处理。所有患者均为女性,术前均未进行化疗,平均年龄(56.42±11.23)岁,均为单侧癌。组织病理学检查显示:浸润性导管癌68例,黏液腺癌7例,乳腺导管原位癌(DCIS) 3例,实性乳头状癌2例;组织学分级Ⅰ级36例,Ⅱ级44例;有淋巴结转移28例,无淋巴结转移52例。纳入标准:(1)接受手术治疗的原发性乳腺癌;(2)非双侧病灶;(3)初次手术;(4)可进行随访。排出标准:(1)继发性乳腺癌患者;(2)非单侧病灶患者;(3)放化疗及免疫治疗者;(5)无法进行随访者;(6)临床资料不齐全者;(7)参与其他临床项目研究者。本研究已经获得患者同意,签署知情同意书,并经本院伦理委员会批准同意。
1.2主要试剂 小鼠抗人p63单克隆抗体购自美国Santa Cruz公司,α-SMA抗体购自圣克鲁斯生物技术(上海)有限公司,SP9002免疫组织化学(免疫组化)试剂购自中国上海鼎杰生物技术有限公司。
1.3方法
1.3.1免疫组化检测 将乳腺癌组织及癌旁组织剪切成小块,脱水、包埋后,采用10%甲醛固定,水化后,37.5 ℃静置0.5 h后,加入1%的乙二胺四乙酸(EDTA)溶液,山羊血清封闭。加入1抗(1∶500),加入α-SMA及p63抗体,加入二抗0.5 h后,复染,封闭。选择不交叉的10个视野,以淡黄色至棕褐色为阳性,计算阳性率。判断标准:苏木精-伊红(HE)染色,染色结果经过本科室2位高年资医师复诊,参考世界卫生组织(WHO)乳腺癌分类形态学(2019年第5版)[5]判定。免疫组化结果判断参考表1。
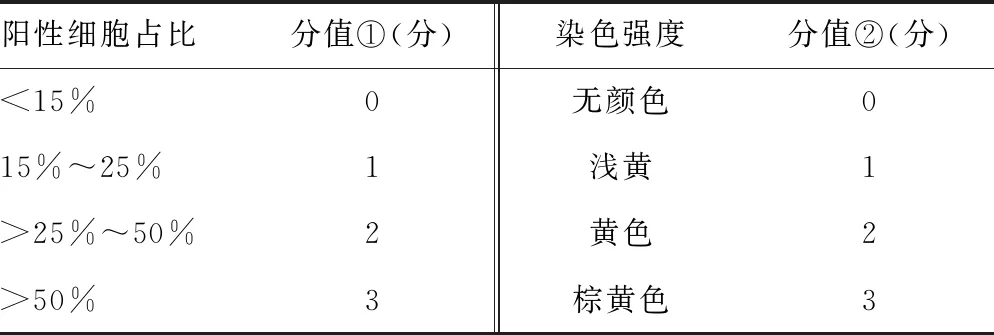
表1 免疫组化判断标准
1.3.2随访 对80例患者进行2年时间的随访,随访方式为电话随访及门诊复查,随访截止日期为2021年5月31日,观察患者2年生存率。
1.4统计学处理 采用SPSS23.0软件进行数据分析,计数资料以n(%)表示,采用χ2检验或Fisher确切概率法,采用Log-rank检验比较生存率,采用受试者工作特征(ROC)曲线分析诊断价值。以P<0.05为差异有统计学意义。
2 结 果
2.1两组患者乳腺癌组织及癌旁组织p63、α-SMA阳性表达情况 免疫组化结果显示,p63、α-SMA阳性表达呈棕黄色颗粒,乳腺癌组织p63阳性表达率低于癌旁组织,α-SMA阳性表达率高于癌旁组织,差异均有统计学意义(P<0.05)。见表2及图1。
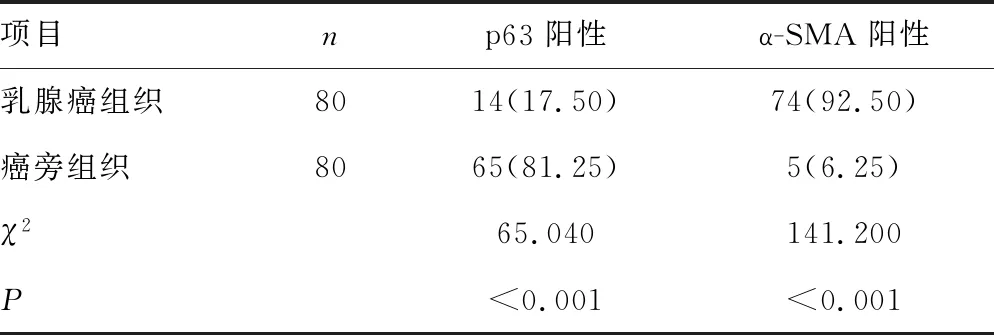
表2 乳腺癌组织及癌旁组织p63及α-SMA阳性表达率比较[n(%)]
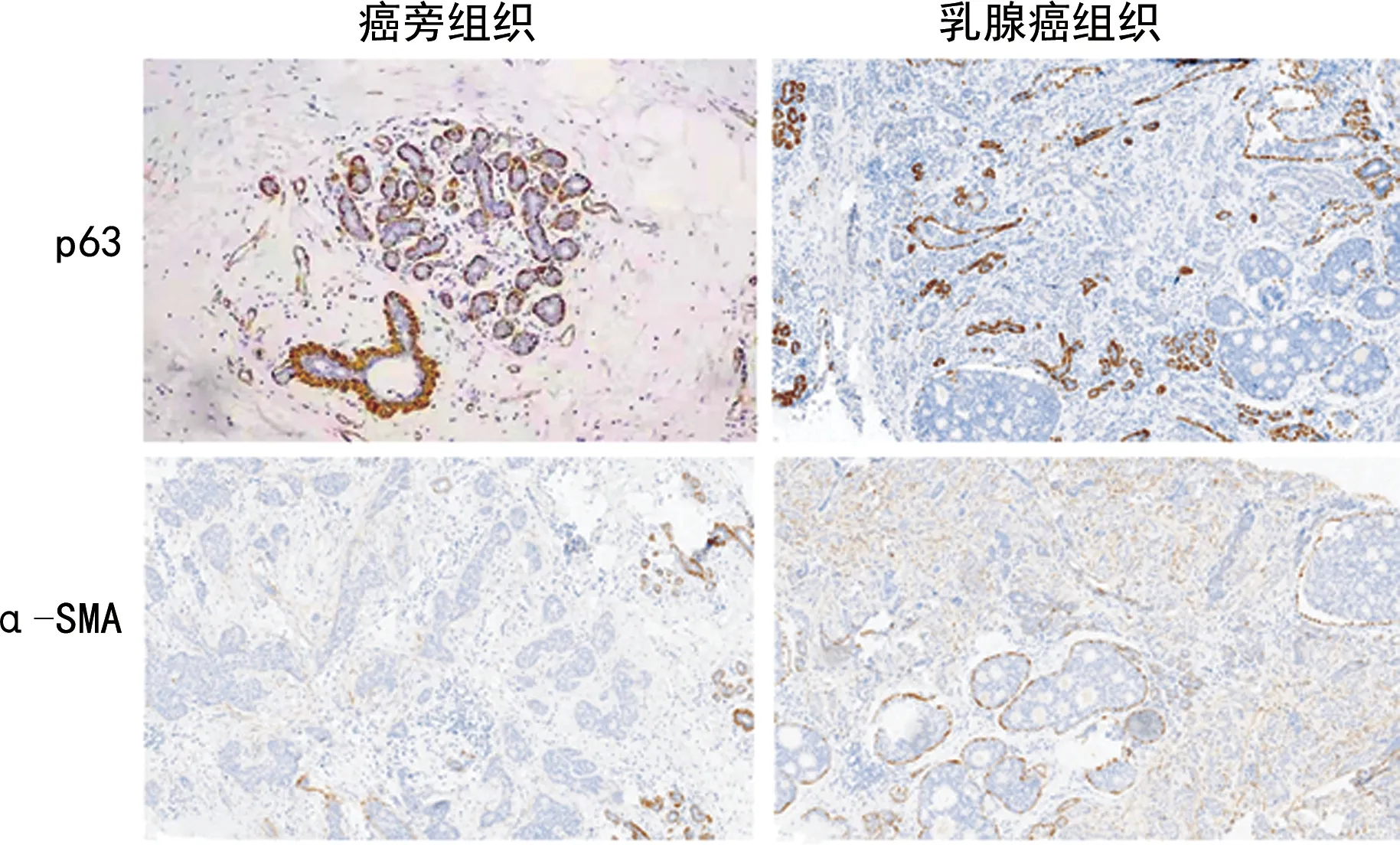
图1 乳腺癌组织及癌旁组织中p63及α-SMA阳性表达情况(×200)
2.2不同临床特征乳腺癌患者p63及α-SMA阳性情况比较 不同年龄、肿瘤大小、TNM分期及组织学类型乳腺癌患者p63及α-SMA阳性表达率比较,差异无统计学意义(P>0.05),有淋巴结转移与无淋巴结转移乳腺癌患者p63及α-SMA阳性表达率比较,差异有统计学意义(P<0.05)。见表3。
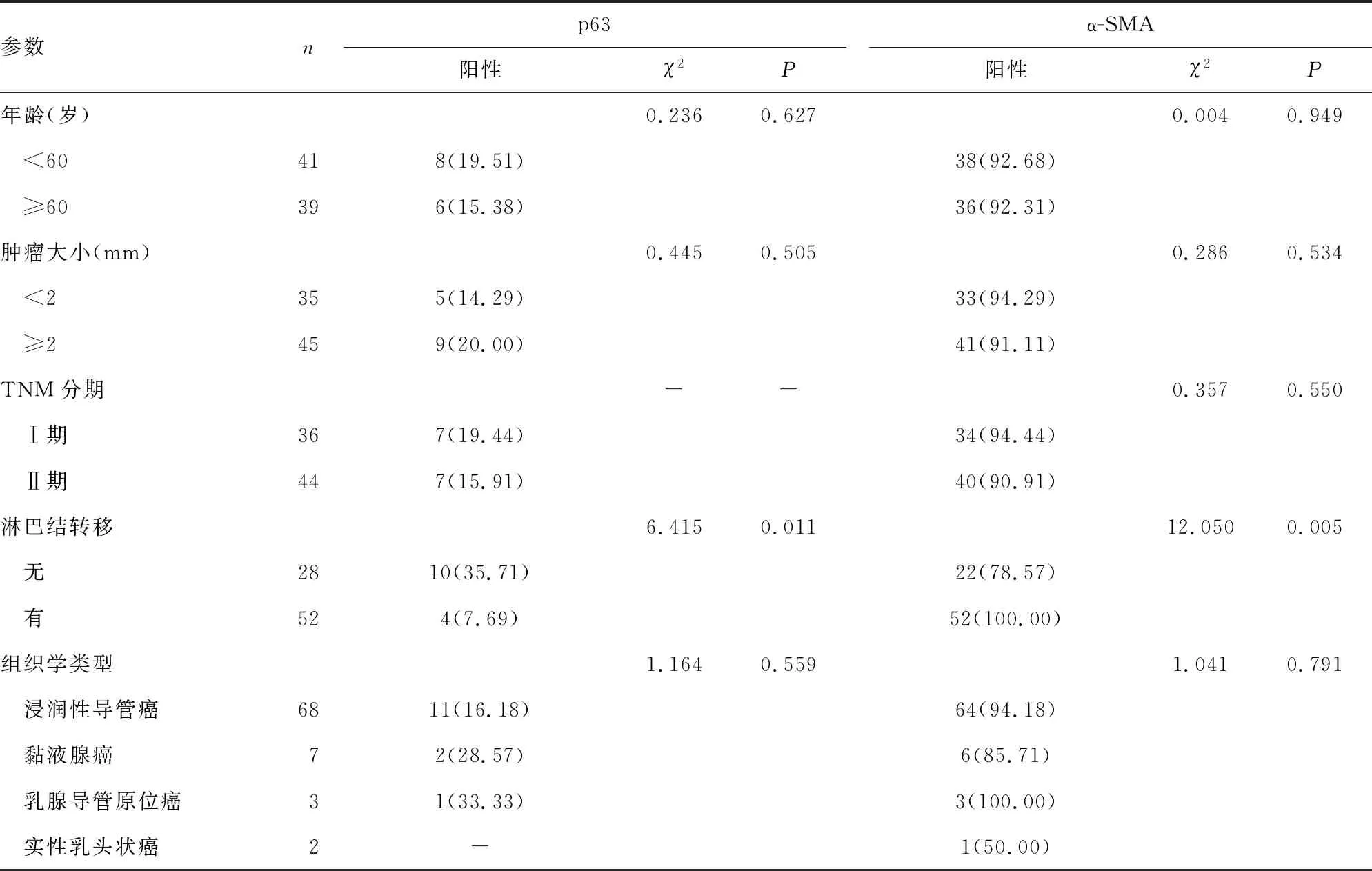
表3 不同临床特征乳腺癌患者p63及α-SMA阳性情况比较[n(%)]
2.3乳腺癌患者预后分析 80例乳腺癌患者2年生存率为59例(73.75%),p63阳性患者2年生存人数为13例,存活率为92.85%(13/14),p63阴性患者2年生存人数为46例,生存率为69.70%(46/66),Log-rank检验显示,p63阳性与阴性患者生存率比较,差异有统计学意义(P<0.05);α-SMA阳性患者2年生存人数为54例,生存率为72.97%(54/74),α-SMA阴性患者生存人数为5例,生存率为83.33%(5/6),Log-rank检验α-SMA阳性与阴性患者生存率比较,差异无统计学意义(P>0.05)。见图2。
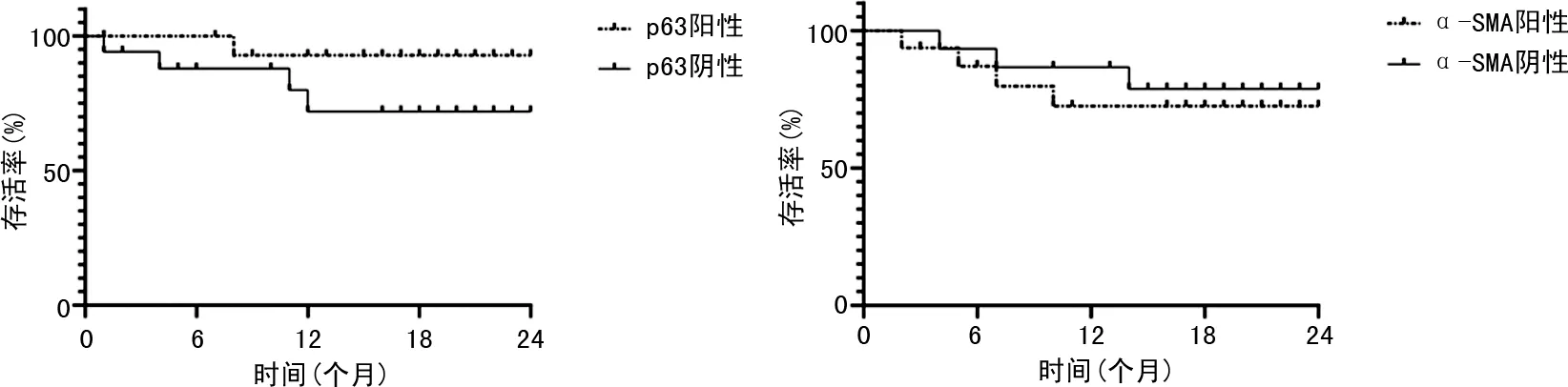
图2 预后分析
2.4p63及α-SMA对乳腺癌的诊断价值 p63检测乳腺癌的AUC为0.778(95%CI:0.683~0.871),灵敏度为78.54%,特异度为75.16%;α-SMA检测AUC为0.731(95%CI:0.622~0.838),灵敏度为76.30%,特异度为70.82%;p63联合α-SMA检测AUC为0.872(95%CI:0.794~0.951),灵敏度为82.46%,特异度为78.17%。p63、α-SMA及二者联合检测对乳腺癌诊断均有一定价值。见图3。
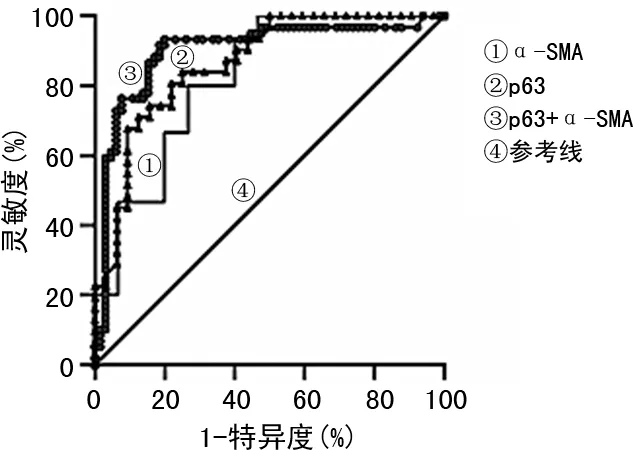
图3 p63、α-SMA及联合检测对乳腺癌的诊断价值
3 讨 论
因乳腺癌早期无明显症状,故多数患者确诊时已经为中晚期,严重影响患者生存预后,因此早期诊断对提高乳腺癌患者预后具有重要意义[5]。本研究结果显示,p63在乳腺癌组织中的阳性表达低于癌旁组织,α-SMA在乳腺癌组织中阳性表达高于癌旁组织,p63及α-SMA表达阳性水平与患者淋巴结转移相关,与患者年龄、肿瘤大小、TNM分期及病理组织类型均无相关性,说明p63及α-SMA表达水平参与乳腺癌的发生、发展。
p63属于p53家族成员之一,主要在正常乳腺肌上皮细胞核中特异性表达。近年研究发现,p63能够应用于乳腺癌的诊断,效果较理想[6]。侍朋举等[7]研究显示,p63在正常肌组织及乳腺良性疾病中的肌上皮细胞中呈阳性表达,而p63在乳腺癌中呈阴性表达,提示肌上皮细胞较少甚至消失。苗洋洋等[8]研究发现,在乳腺癌患者中p63几乎无表达,但是在无淋巴结转移的乳腺癌患者癌组织中p63的阳性表达率高于有淋巴结转移乳腺癌患者,说明p63缺失与乳腺癌发展及转移有关。α-SMA是肌上皮细胞中表达的一种细胞骨架蛋白,具有较高的平滑肌特异性,可作为良性肿瘤与恶性肿瘤鉴别的指标。有研究显示,正常乳腺细胞α-SMA表达较少甚至无表达,在乳腺癌组织中α-SMA呈强阳性表达,说明其活性升高能够促进乳腺癌发生、发展[9]。张哲珺等[10]研究显示,肌成纤维细胞能够分泌大量胰岛素生长因子及α-SMA,从而加快乳腺癌细胞淋巴结转移,增加乳腺癌患者复发风险,预后较差。
p63及α-SMA均对肌上皮细胞检测具有较高的灵敏度,可以用于乳腺癌临床诊断。但是相关研究证实,乳腺癌患者采用单一p63或单一α-SMA进行检测的检出率一般,尤其是对乳腺癌上皮细胞增生活跃时,诊断难度加大,在同一标本组织采用免疫组化检测p63及α-SMA,能够更好鉴别乳腺良恶性疾病,避免误诊或漏诊[11-12]。
本研究结果显示,p63阳性与阴性患者生存率比较,差异有统计学意义(P<0.05),而α-SMA阳性与阴性患者生存率比较,差异无统计学意义(P>0.05),p63、α-SMA及二者联合检测对乳腺癌诊断均有一定价值。α-SMA水平与患者预后相关性较小的原因可能与样本量较小及随访时间较短等因素有关,在后期研究中考虑将增加样本量、延长随访时间。
综上所述,免疫组化检测p63、α-SMA表达与乳腺癌患者淋巴结转移相关,p63表达与患者2年预后存在相关性,p63、α-SMA及二者联合检测均对乳腺癌有一定诊断价值。
