结肠癌肝转移患者同期手术结合术后mFOLFOX6辅助化疗的远近期疗效及其影响因素分析
2022-05-26关记飞杨丽丽
关记飞,杨丽丽
河南省平顶山市第一人民医院:1.消化内科二病区;2.肿瘤科,河南平顶山 467000
结直肠癌是结肠癌和直肠癌的统称,是全球最为常见的恶性肿瘤之一,其具体的发病原因仍有待研究,部分学者认为其与饮食习惯、遗传和环境因素等有关。目前,全球每年的结直肠癌新发病例数已经超过120万,并且死亡病例数达60多万[1],我国结直肠癌的发病率及病死率也在逐年上升,对人们生命健康造成了极大的威胁。结直肠癌中结肠癌主要是指发生于升结肠、横结肠、降结肠及乙状结肠上皮细胞的恶性肿瘤[2],根据《2015年中国肿瘤登记年报》数据显示,超过50%的结肠癌患者会在病程中出现肝转移。目前手术治疗是根治结肠癌肝转移的主要方法,且术后患者的5年生存率能超过50%,但也有将近70%的患者术后会出现复发转移,对于预后不良的患者,5年生存率只有5%。术后的化疗对于降低肿瘤复发的风险起到了重要作用,其中FOLFOX化疗方案是临床上常用的术后一线治疗方案[3],并且根据临床的多次试验衍生出来多种治疗方案,其中mFOLFOX6方案是当前美国国立综合癌症网络(NCCN)指南推荐的方案之一[4]。因此,探索结肠癌肝转移术后mFOLFOX6辅助化疗的效果并研究其影响因素,是减少患者术后复发转移及改善患者生活质量的关键。目前,关于结肠癌肝转移患者术后远近期疗效影响因素的研究还比较缺乏。因此,本研究回顾性地分析本院结肠癌肝转移同期手术结合术后mFOLFOX6辅助化疗患者的临床资料,对患者的临床特征与根治术后远近期的疗效关系进行分析,现报道如下。
1 资料与方法
1.1一般资料 回顾性分析2016年1月至2018年1月在本院确诊为结肠癌肝转移并接受手术治疗的180例患者的临床资料。选取手术后接受mFOLFOX6辅助化疗的90例患者作为观察组,其余90例接受FOLFOX4辅助化疗的患者作为对照组。观察组男63例,女27例;年龄36~80岁;原发病灶位于升结肠、横结肠28例,位于降结肠、乙状结肠62例。对照组男68例,女22例;年龄34~78岁;原发病灶位于升结肠、横结肠31例,位于降结肠、乙状结肠59例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2纳入及排除标准 纳入标准:(1)年龄在20~80岁。(2)经病理学检查,参照《美国直肠外科医师协会结直肠治疗规范(2012版)精要及解读》[5]中相关标准,确诊为结肠癌的患者,同时伴有肝转移。(3)采用美国麻醉师协会(ASA)评分标准评估患者全身麻醉状态下手术治疗的耐受性,结果表现为Ⅰ~Ⅱ级。(4)采用卡式体能状态(KPS)评分标准评估患者化疗耐受能力,结果≥60分。(5)结肠癌原发病灶和肝转移病灶均可切除。(6)血常规、肝功能、肾功能、心电图等检验或检查结果正常或基本正常。排除标准:(1)对手术不耐受。(2)对化疗不耐受。(3)除肝脏外其他部位存在转移病灶。(4)除肝脏外其他部位存在未治愈的恶性肿瘤。
1.3方法 两组患者均接受腹腔镜结肠癌手术和腹腔镜下肝切除手术,手术过程中一般采用头高脚低的体位,以便完成腹腔镜下的肝切除手术,随后将肝脏的标本袋暂放于腹腔内;接着,根据原发肿瘤的位置选取适当的体位来完成腹腔镜结肠癌手术,并根据结肠癌的位置确定合适的腹壁切口,完成切除术后再将肝脏切除手术遗留的标本取出。观察组患者术后1周内接受mFOLFOX6辅助化疗,第1天,奥沙利铂,85 mg/m2静脉滴注2 h;亚叶酸钙,400 mg/m2静脉滴注2 h,随后静脉推注氟尿嘧啶400 mg/m2;氟尿嘧啶2 400 mg/m2持续静脉滴注46 h。每2周为1个周期治疗1次,共12个周期。对照组患者术后1周内接受FOLFOX4辅助化疗,第1天,奥沙利铂,100 mg/m2静脉滴注2 h;亚叶酸钙,400 mg/m2静脉滴注2 h,随后静脉推注氟尿嘧啶400 mg/m2;氟尿嘧啶2 400~3 000 mg/m2持续静脉滴注46 h。每2周为1个周期治疗1次,共治疗12个周期。在治疗过程中,若患者出现以下情况则延迟化疗(不超过1周):(1)中性粒细胞计数<1.5×109/L;(2)血小板计数<1.5×109/L。若患者出现Ⅳ级黏膜反应、Ⅲ级以上神经毒性、粒细胞减少伴发热,则将化疗药物减少25%;若患者出现Ⅲ级以上骨髓抑制,则使用粒细胞集落刺激因子。治疗过程中每4个周期对患者进行1次疗效评估,观察并记录患者辅助化疗后的不良反应,评估患者的生活质量。对于出现Ⅳ级不良反应,或Ⅲ级不良反应对症处理后,2周仍未恢复至≤Ⅱ级的患者则终止化疗。
1.4近期疗效评价
1.4.1化疗有效率评价 根据《实体瘤治疗疗效评价标准:RECIST》[6]中相关标准对患者术后化疗的近期疗效进行评价,疗效评价等级可分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。客观缓解率=(CR例数+PR例数)/总例数×100%。临床受益率=(CR例数+PR例数+SD例数)/总例数×100%。
1.4.2不良反应评价 根据美国国立癌症研究所颁布的国际通用化疗不良反应术语标准CTCAE V4.0将化疗后不良反应分为Ⅰ~Ⅳ级。Ⅰ级:化疗过程中患者未有明显的症状或者症状较轻,不需要采取干预措施;Ⅱ级:患者在化疗过程中出现需要药物干预的不适症状,但不影响患者的正常生存活动;Ⅲ级:患者在化疗过程中出现急需药物干预的不适症状,需要暂停或推迟化疗,可能影响患者的正常生存;Ⅳ级:严重影响患者的健康,危及生命。每个治疗周期评估过程中,只要出现1次不良反应症状则记为患者出现不良反应。将出现Ⅳ级定义为严重不良事件。
1.5远期疗效评价 采用门诊复查的方式进行随访,所有患者均有随访记录完整。患者在化疗结束后2年内平均每3个月复查1次,2年后则平均每6个月复查1次。复查的项目主要包括胸部和腹部CT、肝脏MRI,以及血清肿瘤标志物检测等,并记录统计患者1、2、3年后的生存率。
1.6统计学处理 所有数据经SPSS17.0软件进行统计分析。以Kaplan-Meier法分析患者的生存情况。计数资料比较采用χ2检验,等级资料比较采用秩和检验。采用单因素COX回归分析术后mFOLFOX6辅助化疗远期疗效的影响因素,采用多因素COX回归分析术后mFOLFOX6辅助化疗患者无瘤生存率及累积生存率的影响因素。以P<0.05为差异有统计学意义。
2 结 果
2.1近期疗效
2.1.1两组客观缓解率和临床受益率比较 治疗结束后,观察组患者客观缓解率高于对照组,但差异无统计学意义(P>0.05),观察组患者临床受益率高于对照组,差异有统计学意义(P<0.05)。见表1。

表1 两组客观缓解率和临床受益率比较[n(%)]
2.1.2不良反应评价 化疗前,所有患者均未出现严重不良反应,化疗后主要出现的一般不良反应有恶心呕吐、腹痛腹泻、白细胞减少、皮疹等。观察组患者不良反应的症状均较轻,除腹痛腹泻外,不良反应发生率明显低于对照组,差异有统计学意义(P<0.05)。两组患者出现不良反应后,通过对症治疗均能恢复。见表2。
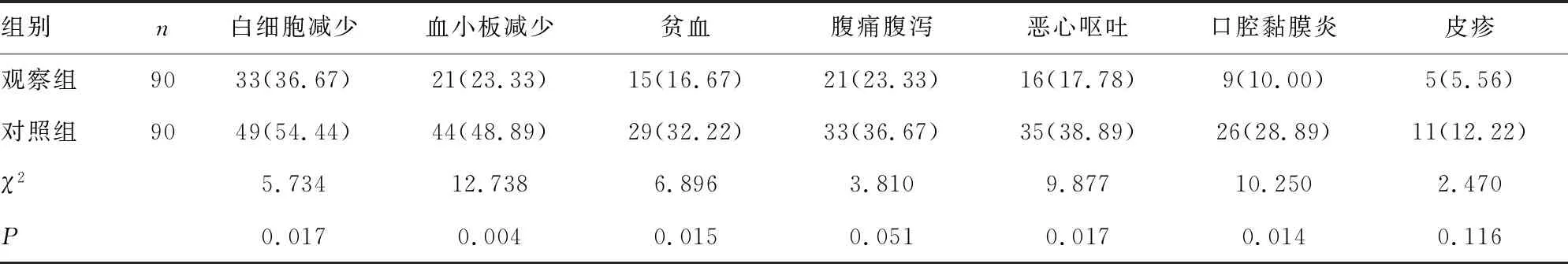
表2 两组患者化疗后不良反应发生率比较[n(%)]
2.2远期疗效 两组患者随访6~39个月,失访患者以删失数据进行处理。观察组失访21例,中位生存时间20个月(95%CI:18.8~21.2);对照组失访18例,中位生存时间17个月(95%CI:16.2~18.8)。观察组远期生存率高于对照组,差异有统计学意义(Log-rankP=0.033)。见图1。
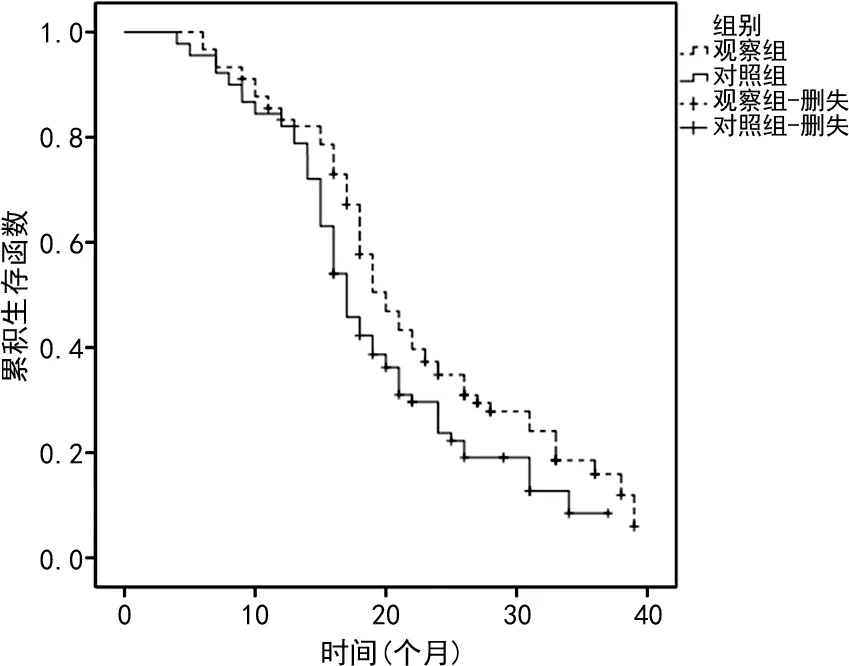
图1 两组患者生存曲线
2.3单因素COX回归分析 单因素COX回归分析显示,年龄、TNM分期、分化程度、转移病灶的数量、术前癌胚抗原(CEA)水平是同期手术结合术后mFOLFOX6辅助化疗患者3年无瘤生存率和累积生存率的影响因素(P<0.05)。见表3。
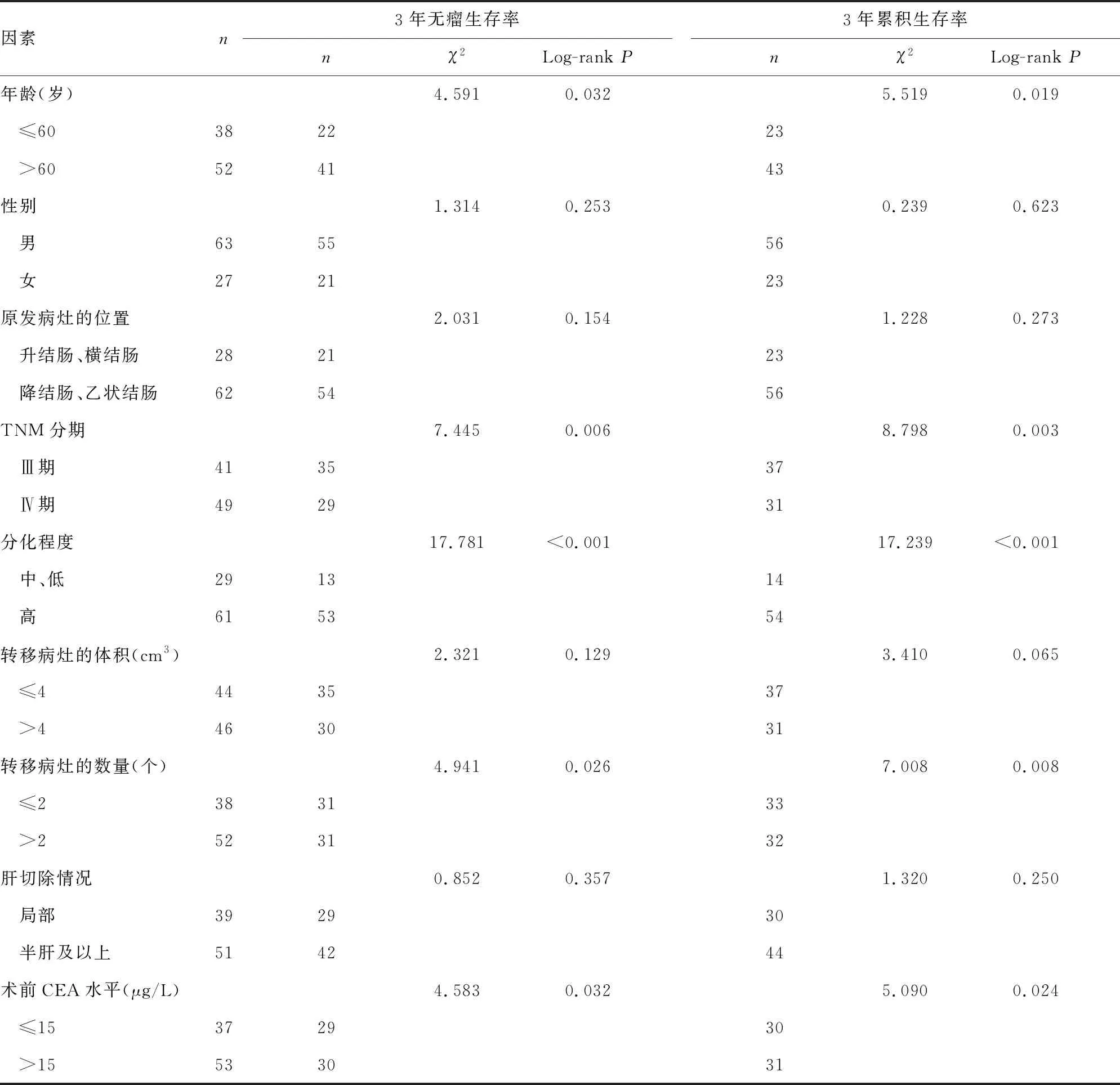
表3 术后mFOLFOX6辅助化疗对患者远期疗效的单因素分析
2.4多因素COX回归分析
2.4.1无瘤生存率的多因素COX回归分析 多因素COX回归分析显示,TNM分期、分化程度、转移病灶的数量和术前CEA水平是同期手术结合术后mFOLFOX6辅助化疗患者无瘤生存率的影响因素(P<0.05)。见表4。
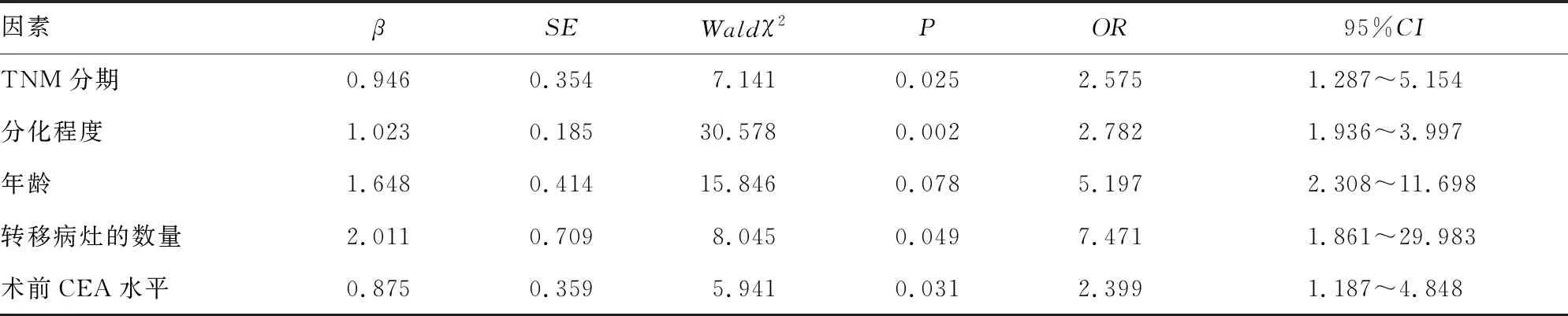
表4 无瘤生存率的多因素分析
2.4.2累积生存率的多因素COX回归分析 多因素COX回归分析结果显示,TNM分期、分化程度、转移病灶的数量和术前CEA水平是术后mFOLFOX6辅助化疗患者3年无瘤生存率和累积生存率的影响因素(P<0.05)。见表5。

表5 累积生存率的多因素COX回归分析
3 讨 论
目前,临床上治疗结肠癌肝转移的方法分为手术治疗和靶向治疗。随着临床手术技术的成熟,结肠癌肝转移手术成功率及安全性均提高。为提高患者结肠癌肝转移手术后的生存率,改善患者的生活质量,选择一种低毒高效的化疗方案成为当前研究的热点[7]。FOLFOX辅助化疗方案是当前临床上最为常见的一线化疗方案[8],化疗药物主要由奥沙利铂和亚叶酸钙等组成,其中奥沙利铂主要通过与肿瘤细胞的DNA发生交联反应,抑制肿瘤细胞DNA的合成,进而产生抗瘤的效果[9]。目前,FOLFOX4和FOLFOX6使用频率最高,但是传统的FOLFOX6方案辅助化疗的周期长,随着奥沙利铂神经毒性的积聚,会极大地影响患者的化疗效果[10-11]。目前,mFOLFOX6在传统FOLFOX4/6化疗方案的基础上对奥沙利铂的剂量做出了调整,是NCCN指南推荐的结肠癌肝转移同期术后的化疗方案之一[4]。
本研究结果发现,两组患者的化疗客观缓解率相似,但观察组的临床受益率明显高于对照组(P<0.05),进一步比较两组患者的不良反应发现,观察组患者的贫血、恶心呕吐、口腔黏膜等症状均较轻,观察组白细胞和血小板减少的患者比例小于对照组(P<0.05)。通过比较两组患者的近期疗效、不良反应,本研究发现,在结肠癌肝转移同期手术后采用mFOLFOX6辅助化疗能在保证化疗效果的基础上,明显缓解患者的不良反应症状,改善患者生活质量。奥沙利铂主要的神经毒性表现为明显剂量依赖性[12],在患者受到特定因素的激发时,其神经毒性的发生率能达到85%~95%[13]。而mFOLFOX6辅助化疗方案通过调整奥沙利铂的剂量,控制了其神经毒性积聚,进而对患者术后恢复产生了积极作用。
目前,临床上关于结肠癌术后危险因素的研究相对较多,但结肠癌合并肝转移同期术后化疗患者的病情更加复杂,影响其生存率的因素更值得研究。本研究将患者的性别、年龄、结肠癌原发病灶的位置、淋巴结是否侵犯、TNM分期、分化程度、转移病灶的数量及体积、肝切除情况,以及术前CEA水平等临床资料纳入单因素分析,评估其对患者同期手术后结合mFOLFOX6辅助化疗的3年无瘤生存率及累积生存率的影响。结果表明,年龄、TNM分期、分化程度、转移病灶的数量、术前CEA水平是患者无瘤生存率和累积生存率的影响因素。COX多因素回归分析显示,TNM分期、分化程度、转移病灶的数量、术前CEA水平是患者无瘤生存率和累积生存率的独立影响因素。
本研究结果显示,TNM分期是同期手术后结合mFOLFOX6辅助化疗患者无瘤生存率和累积生存率的影响因素,TNM分期处于Ⅲ期的患者无瘤生存率和累积生存率分明显高于TNM分期处于Ⅳ期患者(P<0.05)。有研究报道,TNM分期是恶性肿瘤预后的独立影响因素 ,也是结直肠癌预后的影响因素[14],表明TNM分期可用于评估瘤灶转移风险。
根据单因素分析结果显示,患者癌组织分化程度高的无瘤生存率及累积生存率明显高于分化程度处于中、低阶段患者的生存率,同时COX多因素回归分析显示,分化程度也是影响患者无瘤生存率及累积生存率的独立影响因素 。这与文献[15-16]的研究结果一致。由于对肿瘤分化程度的评估需要在术后通过病理组织学检查确定,具备一定的滞后性,因此无法在术前对患者的化疗预后进行评估。但是对于分化程度低的患者,在化疗后要加强患者的复查意识。
本研究单因素分析结果显示,转移灶的数量是患者无瘤生存率和累积生存率的影响因素,进一步COX多因素回归分析显示,转移灶的数量多于2个是患者无瘤生存率和累积生存率的危险因素。有研究表明,当患者肝转移瘤的数量多于3个时,患者的无瘤生存率会明显降低[17-18]。本研究结果发现,当患者的肝转移瘤多于2个时,患者的3年无瘤生存率及累积生存率明显下降。说明当患者的转移病灶的数量多于2个时,应对患者的根治性手术予以重视,探索最佳的治疗方案。
本研究对患者术前CEA水平进行统计分析,结果表明术前CEA水平是患者无瘤生存率和累积生存率的影响因素,进一步COX多因素回归分析显示,术前CEA大于15 μg/L是患者无瘤生存率和累积生存率的危险因素。CEA水平对多种肿瘤具有预测作用。本研究结果显示,当患者术前CEA水平大于15 μg/L时,患者的3年无瘤生存率及累积生存率明显下降,这与其他研究结果相近[19-20]。因此,对于术前CEA水平大于15 μg/L的患者应加强术后随访,并定期对CEA水平进行检查,从而及时应对肿瘤的复发和转移情况,提高患者的生存率。
综上所述,结肠癌肝转移同期手术后采用mFOLFOX6辅助化疗能提高患者的临床受益率,缓解患者的不良反应症状。单因素COX回归分析显示,年龄、TNM分期、分化程度、转移病灶的数量和术前CEA水平是同期手术结合术后mFOLFOX6辅助化疗患者3年无瘤生存率和累积生存率的影响因素,而多因素COX回归分析显示,TNM分期、分化程度、转移病灶的数量和术前CEA水平则是患者3年无瘤生存率及累积生存率的影响因素。本研究通过分析结肠癌肝转移同期手术结合术后mFOLFOX6辅助化疗患者的远近期疗效及临床影响因素,为临床上合理使用mFOLFOX6辅助化疗以及预测患者术后复发和转移风险提供数据支撑。但本研究纳入病例数及远期的观察指标有限,仍需多中心联合研究数据进一步验证。
