超声引导下射频消融术与激光消融术治疗小肝癌疗效比较
2022-05-26王黎伟王志芬
王黎伟,王志芬
(1.新乡医学院第一附属医院超声科,河南 卫辉 453100;2.新乡医学院第一附属医院PICC门诊,河南 卫辉 453100)
肝癌是常见的恶性肿瘤之一,其发病率、病死率高,严重危害患者健康[1-2]。目前,肝癌的主要治疗手段是手术切除和肝脏移植术[3-4]。手术切除和肝移植具有潜在的治愈性,但需要在发病早期得到诊断和治疗;然而,大部分肝癌患者确诊时已属晚期,往往错失手术及肝移植的最佳时机,导致无法得到有效治疗。此外,肝癌切除术后患者的肝功能严重受损,而肝移植仍然面临肝脏供体短缺的困境。近年来,射频消融术(radiofrequency ablation,RFA)、激光消融术(laser thermal ablation,LA)逐渐应用于临床[5-6]。RFA是治疗肝癌小病灶的方式之一,在造成局部高温杀死肿瘤细胞的同时又能保留肝脏组织的正常形态[7]。LA是以激光为能量源,通过组织阻抗产生热能,热能的积累使组织升温而导致蛋白质变性、肿瘤细胞坏死[8]。由于LA加热时间短、消融范围稳定,更适用于高危部位肝癌的治疗[9]。本研究对超声引导下RFA与LA治疗小肝癌的临床效果进行比较,旨在为临床选择肝癌的治疗方法提供参考。
1 资料与方法
1.1 一般资料选择2017年6月至2019年6月新乡医学院第一附属医院肝胆外科收治的小肝癌患者为研究对象。病例纳入标准:(1)经穿刺活检病理学检查、影像学检查确诊为肝癌,且为首次确诊;(2)单发癌灶直径≤3 cm,或者2个相邻癌灶的直径之和≤3 cm;(3)肝功能Child-Pugh分级标准为A、B级;(4)均为首次行LA或RFA治疗;(5)既往无肝脏手术史。排除标准:(1)伴有周围血管、胆管浸润及腹腔淋巴结转移、远处转移等;(2)肝功能Child-Pugh分级标准为C级;(3)合并严重心、肺、肾等脏器实质性病变或功能衰竭;(4)活动性消化道出血、顽固性腹水、严重出凝血功能障碍、活动性感染等。本研究共纳入肝癌患者146例,采用随机数字表法将患者分为RFA组和LA组,每组73例。RFA组:男53例,女20例;年龄57~81(69.88±11.44)岁,病灶86个。LA组:男50例,女23例;年龄58~79(67.82±10.26)岁,病灶87个。2组患者的性别、年龄、病灶数比较差异无统计学意义(P>0.05),具有可比性。本研究通过医院伦理委员会审批,所有患者签署知情同意书。
1.2 治疗方法所有患者消融治疗前进行常规二维超声及超声造影检查。采用二维灰阶超声观察病灶位置、数目、形态、大小、边界、毗邻结构或脏器、有无淋巴结转移等;使用彩色多普勒超声观察病灶中央及周边的血供情况。超声造影检查:造影剂中加入5 mL生理盐水,摇晃混合形成六氟化硫微泡。经肘正中静脉注入造影剂2~4 mL,嘱咐患者平静呼吸,随后注入5 mL生理盐水,观察并测量病灶大小及部位。根据二维超声和超声造影检查结果,在保证足够的安全范围的前提下选择合适的体位及进针路径,确定布针数目,制定治疗方案。
1.2.1 RFA组RFA组患者应用C001-Tip型冷循环射频系统(美国Radionics公司)行超声引导下肝癌RFA。患者选择合适的体位,常规消毒铺单,采用静脉麻醉及10 g·L-1利多卡因局部麻醉。肿瘤直径<2 cm时选用单极消融电极针操作,穿刺至肿瘤中心部位;肿瘤直径2~3 cm时选用双极消融电极针T30或T40穿刺至肿瘤两侧;开始消融,注意观测汽化所致高回声覆盖范围,当针杆温度低于20 ℃时拔出电极针,退针过程中实施针道消融,观察患者生命体征正常,将患者送回病房。
1.2.2 LA组LA组患者应用EchOLaserX4超声激光消融系统(意大利百胜医疗设备公司)行超声引导下肝癌LA。患者选择合适体位,常规消毒铺单,采用静脉麻醉及10 g·L-1利多卡因局部麻醉。肿瘤直径<2 cm时选用1~2根光纤,肿瘤直径2~3 cm时选用2~4根光纤。嘱咐患者深呼吸,此时在超声引导下进针,注意避免损伤周围组织或引起癌组织出血等情况;参数设置:光纤输出功率5 W,单针输出能量1 800 J。开启后逐渐向体表退出穿刺针和光纤,直至完成整块占位的消融,此后,观察患者生命体征正常,将患者送回病房。
1.3 观察指标(1)记录2组患者手术时间和病灶范围(即可手术病灶的直径)。(2)肿瘤消除情况:分别于术后1、3、12个月通过二维超声及超声造影检查观察患者的病灶大小及动态增强情况。参照修订版实体瘤疗效评价标准[10]评定患者临床疗效。肿瘤完全消除:术后肿瘤消融区超声造影无明显增强;部分消除:术后肿瘤消融区超声造影可见部分增强。

2 结果
2.1 2组患者病灶范围和手术时间比较结果见表1。2组患者病灶范围比较差异无统计学意义(P>0.05);LA组患者手术时间显著短于RFA组,差异有统计学意义(P<0.05)。
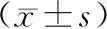
表1 2组患者病灶范围和手术时间比较
2.2 2组患者肿瘤消除情况比较结果见表2。术后1个月2组患者的肿瘤消除情况比较差异无统计学意义(χ2=0.330,P>0.05);术后3个月及术后1 a,LA组患者的肿瘤消除情况显著优于RFA组,差异有统计学意义(χ2=7.601、6.826,P<0.05)。
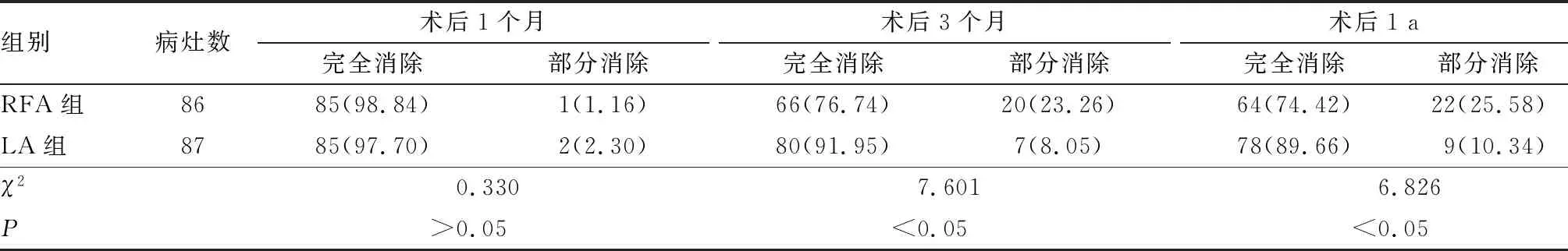
表2 2组患者肿瘤消除情况比较
2.3 2组患者并发症比较结果见表3。2组患者腹腔出血、腹水发生率比较差异无统计学意义(P>0.05);LA组患者恶心呕吐、发热、腹泻、气胸的发生率显著低于RFA组,差异有统计学意义(P<0.05)。2组患者的并发症经临床对症治疗后均完全治愈。
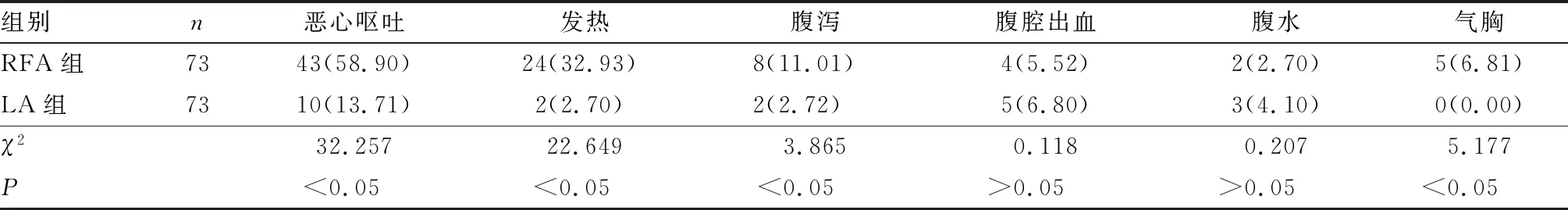
表3 2组患者并发症比较
3 讨论
肝癌是全球第5大最常见的恶性肿瘤,也是第2大最常见的癌症相关死亡原因[11-12]。因此,积极探寻肝癌的早期诊断和有效的治疗方法是提高患者生存质量、降低患者病死率的关键。近年来,随着科技水平的不断提高,高分辨率CT、磁共振成像、超声造影检查及血液肿瘤标志物检测使肝癌的早期诊断率明显提高。
目前,肝癌的治疗多以手术切除和肝脏移植为主,但由于手术适应证、禁忌证及患者自身耐受程度的限制,使得微创手术在小肝癌的治疗方面发挥了不可忽视的作用,消融术已成为小肝癌的首选治疗措施之一[13]。RFA和LA是小肝癌的常用治疗方法[14]。超声引导下RFA是将一电极针插入肿瘤内部,采用450 kHz的高频交流电磁波激发非绝缘电极顶端,造成周围组织离子震荡发热,肿瘤局部温度达90~120 ℃而使肿瘤组织细胞热凝固坏死,一般消融范围可达到3~5 cm。研究显示,RFA治疗时间较传统外科手术明显缩短,且损伤较小,但若肿瘤位于肝脏表面或血管旁,则极易引起血管损伤,导致肿瘤消融不完全[15]。另外,RFA还会引起皮肤灼伤、疼痛、发热等并发症。超声引导下LA是将激光消融针刺入肿瘤体内,以激光为能量源,通过组织阻抗产生热能,热能的积累使组织升温而导致蛋白质变性、肿瘤细胞坏死[8]。LA的特点是能够快速精准地杀死肿瘤细胞,尽可能地保留肿瘤周围正常肝脏组织,且LA操作简便、创伤小、并发症少,可用于不同大小、不同部位的肝癌的治疗[16]。本研究结果显示,LA组患者的手术时间显著短于RFA组,术后3个月及1 a,LA组患者的肿瘤消除情况显著优于RFA组,提示LA治疗小肝癌具有较好的肿瘤消除效果,且手术时间较短。另外,LA组患者恶心呕吐、发热、腹泻、气胸的发生率显著低于RFA组,提示LA的并发症发生率较低。
综上所述,LA治疗小肝癌具有操作简便、手术时间短、肿瘤消除率高、并发症少等优势。但本研究样本量较小,且为单中心研究,尚需要进一步研究。
