Ⅳ型胶原蛋白基因α1对胃癌细胞增殖、转移及凋亡的调控作用与机制
2022-05-26李怡君杨振威陈晓露司望利
李怡君,杨振威,陈晓露,司望利
(西安市中心医院消化科,陕西 西安 710003)
胃癌是一种起源于胃黏膜上皮的常见恶性肿瘤,严重威胁着人类的生命健康[1]。胃癌的发病率和致死率在全球范围内均处于较高水平[2-3]。Ⅳ型胶原蛋白基因α1(type Ⅳ collagen gene α1,COL4A1)是一种特殊的胶原蛋白,参与了基底膜的构成,与多种血管疾病相关[4-5]。有研究表明,COL4A1在多种肿瘤组织中存在异常表达,且在肿瘤发生、发展过程中起到关键的调节作用[6-7]。通过调控COL4A1的表达能够调节肿瘤细胞的转移、增殖以及凋亡能力[8]。此外,微阵列分析发现,COL4A1在胃癌组织中异常表达,且与胃癌的术后复发和不良预后有关[9]。但COL4A1在胃癌发生、发展中的作用机制仍不清晰。本研究旨在探讨COL4A1在胃癌的病理发展中的调控作用及其机制。
1 材料与方法
1.1 病理组织样本来源本研究中所用到的胃癌组织以及匹配的癌旁组织(取自距离肿瘤组织5 cm外的正常组织)样本来自2015年9月至2017年5月于西安市中心医院接受胃癌切除手术的52例患者的标本。患者术前均未接受过化学治疗、放射治疗,患者均无其他部位肿瘤,所有患者及其家属同意样本采集和应用并签署了知情同意书,本研究得到西安市中心医院伦理委员会的批准。
1.2 细胞、试剂与仪器人正常胃黏膜上皮细胞GES-1及胃癌细胞系(SGC-7901、MKN-28、BGC-803、MGC-823、MKN-45和AGS)均购自中国科学院上海细胞库。达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)、胎牛血清、青霉素G、胰蛋白酶、磷酸盐缓冲液(phosphate buffered saline,PBS)、细胞裂解液购自加拿大Gibio公司,LipofectarmineTM3000和TRIzol试剂盒购自美国Invitrogen公司,细胞计数试剂盒-8(cell counting Kit-8,CCK-8)购自日本Dojindo公司,EcoDryTMPremix(Oligo dT)和SYBR Premix Ex Taq试剂盒购自大连Takara公司,二喹啉甲酸蛋白检测试剂盒购自上海碧云天生物技术有限公司,COL4A1 小干扰RNA(small interfering RNA,siRNA)的合成由生工生物工程(上海)股份公司完成,磷脂酰肌醇激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/Akt)通路激活剂740 Y-P购自美国Med Chem Express公司;基质胶、细胞培养板购自美国Corning公司。
1.3 实验方法
1.3.1 细胞培养将所有的胃癌细胞接种于2 mL含有体积分数10%胎牛血清、100 000 U·L-1青霉素G以及100 g·L-1链霉素的DMEM中,于37 ℃、含体积分数5%CO2的培养箱中进行培养。当细胞生长至80%融合度时,使用胰蛋白酶对细胞进行消化,同时使用PBS清洗细胞,然后进行传代培养。培养期间每2~3 d更换1次培养基。
1.3.2 实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)检测胃癌组织、癌旁组织、胃癌细胞及正常胃黏膜上皮细胞中COL4A1基因的表达胃癌组织、癌旁组织、胃癌细胞及GES-1细胞经过消化、研磨破碎后,使用TRIzol试剂盒提取总RNA,于NanoDrop OD仪上分析RNA浓度。EcoDryTMPremix(Oligo dT)试剂盒用于反转录实验。反转录条件为:37 ℃ 60 min,85 ℃ 5 min。以反转录后得到的cDNA为模板,使用SYBR Premix Ex Taq试剂盒进行RT-qPCR实验。PCR反应条件为:95 ℃ 预变性5 min;95 ℃ 10 s,58 ℃ 20 s,72 ℃ 10 s,共40个循环;72 ℃ 7 min;4 ℃ 保存。所有实验操作均按照试剂盒使用说明书进行。以β-actin为内参基因。引物序列如下:COL4A1正向引物序列为5′-CTCCAGTATCTCTTTTGT-3′,反向引物序列为5′-TATTTCTATGAGCCACCT-3′;β-actin正向引物序列为5′-CACTCTCGAGATGGCTACTCAAGCTG-3′,反向引物序列为5′-CTGCGGATCCTTACAGGTCAGTATCAAAC-3′。采用2-ΔΔCt法计算目的基因的相对表达量。实验重复3次,取均值。根据6种胃癌细胞中COL4A1基因的表达情况,AGS和SGC-7901细胞被用于进行后续的细胞功能验证实验。
1.3.3 细胞分组及处理将经过胰蛋白酶消化并计数的AGS、SGC-7901细胞接种于6孔板,并于融合度达到90%后,将2种细胞分为对照组、阴性对照(negative control,NC)siRNA组、siCOL4A1-1组、siCOL4A1-2组和siCOL4A1-2+740 Y-P组。对照组细胞正常培养,不进行任何处理;NC siRNA组细胞转染NC siRNA,siCOL4A1-1组细胞转染siCOL4A1-1,siCOL4A1-2组细胞转染siCOL4A1-2,siCOL4A1-2+740 Y-P组细胞转染siCOL4A1-2,然后使用50 mg·L-1的740 Y-P处理90 min。细胞转染实验的操作步骤依照LipofectarmineTM3000试剂盒说明书进行,siRNA转染浓度为50 nmol·L-1,转染时长48 h。其中siCOL4A1-1组仅用于RT-qPCR实验。
1.3.4 RT-qPCR法检测对照组、NC siRNA组、siCOL4A1-1组和siCOL4A1-2组AGS SGC-7901细胞中COL4A1基因的表达采用“1.4”项中方法检测4组细胞中COL4A1基因的表达。根据检测结果选择siCOL4A1-2组细胞进行后续实验。
1.3.5 CCK-8实验测定AGS、SGC-7901细胞增殖能力取对照组、NC siRNA组、siCOL4A1-2组和siCOL4A1-2+740 Y-P组的AGS和SGC-7901细胞100 μL(5 × 107L-1)分别接种于96孔板中,预培养24 h。更换培养基后,将各组细胞均分为4个亚组,分别继续培养1、2、3、4 d,随后分别加入10 μL CCK-8溶液,于37 ℃下避光孵育2 h,使用酶标仪测定样本在450 nm波长下的吸光度(absorbance,A450),实验重复3次,取均值。吸光度越大代表细胞增殖能力越强。
1.3.6 膜联蛋白-V/异硫氰酸荧光素(annexin Ⅴ/fluorescein isothiocyanate,Annexin Ⅴ/FITC)实验检测AGS、SGC-7901细胞凋亡情况取对照组、NC siRNA组、siCOL4A1-2组和siCOL4A1-2+740 Y-P组的AGS和SGC-7901细胞,1 200 r·min-1离心5 min,弃去培养基上清液后,使用预冷的PBS清洗,随后加入500 μL Annexin Ⅴ 结合缓冲液,混匀后避光孵育25 min。使用5 μL Annexin Ⅴ/FITC以及 5 μL 碘化丙啶对各组细胞进行染色。最后使用流式细胞仪及Cell Quest软件对实验结果(荧光染色)进行分析并计算细胞凋亡率。实验重复3次,取均值。
1.3.7 Transwell实验检测AGS、SGC-7901细胞迁移和侵袭能力取对照组、NC siRNA组、siCOL4A1-2组和siCOL4A1-2+740 Y-P组的AGS和SGC-7901细胞,在进行Transwell实验前转入无血清培养基中培养12 h。细胞迁移实验:取各组细胞200 μL(1 × 106L-1)接种于Transwell小室(滤膜孔径为8 μm)的上层,下层孔板中补入800 μL含有体积分数10%胎牛血清的完全培养液,于37 ℃、含体积分数5% CO2的培养箱中孵育24 h。然后用棉签轻轻刮拭掉上层未穿膜的细胞,PBS清洗后,光学倒置显微镜下随机计数5个不同视野范围内的细胞数量,取均值。在使用Transwell测定细胞侵袭的实验中,需在Transwell的上层小室提前铺入50 μL的Matrigel胶,其余操作步骤与细胞迁移实验相同。
1.3.8 Western blot法检测AGS和SGC-7901细胞中PI3K/Akt通路相关蛋白表达分别使用细胞裂解液和二喹啉甲酸蛋白检测试剂盒裂解对照组、NC siRNA组、siCOL4A1-2组和siCOL4A1-2+740 Y-P组的AGS和SGC-7901并提取总蛋白。提取物经过聚丙烯酰胺凝胶电泳分离后转至含体积分数5%的脱脂牛奶封闭液的聚偏二氟乙烯膜上,并分别在anti-p-PI3K、anti-PI3K、anti-p-Akt以及anti-Akt抗体(稀释比11 000)作用下4 ℃过夜孵育。然后三羟甲基氨基甲烷缓冲液清洗薄膜,加入辣根过氧化物酶抗体(稀释比14 000)室温孵育2 h。增强化学发光显色液曝光蛋白条带,以目的蛋白条带的灰度值/内参条带的灰度值代表目的蛋白相对表达量。以p-PI3K/PI3K及p-Akt/Akt比值表示PI3K/Akt通路的激活水平。此部分实验以β-actin为内参蛋白,用于均一化蛋白测定条件。

2 结果
2.1 胃癌组织、癌旁组织、胃癌细胞及正常胃黏膜上皮细胞中COL4A1基因的表达情况胃癌组织及癌旁组织中COL4A1基因的相对表达量分别为1.978±0.061、0.979±0.043,胃癌组织中COL4A1基因的相对表达量显著高于癌旁组织,差异有统计学意义(P<0.05)。
AGS、BGC-823、MGC-803、MKN-28、MKN-45、SGC-7901细胞中COL4A1基因的相对表达量均显著高于GES-1细胞,差异有统计学意义(P<0.05)。AGS、SGC-7901细胞中COL4A1基因的相对表达量显著高于BGC-823、MGC-803、MKN-28、MKN-45细胞,差异有统计学意义(P<0.05)。BGC-823、MGC-803、MKN-28、MKN-45细胞中COL4A1基因的相对表达量比较差异无统计学意义(P>0.05)(表1)。选择AGS和SGC-7901细胞用于后续细胞功能验证实验(细胞增殖、凋亡、迁移和侵袭等)。
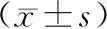
表1 COL4A1基因在正常胃黏膜上皮细胞和胃癌细胞中的表达比较
2.2 siRNAs对AGS和SGC-7901细胞中COL4A1基因表达的影响结果见表2。siCOL4A1-1和siCOL4A1-2组AGS、SGC-7901细胞中COL4A1基因相对表达量均显著低于NC siRNA组和对照组,差异有统计学意义(P<0.05);siCOL4A1-2组AGS、SGC-7901细胞中COL4A1基因的相对表达量显著低于siCOL4A1-1组,差异有统计学意义(P<0.05)。选择siCOL4A1-2组细胞进行后续实验。
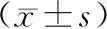
表2 对照组、NC siRNA组、siCOL4A1-1组、siCOL4A1-2组AGS和SGC-7901细胞中COL4A1基因表达的比较
2.3 4组AGS和SGC-7901细胞增殖和凋亡情况比较结果见表3和表4。siCOL4A1-2组AGS细胞的增殖能力在培养3 d和4 d时显著低于对照组和NC siRNA组,SGC-7901细胞的增殖能力在培养1、2、3、4 d时均显著低于对照组和NC siRNA组,差异有统计学意义(P<0.05);siCOL4A1-2+740 Y-P组AGS细胞的增殖能力在培养3 d和4 d时显著高于siCOL4A1-2组,SGC-7901细胞的增殖能力在培养1、2、3、4 d时均显著高于siCOL4A1-2组,差异有统计学意义(P<0.05);其余各组细胞增殖能力比较差异均无统计学意义(P>0.05)。
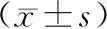
表3 4组AGS和SGC-7901细胞增殖能力比较
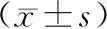
表4 4组AGS和SGC-7901细胞凋亡率比较
siCOL4A1-2组AGS、SGC-7901细胞的凋亡率均显著高于对照组和NC siRNA组,差异有统计学意义(P<0.05);siCOL4A1-2+740 Y-P组AGS、SGC-7901细胞的凋亡率均显著低于siCOL4A1-2组,差异有统计学意义(P<0.05);其余各组2种细胞凋亡率比较差异均无统计学意义(P>0.05)。
2.4 4组AGS和SGC-7901细胞迁移和侵袭能力的比较结果见表5。siCOL4A1-2组AGS、SGC-7901细胞迁移能力和侵袭能力均显著低于对照组和NC siRNA组,差异有统计学意义(P<0.05);siCOL4A1-2+740 Y-P组AGS、SGC-7901细胞迁移能力和侵袭能力均显著高于siCOL4A1-2组,差异有统计学意义(P<0.05);其余各组2种细胞迁移能力和侵袭能力比较差异无统计学意义(P>0.05)。
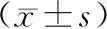
表5 4组AGS和SGC-7901细胞迁移和侵袭能力比较
2.5 4组AGS和SGC-7901细胞中PI3K/Akt信号通路相关蛋白表达的比较结果见图1及表6。对照组与NC siRNA组AGS、SGC-7901细胞中p-PI3K/PI3K、p-Akt/Akt值比较差异无统计学意义(P>0.05);siCOL4A1-2组AGS、SGC-7901细胞中p-PI3K/PI3K、p-Akt/Akt值显著低于对照组和NC siRNA组,差异有统计学意义(P<0.05);siCOL4A1-2+740 Y-P组AGS、SGC-7901细胞中p-PI3K/PI3K、p-Akt/Akt值显著高于siCOL4A1-2组,差异有统计学意义(P<0.05)。

A:AGS细胞;B:SGC-7901细胞;1:对照组;2:NC SiRNA组;3:siCOL4A1-2;4:siCOL4A1-2+740 Y-P组。
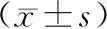
表6 4组AGS和SGC-7901细胞中PI3K/Akt通路相关蛋白表达的比较
3 讨论
研究表明,Ⅳ型胶原蛋白是构成基底膜最主要且最重要的成分[6]。基底膜与层粘连蛋白、纤连蛋白和肌动蛋白一并构成了特殊形式的细胞外基质[10]。此外,基底膜不仅是组织的结构特征、血管的功能成分,同样也是调节肿瘤细胞行为的重要成分[11]。COL4A1是Ⅳ型胶原蛋白家族中的一员,其突变被认为参与了多种血管疾病的病理进程,包括心肌梗死、家族性肾病、脑卒中等[3-4,12]。近年来,越来越多的研究发现COL4A1的异常表达与肿瘤疾病相关。MIYAKE等[6]研究表明,膀胱尿路上皮癌的肿瘤细胞产生的COL4A1通过诱导肿瘤出芽在肿瘤侵袭中起着关键作用。COL4A1在肝癌中的高表达水平与肿瘤晚期进展以及肝癌患者不良的生存情况密切相关[13]。此外,沉默COL4A1能够降低乳腺癌细胞活力,阻滞细胞周期[14]。近来,科学家通过测序及微阵列分析等生物信息学方法发现,COL4A1在胃癌中存在异常表达,并可能与胃癌细胞的生长、耐药性及术后复发密切相关[9,15-16]。本研究证实,COL4A1在胃癌组织与细胞中表达上调,这与先前的研究结论一致[9]。同时,本研究还发现,沉默COL4A1可显著抑制胃癌细胞的增殖、迁移与侵袭能力,并促进细胞凋亡。
PI3K/Akt是生物体内最重要的参与多种细胞基本进程调控的信号转导通路之一[17]。研究表明,PI3K/Akt信号通路的失调与包括恶性肿瘤在内的许多疾病相关[18-20]。HUANG等[21]研究发现,激活PI3K/Akt通路能够促进胃癌细胞的侵袭能力。阻断PI3K/Akt通路可以有效地抑制胃癌细胞的增殖[19]。YANG等[22]研究证实,抑制PI3K/Akt通路可促进胃癌细胞的凋亡,进而抑制肿瘤进展。有研究表明,COL4A1可能是通过PI3K/Akt通路激活成纤维细胞来合成胶原蛋白[23]。本研究结果显示,PI3K/Akt信号通路在胃癌细胞中被高度激活,而沉默COL4A1显著抑制了PI3K/Akt通路的激活,使用740 Y-P激活该通路能够逆转COL4A1沉默对胃癌细胞增殖、凋亡及转移能力的影响。
综上所述,COL4A1在胃癌组织和细胞中的高表达参与了肿瘤病理发展的调控。沉默COL4A1能够抑制胃癌细胞的增殖、侵袭和迁移能力,同时促进细胞凋亡。此外,本研究还证实了COL4A1可通过PI3K/Akt信号通路对胃癌细胞功能及肿瘤发展进行调控。
