外周血中微RNA-16和微RNA-124表达水平对抑郁症患者治疗效果的影响
2022-05-26邵秋静冀紫阳王长虹
邵秋静,冀紫阳,董 娇,王长虹
(新乡医学院第二附属医院精神科,河南 新乡 453002)
抑郁症是一种临床上常见的以情绪低落、快感缺失、思维迟缓、意志活动减退为主的心境障碍,近年来其发生率逐年升高[1]。5-羟色胺(5-hydroxytryptamine,5-HT)与抑郁症的发生、进展有关,5-HT具有神经调控作用,参与睡眠、焦虑、情感控制等多种脑功能活动[2]。目前,临床治疗抑郁症多采用艾司西酞普兰、米氮平等药物,其中艾司西酞普兰可选择性抑制5-HT再摄取,有效提高中枢神经系统外5-HT水平,起到抗抑郁效果[3]。米氮平可拮抗α2受体,促进5-HT释放,且可协同中枢神经系统5-HT受体,发挥抗焦虑、抗抑郁作用[4]。但有临床研究发现,30%~40%的抑郁症患者抗抑郁治疗效果不佳,可能会出现抑郁复发、症状残留等情况[5]。SI等[6]研究发现,微RNA(microRNA,miRNA)与抑郁症的发生、发展密切相关。miR-16、miR-124是miRNA家族的成员,其中miR-16相应碱基序列可匹配5-HT转运体的3′端非翻译区,上调5-HT表达,抑制抑郁症的发生;而miR-124可调节神经细胞再生,促进神经元分化,下调5-HT转运体表达,促进抑郁症的发生[7-8]。结合miR-16、miR-124作用机制,推测二者可能与抑郁症患者接受艾司西酞普兰、米氮平治疗的临床疗效有关,但具体关系尚未明确。鉴于此,本研究探讨了抑郁症患者外周血中miR-16、miR-124的表达水平与临床疗效的关系。
1 资料与方法
1.1 一般资料选择2020年5月至2021年3月新乡医学院第二附属医院收治的60例抑郁症患者为研究对象。病例纳入标准:(1)符合《精神病诊断与统计手册(第5版)》抑郁症[9]相关诊断标准;(2)经临床症状(自我评价低、有自伤或自杀观念、注意力低等)、病史等确诊为抑郁症;(3)入院时汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)[10]≥14分,入院时汉密尔顿抑郁量表(Hamilton depression scale,HAMD)[11]≥17分;(4)首次发病,且首次接受抑郁症相关治疗;(5)受教育程度为初中及以上;(6)依从性好,可配合临床研究。排除标准:(1)分裂情感性精神障碍、精神发育迟滞、广泛性发育障碍、谵妄、痴呆、记忆障碍或其他认知障碍者;(2)物质(酒、药物等)滥用所致精神障碍;(3)患有严重或不稳定的躯体疾病者、糖尿病、甲状腺疾病、高血压病、心脏病等;(4)患有闭角型青光眼;(5)有癫痫病史(高热惊厥者除外)者;(6)符合《精神疾病的诊断和统计手册》2000年修订版酒药依赖(尼古丁依赖除外)诊断标准的患者;(7)患有或曾患有药源性恶性综合征、严重迟发性运动障碍者;(8)妊娠期、哺乳期、计划妊娠者。本研究60例患者中,男27例,女33例;年龄24~38(31.63±2.07)岁;病程3~11(7.15±1.12)个月;入院时HAMA评分14~21(17.12±1.21)分;入院时HAMD评分17~24(20.13±1.04)分。本研究获新乡医学院第二附属医院医学伦理委员会批准[XYEFYLL-(科研)-2020-26],所有患者及家属知情同意并签署研究知情同意书。
1.2 治疗方法所有患者接受米氮平片[华裕(无锡)制药有限公司,国药准字H20100103]口服治疗,起始剂量为15 mg·d-1,服用2周后增加至30 mg·d-1,并维持此剂量服用;若服用2周后治疗效果不明显,可增加至45 mg·d-1(最大剂量不得超过45 mg·d-1),或调整为联合口服艾司西酞普兰(山东京卫制药有限公司,国药准字H2008059),艾司西酞普兰起始剂量为10 mg·d-1,可根据患者病情变化适当调整用药剂量,最大剂量不得超过20 mg·d-1,注意米氮平不可掰开服用。治疗周期为3个月。
1.3 基线资料采集设计基线资料填写表,询问并记录患者相关基线资料,包括:性别、年龄、病程、入院时HAMA评分、入院时HAMD评分、受教育程度(高中或中专、专科及以上)、婚姻情况(已婚、未婚/离异/丧偶)等。
1.4 临床疗效评估治疗3个月后,参照文献[12]方法,采用HAMA、HAMD评估临床疗效。HAMA包括14个项目,各项目均采用0~4分的5级评分法,总分0~56分,得分越高表示焦虑症状越严重。HAMD包括17个项目,其中第1~3、7~11、15、17项采用0~4分的5级评分法,第4~6、12~14、16项采用0~2分的3级评分法,总分0~54分,得分越高表示焦虑症状越严重。HAMA≥7分或HAMD≥8分表示临床疗效不佳,反之则为临床疗效良好。
1.5 外周血中miR-16、miR-124相对表达量检测治疗前,采集患者空腹静脉血3 mL,使用低速离心机(湖南赫西仪器装备有限公司)3 000 r·min-1离心10 min,离心半径为10 cm,分离血浆,置于-20 ℃环境下贮存、待检。取200 μL标本,使用TRIzol总RNA试剂盒(美国Thermo Scientific公司)提取样本总RNA,使用反转录仪(美国Thermo Scientific公司)将总RNA反转录为cDNA,反应体系共20 μL:1.2 μL引物、0.2 μL反转录酶、10 μL 2×反转录缓冲液、2 μL RNA模板,6.6 μL 焦碳酸二乙酯水;反应程序: 26 ℃变性30 min、42 ℃退火30 min、85 ℃延伸10 min。反转录反应结束后,使用聚合酶链式反应(polymerase chain reaction,PCR)分析仪(山东博科科学仪器有限公司)进行实时荧光PCR,反应体系共20 μL:2 μL cDNA模板,0.4 μL Taq DNA聚合酶,0.08 μL上、下游引物、17.44 μL 双蒸水;反应条件:95 ℃变性3 min、95 ℃退火30 s、62 ℃延伸40 s,共40个循环。采用2-△△Ct法计算miR-16、miR-124相对表达量。

2 结果
2.1 抑郁症患者临床疗效60例抑郁症患者经3个月治疗后,19例(31.67%)患者临床疗效不佳(疗效不佳组),HAMA评分8~15(9.34±1.02)分,HAMD评分9~18(11.36±1.20)分;41例(68.33%)患者临床疗效良好(疗效良好组),HAMA评分2~7(3.13±0.76)分,HAMD评分1~8(4.25±0.97)分。
2.2 2组患者基线资料比较2组患者的性别、年龄、病程、受教育程度、婚姻状况比较差异均无统计学意义(P>0.05)。
表1 2组患者基线资料比较
2.3 2组患者外周血中miR-16、miR-124相对表达量比较疗效不佳组和疗效良好组患者外周血中miR-16相对表达量分别为0.03(0.03,0.04)、0.06(0.04,0.07),miR-124相对表达量分别为5.22(4.25,5.96)、4.00(3.40,4.60)。疗效良好组患者外周血中miR-16相对表达量显著高于疗效不佳组,差异有统计学意义(t=4.288,P<0.05);疗效良好组患者外周血中miR-124相对表达量显著低于疗效不佳组,差异有统计学意义(t=5.450,P<0.05)。
2.4 抑郁症患者外周血中miR-16、miR-124相对表达量与临床疗效的关系结果见表2。将患者外周血中miR-16、miR-124相对表达量作为自变量,抑郁症患者临床预后情况作为因变量进行logistic回归分析,结果显示,miR-16是抑郁症患者临床疗效的保护因子(OR<1,P<0.05),miR-124是抑郁症患者临床疗效的危险因子(OR>1,P<0.05)。
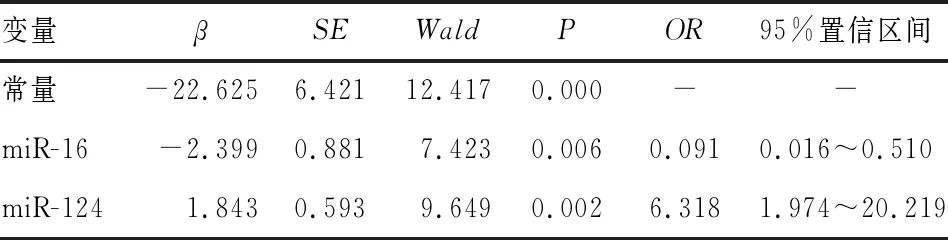
表2 抑郁症患者外周血中miR-16、miR-124相对表达量与临床疗效的关系
2.5 外周血中miR-16、miR-124相对表达量预测抑郁症患者临床疗效的价值分析结果见图1和表3。将抑郁症患者外周血中miR-16、miR-124相对表达量作为检验变量,抑郁症患者临床疗效情况作为状态变量,绘制ROC曲线,结果发现,外周血中miR-16、miR-124相对表达量单独及联合检测预测抑郁症患者临床疗效不佳风险的AUC分别为0.843、0.849、0.909。外周血中miR-16、miR-124相对表达量单独及联合检测预测抑郁症患者临床疗效的AUC、敏感度比较差异无统计学意义(P>0.05)。miR-16和miR-124相对表达量联合检测预测抑郁症患者临床疗效的特异度显著高于miR-16相对表达量单独检测,显著低于miR-124相对表达量单独检测,差异有统计学意义(P<0.05)。
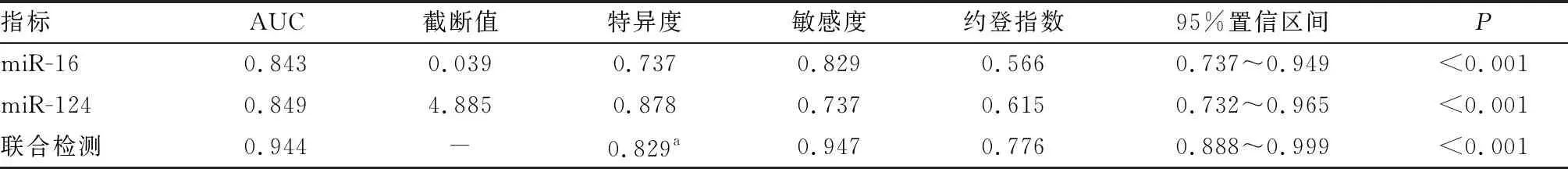
表3 外周血中miR-16、miR-124相对表达量预测抑郁症患者临床疗效的价值
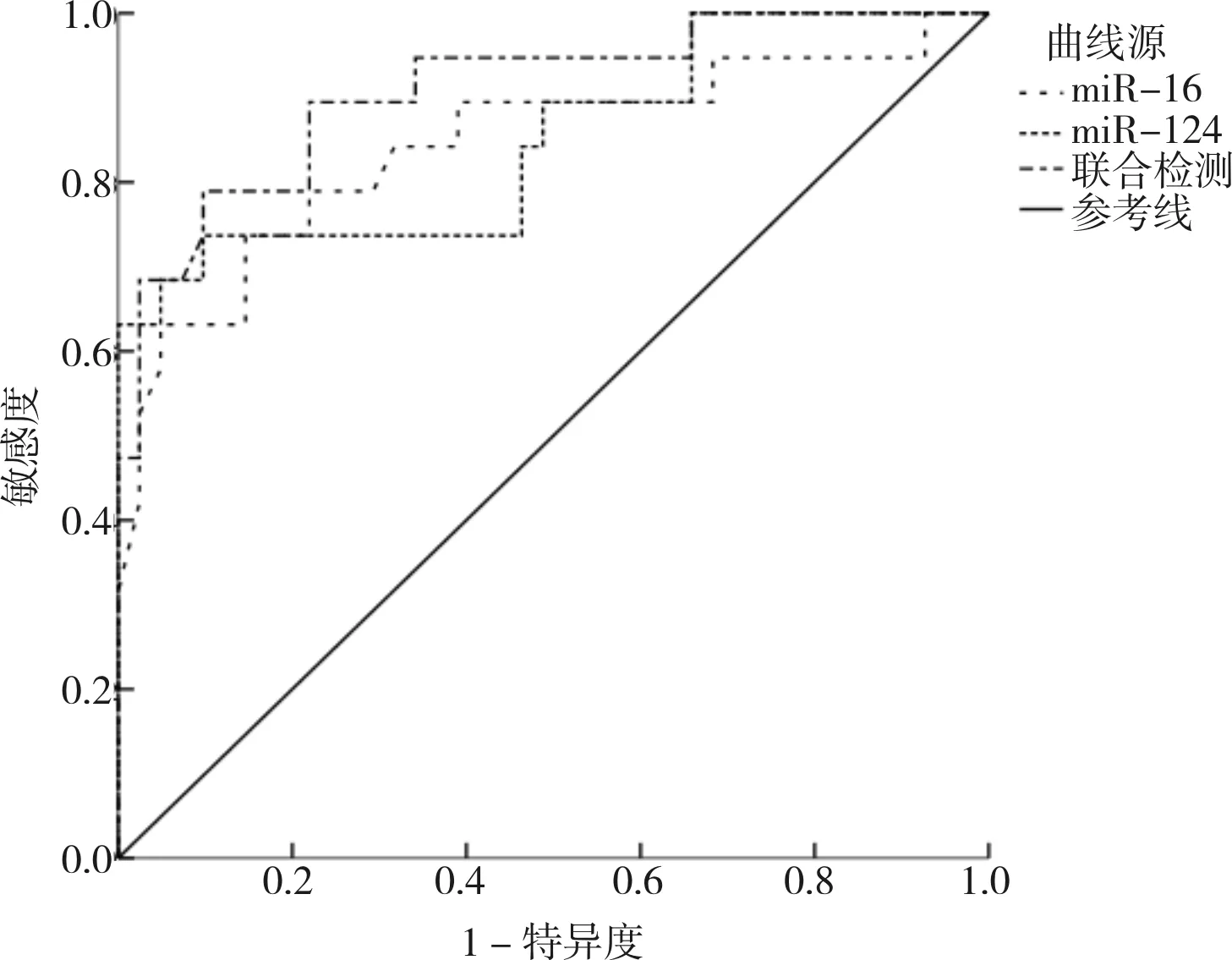
图1 外周血中miR-16、miR-124水平预测抑郁症患者临床疗效的ROC
3 讨论
抑郁症作为精神科常见疾病,病因尚未明确,多认为与生物、环境等因素交互作用有关,疾病早期患者主要有心境低落、思维迟缓等表现,但随着疾病进展,约1/5的抑郁症患者可能会产生自杀观念或行为[13]。研究发现,大部分抑郁症患者经抗抑郁治疗后临床症状可缓解,且能够恢复病前状态,但也有部分患者临床疗效不佳,会出现疾病反复发作情况[14]。因此,明确可能与抑郁症患者临床疗效有关的指标,对指导临床早期干预尤为重要。
miRNA是一种由22~25个核苷酸序列组成的非编码小分子RNA,具有基因调控作用,在脑组织中表达丰富,可维持神经元功能,调节神经可塑性,促进神经再生[15]。有研究指出,miRNA通过调节细胞分化与蛋白质合成及重塑神经元结构,参与抑郁症发生与发展过程[16]。据报道,5-HT表达异常是抑郁症发生的关键,5-HT具有调节情绪、调控神经纤维生长等作用,其表达降低会影响情绪调控,继而导致抑郁症发生[17]。miR-16、miR-124是与5-HT转运体有关的miRNA基因,抗抑郁药物通过作用于中缝核,可增加miR-16表达,减少5-HT转运体表达,且直接将miR-16用于中缝核,可抑制5-HT转运体生成,发挥抗抑郁作用[18]。李桂萍等[19]研究也表明,通过降低大鼠脑脊液miR-16水平,会增加5-HT转运体表达,加重抑郁样行为,推进疾病发展。miR-124作为脑组织中丰富表达的miRNA,其通过降低糖皮质激素受体活性,可阻止Lim激酶1干扰树突生长,抑制脑源性生长因子生长[20]。同时,miR-124可重塑海马神经结构,影响5-HT释放,继而引发抑郁症[21]。相关研究表明,首发抑郁症患者miR-124表达显著增加,且miR-124表达与患者治疗效果密切相关,可作为抑郁症诊断、疗效评估的有效生物学指标[22]。本研究结果发现,疗效良好组患者外周血中miR-16相对表达量显著高于疗效不佳组,miR-124相对表达量显著低于疗效不佳组,说明miR-16、miR-124可能与抑郁症患者临床疗效有关。
本研究logistic回归分析结果显示,miR-16是抑郁症患者临床疗效的保护因子,miR-124是抑郁症患者临床疗效的危险因子,说明随着miR-16表达降低、miR-124表达增加,患者疗效不佳风险增加,这进一步验证了miR-16、miR-124与抑郁症患者临床疗效有关。分析原因可能为:外周血中miR-16表达水平降低、miR-124表达水平升高,会促进5-HT转运体产生,抑制5-HT生成,继而加重抑郁症患者焦虑、抑郁情绪,影响抗抑郁治疗效果,导致临床疗效不佳[23-24]。本研究绘制ROC曲线发现,外周血中miR-16、miR-124相对表达量预测抑郁症患者临床疗效均有一定的预测价值,二者截断值分别取0.045、4.240时,可获得最佳预测价值。因此,对于治疗前外周血中miR-16表达降低、miR-124表达增加的抑郁症患者,临床可考虑在抗抑郁药物治疗基础上增加经颅直流电刺激、心理干预等,以提高整体干预效果,改善患者预后。同时,本研究发现,外周血中miR-16和miR-124相对表达量联合检测预测抑郁症患者临床疗效的AUC、敏感度与各项单独检测比较差异无统计学意义;而特异度显著高于miR-16相对表达量单独检测,未来临床可考虑将二者结合起来观察,提高抑郁症患者整体获益。但本研究并未分析抑郁症患者外周血中miR-16与miR-124的相关性,研究存有局限,未来仍需展开前瞻性研究加以验证。
综上所述,抑郁症患者临床疗效不佳可能受外周血miR-16水平降低、miR-124水平升高影响,临床可于抑郁症患者药物治疗前检测外周血中miR-16、miR-124表达水平,从而辅助评估抑郁症患者临床疗效不佳风险。
