鳗鲡疱疹病毒ORF87基因克隆及其多克隆抗体的制备
2022-05-26陈曦杨金先李英英陈强黄小红宋铁英葛均青
陈曦 杨金先 李英英 陈强 黄小红 宋铁英 葛均青


摘要:【目的】克隆鳗鲡疱疹病毒(Anguillid herpesvirus,AngHV)ORF87基因,分析其序列特征并制备多克隆抗体,为揭示ORF87基因在AngHV侵染过程中的作用机制提供技术支持。【方法】根据GenBank已公布AngHV参考株(NC_013668)的ORF87基因序列设计引物,从AngHV-FJ株基因组中扩增出ORF87基因,构建重组质粒pMD19-ORF87经酶切鉴定和测序验证后,采用Softberry、ProtParam、CDD、TMHMM、SignalP 5.0、PSORT及BepiPred等在线软件进行生物信息学分析;将ORF87基因克隆至pET-32a表达载体上,转化大肠杆菌BL21(DE3)感受态细胞,经IPTG诱导表达后进行SDS-PAGE检测及Western blotting鉴定;以纯化的融合蛋白免疫新西兰大白兔,制备ORF87多克隆抗体。【结果】克隆获得的AngHV-FJ株ORF87基因为2127 bp,与GenBank已发布的参考序列高度同源(相似性为99.72%),仅存在4个碱基突变;其编码蛋白分子量为80.1 kD,理论等电点(pI)为7.62,不稳定系数为42.38,总平均亲水性为-0.271。ORF87蛋白具有蛋白激酶C超家族(PKC-like Superfamily)的保守结构域,但不具信号肽和跨膜结构域;其亚细胞定位可能位于细胞核和细胞质膜,存在19个潜在B细胞抗原表位,即具有良好的免疫原性。AngHV-FJ株ORF87基因可在大肠杆菌中高效表达,表达获得的融合蛋白约100.0 kD,主要以包涵体形式存在;以融合蛋白免疫新西兰大白兔制备获得的ORF87多克隆抗体效价达1∶16000,能特异性识别AngHV的ORF87蛋白。【结论】AngHV-FJ株源ORF87基因经原核表达载体诱导表达获得的融合蛋白ORF87具有Serine/threonine蛋白激酶活性,以其免疫新西兰大白兔制备获得的ORF87多克隆抗体具有高效价,能特异性识别AngHV感染,可作為亚细胞定位及表达时相分析等蛋白特性研究的工具,用于解析ORF87基因在AngHV侵染过程中的作用。
关键词: 鳗鲡疱疹病毒(AngHV);ORF87基因;原核表达;多克隆抗体;免疫原性
中图分类号: S941.41 文献标志码: A 文章编号:2095-1191(2022)02-0538-08
Cloning, prokaryotic expression and polyclonal antibody preparation of Anguillid herpesvirus ORF87
CHEN Xi YANG Jin-xian LI Ying-ying CHEN Qiang HUANG Xiao-hong SONG Tie-ying GE Jun-qing
(1Institute of Biotechnology,Fujian Academy of Agricultural Science, Fuzhou 350003, China; 2 College of Animal Science (College of Bee Science), Fujian Agriculture and Forestry University, Fuzhou 350028, China)
Abstract:【Objective】Anguillid herpesvirus (AngHV) ORF87 was cloned, analyzed on sequence features, and prepared for polyclonal antibody, so as to provide technical support for revealing the role of ORF87 gene on the AngHV infection.【Method】The ORF87 sequence was amplified from the genome of AngHV-FJ strain by PCR with primers based on the AngHV reference strain (NC_013668) in GenBank to construct recombinant plasmid pMD19-ORF87. The gene was verified by restriction enzyme digestion and sequencing. The bioinformatics information was analyzed by online softwares such as Softberry, ProtParam, CDD, TMHMM, SignalP 5.0, PSORT and BepiPred. Then, ORF87 was cloned into the expression vector pET-32a and transformed into Escherichia coli BL21 (DE3) competent cells The transformed E. coli was induced by IPTG, and the protein expression of ORF87 gene was validated by SDS-PAGE and Western blotting analysis. The expressed fusion protein was purified, and used to immunize New Zealand rabbits to prepare anti-ORF87 polyclonal antibody. 【Result】The AngHV-FJ ORF87 was 2127 bp with only four base mutations, which shared high similarity (99.72%) with the reference sequence in GenBank. The molecular weight of its encoded protein was 80.1 KD, the theoretical isoelectric point (PI) was 7.62, the instability coefficient was 42.38, and the total average hydrophilicity was -0.271. ORF87 contained a conserved domain of PKC-like Superfamily, but the protein had no signal peptide and transmembrane domain. The subcellular localization of the protein was predicted to localize on the nucleus and cytoplasmic membrane with good immunogenicity due to 19 potential B-cell antigen epitopes. It was indicated that the AngHV-FJ ORF87 could be highly expressed in E. coli. The fusion protein was expressed at the size of 100 kD and mainly in the form of inclusion body. The prepared rabbit anti-ORF87 polyclonal antibody by fusion protein could specifically recognize AngHV ORF87 with serum titer of 1∶16000. 【Conclusion】The fusion protein ORF87 of AngHV-FJ induced by prokaryotic expression vector has Serine/threonine protein kinase activity. The anti-ORF87 polyclonal antibody obtained by immunizing the rabbits has high titer and specific recognition with AngHV infection. The antibody can be used as a tool to study protein characteristics such as subcellular localization and expression profile, which is helpful to reveal the role of ORF87 gene on the AngHV infection.
Key words: Anguillid herpesvirus(AngHV); ORF87 gene; prokaryotic expression; polyclonal antibody; immunogenicity
Foundation items:Fujian Natural Science Foundation (2019J01109); Public-Interest Scientific Institution Basal Research Fund of Fujian Province (2018R1019-4); “5511”Collaborative Innovation Project of Fujian Academy of Agricultural Sciences (XTCXGC2021013)
0 引言
【研究意义】鳗鲡疱疹病毒(Anguillid herpesvirus,AngHV)隶属于鱼蛙疱疹病毒亚科(Alloherpesviridae)鲤疱疹病毒属(Cyprinivirus),是鳗鲡养殖过程中的主要病原之一,能给其养殖业造成巨大经济损失(杨金先等,2020)。AngHV可造成养殖的欧洲鳗鲡(Anguilla anguilla)和美洲鳗鲡(A. rostrata)暴发脱黏败血综合征,是黑仔和幼鳗阶段的主要传染性病原,其典型临床症状为脱黏、红头和败血等,具发病率高、传染性强及死亡率高等特点(陈强等,2021)。因此,开展AngHV的功能基因研究对快速诊断及科学防控AngHV感染具有重要指导意义。【前人研究进展】AngHV为线性双链DNA病毒,其基因组全长248.5 kb,包括136个开放阅读框(ORF)(van Beurden et al.,2010,2011)。自首次发现AngHV以来,已有诸多学者针对其基因组(van Beurden et al.,2010;Donohoe et al.,2021)、结构蛋白(van Beurden et al.,2011,2013)及转录组(van Beurden et al.,2012)等进行大量研究,不仅明确了该病毒与鲤科疱疹病毒(Cyprinid herpesviruses)的近源性,还分析了病毒基因的特征、转录剪切方式、病毒结构蛋白及预测部分蛋白在病毒侵染中的潜在作用,为建立免疫学诊断方法、防控策略研究及疫苗开发等奠定了理论基础。流行病学调查研究显示,AngHV在全球多个地区的养殖鳗鲡和野生鳗鲡中广泛存在,且可能是造成野生鳗鲡资源锐减的主要因素(Haenen et al.,2002;Jakob et al.,2009;Bandín et al.,2014;Kempter et al.,2014)。在我国,已从养殖鳗鲡病料中成功分离鉴定出AngHV福建株(AngHV-FJ)(葛均青等,2014),并建立PCR及实时荧光定量PCR等检测方法(葛均青等,2012;李英英等,2021);此外,通过分析AngHV-FJ株的致病性、生物学和理化特性等基本特征(杨金先等,2020;陈强等,2021),为后续开展AngHV的入侵机制研究奠定了基础。【本研究切入点】病毒基因组功能预测显示AngHV的ORF87可能具有磷酸蛋白激酶活性(van Beurden et al.,2010),而转录时相分析证实ORF87基因为病毒的早期基因(van Beurden et al.,2013),其编码的激酶可能在调控病毒入侵、复制及释放等过程中发挥重要作用(Schang et al.,2006),但至今未见AngHV ORF87基因克隆及其多克隆抗体制备的研究报道。【拟解决的关键问题】克隆AngHV-FJ株ORF87基因,通过构建高效表达的原核表达载体以获得高纯度融合蛋白,并制备特异性ORF87多克隆抗体,为揭示ORF87基因在AngHV侵染过程中的作用机制提供技术支持。
1 材料与方法
1. 1 试验材料
AngHV-FJ株及鳗鲡卵巢细胞系(EO)、pET-32a表达载体、大肠杆菌(Escherichia coli)DH5α感受态细胞及BL21(DE3)感受态细胞均由福建省农业科学院生物技术研究所保存提供。DNA胶回收试剂盒及质粒小量抽提试剂盒购自生工生物工程(上海)股份有限公司,pMD19-T载体及T4 DNA连接酶购自宝日医生物技术(北京)有限公司。
1. 2 试验方法
1. 2. 1 AngHV-FJ株扩繁及基因组DNA提取 EO细胞以含10%胎牛血清的L-15培养基(Hyclone)在26 ℃生化培养箱中培养,当EO细胞铺满单层后按感染复数(Multiplicity of infection,MOI)为1.0的比例接种AngHV-FJ株,待大部分细胞出现细胞病变(CPE)时收集细胞,利用PureLinkTM Viral RNA/DNA Mini Kit (Invitrogen)提取病毒基因组DNA,-20 ℃保存备用。
1. 2. 2 ORF87基因克隆 根据AngHV参考株的基因组序列(NC_013668),设计扩增ORF87基因的特异引物,并分别引入酶切位点Hind III和Xho I,引物序列为ORF87-F:5'-AAGCTTATGTTGCACATGTT GCTT-3'和ORF87-R:5'-CTCGAGTCAGGCGTCAT AAGAGGC-3'(下劃线处为酶切位点)。以提取的AngHV-FJ株基因组DNA为模板,进行ORF87基因PCR扩增。PCR扩增产物电泳后使用DNA胶回收试剂盒进行回收纯化,并克隆至pMD19-T载体上;以质粒小量抽提试剂盒提取质粒,经PCR鉴定和双酶切鉴定后委托生工生物工程(上海)股份有限公司测序,验证重组质粒pMD19-ORF87是否构建成功。
1. 2. 3 生物信息学分析 利用NCBI中的BLAST对扩增获得的ORF87基因序列进行比对分析,采用Softberry进行基因转录启动子分析,运用ExPASy中的ProtParam预测编码蛋白理化性质,使用CDD、TMHMM、SignalP 5.0分别预测编码蛋白的保守结构域、跨膜结构域及信号肽,利用PSORT预测编码蛋白亚细胞定位,并以BepiPred预测编码蛋白的B细胞抗原表位。
1. 2. 4 原核表达质粒构建 采用Hind III/Xho I双酶切重组质粒pMD19-ORF87和pET-32a表达载体,利用DNA胶回收试剂盒纯化回收目的片段,经T4 DNA连接酶连接后转化DH5α感受态细胞,提取质粒进行双酶切鉴定,以检验原核表达质粒pET-32a-ORF87是否构建成功。
1. 2. 5 融合蛋白诱导表达及Western blotting鉴定
以原核表达质粒pET-32a-ORF87转化BL21(DE3)感受态细胞,挑选单菌落接种至含100 μg/mL氨苄青霉素(Ampicillin)的LB液体培养基中,37 ℃培养过夜,次日按1∶100的比例接种至新鲜的LB液体培养基中,培养至吸光值(OD)为0.6~0.8时加入终浓度1 mmol/L的IPTG,37 ℃继续培养12 h,收集菌体,经超声波破碎后进行SDS-PAGE检测分析。
蛋白样品经SDS-PAGE检测后,以半干法转印至PVDF膜上,以含5%脱脂奶粉的TBST缓冲液37 ℃封闭1.0 h;经TBST缓冲液洗膜后,与1∶3000倍稀释的鼠抗His-Tag单克隆抗体在室温下共孵育1.5 h;TBST缓冲液洗膜,再与1∶5000倍稀释的HRP标记羊抗鼠IgG在室温下共孵育1.0 h;TBST缓冲液洗膜,采用Super ECL Plus化学发光液(北京兰博利德商贸有限公司)显色,并以上海勤翔ChemiScope 6000 Touch成像系统进行拍照。
1. 2. 6 融合表达蛋白纯化及多克隆血清制备 收集表达菌株以超声波破碎,经SDS-PAGE检测分离及染色后将含目的条带的凝胶切下,置于-80 ℃预冷的研钵中研磨,采用PAGE-胶蛋白微量回收试剂盒进行回收,蛋白样品-80 ℃保存备用。选取2只体重约2 kg的健康新西兰大白兔,耳静脉采血2.0 mL为阴性对照。以制备的纯化融合蛋白为抗原,按1∶1的比例与弗氏完全佐剂(FCA)充分乳化后,在新西兰大白兔的背部、腋窝及腹股沟进行多点皮下注射(1 mL/只)。在首次免疫后第14和28 d,分别取纯化融合蛋白与弗氏不完全佐剂(FIA)按1:1的比例充分乳化后注射新西兰大白兔,在首次免疫后第42 d取纯化融合蛋白进行加强免疫。末次免疫1周后大量采血,离心收集血清,-40 ℃保存备用。
1. 2. 7 血清抗体效价测定及特异性分析 采用间接ELISA测定制备的血清抗体效价,具体步骤:以纯化融合蛋白ORF87包被96孔酶标板,抗原含量为10 μg/mL,每孔50 μL;包被液为空白对照;以制备获得的兔抗血清为一抗,以免疫前兔血清为阴性对照,按起始稀释度为1∶1000进行2倍等比稀释,每个样品重复3次;以HRP标记羊抗兔IgG为二抗,OPD显色后采用酶标仪测定OD492 nm。取感染AngHV-FJ株的EO细胞,以正常EO细胞为对照,HRP标记羊抗兔IgG为二抗,通过Western blotting对制备获得的兔抗血清进行特异性检测。
2 结果与分析
2. 1 AngHV-FJ株ORF87基因克隆结果
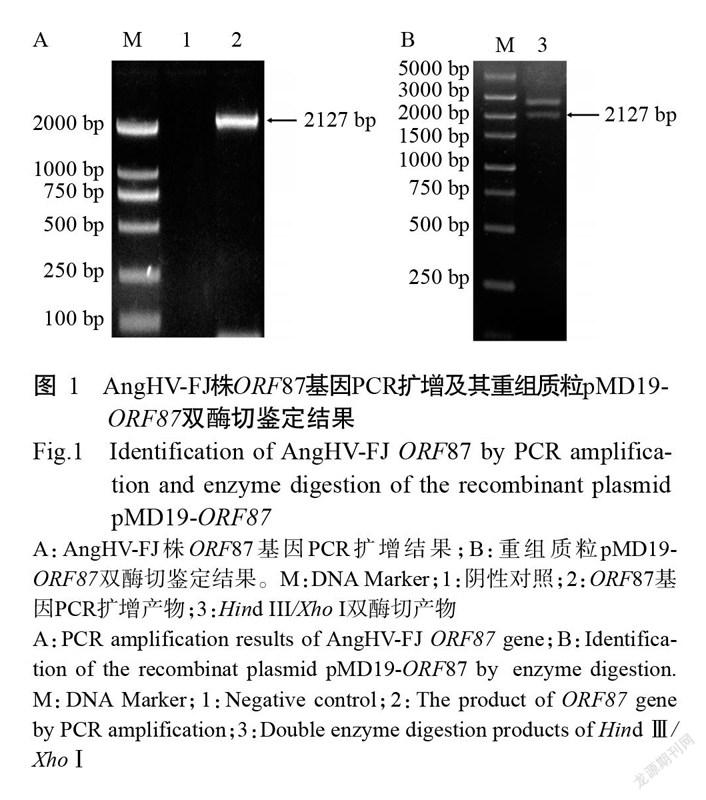
利用设计的引物对ORF87-F/ORF87-R从AngHV-FJ株基因组中扩增出约2100 bp的特异性条带(图1-A),克隆至pMD19-T载体后提取质粒进行双酶切鉴定(图1-B),经测序验证ORF87基因为2127 bp,即成功克隆获得AngHV-FJ株的ORF87基因,也说明重组质粒pMD19-ORF87构建成功。
2. 2 AngHV-FJ株ORF87基因生物信息学分析结果
BLAST比对分析结果表明,AngHV-FJ株ORF87基因序列与AngHV-1株ORF87基因序列(NC_013668)的相似性为99.72%,其碱基突变发生在ORF87基因第43、56、57和84 bp处(图2),对应的推导氨基酸序列变化分别为L?I、V?E和C?W。Softberry预测结果表明,在ORF87基因起始密码子上游第61和101 bp处分别存在2个基因转录启动子(CATTCA和TTCACA),在终止密码子TGA下游38 bp处存在转录因子ihf的潜在结合位点,其序列为TGTAAGAA;在下游第96 bp处存在poly(A)尾,其序列为AATAA AAA。
ProtParam预测结果顯示,AngHV-FJ株ORF87基因编码蛋白分子量为80.1 kD,理论等电点(pI)为7.62,属于弱碱性蛋白;不稳定系数为42.38,总平均亲水性为-0.271,为非常不稳定的亲水性蛋白。CDD预测结果显示,ORF87蛋白在氨基酸序列第135~330位和第442~608位存在蛋白激酶C超家族(PKC-like superfamily)的保守结构域,故推测其具有Serine/threonine蛋白激酶活性。ORF87蛋白不存在跨膜结构域,无信号肽结构,其亚细胞定位可能位于细胞核和细胞质膜(图3)。BepiPred预测结果(表1)显示,ORF87蛋白存在19个潜在B细胞抗原表位,即具有良好的免疫原性。
2. 3 融合蛋白ORF87表达情况
重组质粒pMD19-ORF87经Hind III/Xho I双酶切后,与pET-32a表达载体连接,构建获得的原核表达质粒以Hind III/Xho I双酶切进行验证,结果获得约2100 bp的特异性条带(图4),表明成功构建获得原核表达质粒pET-32a-ORF87。以原核表达质粒pET-32a-ORF87转化BL21(DE3)感受态细胞,经IPTG诱导表达后进行SDS-PAGE检测,结果(图5-A)显示,与未经IPTG诱导的全菌蛋白相比,含pET-32a表达载体的诱导菌体在20.0 kD处有明显的蛋白条带,而含原核表达质粒pET-32a-ORF87的诱导菌体在约100.0 kD处有明显的蛋白条带。Western blotting鉴定结果(图5-B)表明,含pET-32a表达载体的诱导菌体可被His-Tag单克隆抗体检测到20.0 kD的蛋白条带,而含原核表达质粒pET-32a-ORF87的诱导菌体可被His-Tag单克隆抗体检测到约100.0 kD的蛋白条带,说明诱导表达获得的融合蛋白ORF87与预期结果一致,即成功实现AngHV-FJ株ORF87基因在BL21(DE3)感受态细胞中的融合表达。
2. 4 融合蛋白ORF87纯化结果
SDS-PAGE检测结果(图6-A)显示,融合蛋白ORF87在BL21(DE3)感受态细胞中的表达主要以包涵体形式存在。以切胶后纯化方式收集诱导表达的融合蛋白条带,回收的融合蛋白进行SDS-PAGE检测,结果(图6-B)显示,回收获得的融合蛋白与ORF87蛋白大小一致,表明成功获得高纯度的融合蛋白ORF87。
2. 5 兔抗ORF87多克隆抗体制备
以纯化融合蛋白ORF87免疫新西兰大白兔制备ORF87多克隆抗体(兔抗ORF87血清),ELISA检测结果显示其抗体效价为1∶16000。进一步利用制备获得的ORF87多克隆抗体对AngHV-FJ株感染的EO细胞进行Western blotting鉴定,结果(图7)显示,感染AngHV-FJ株的EO细胞出现约100.0 kD的特异性条带,而正常EO细胞未出现对应的条带,表明备获得的ORF87多克隆抗体能特异性识别AngHV的ORF87蛋白。
3 讨论
脱黏败血综合征是危害我国养殖欧洲鳗鲡和美洲鳗鲡的主要传染病,自鳗鲡规模化养殖以来就有发生,给鳗鲡养殖业造成巨大经济损失(杨金先等,2020)。本课题组的前期研究结果表明,AngHV是脱黏败血综合征的致病性病原(陈强等,2021),且具有高度的宿主细胞侵染专一性,仅在鳗鲡源细胞系内增殖及稳定传代,非鳗鲡来源的细胞系均不支持AngHV的复制与增殖(杨金先等,2020),与鲤疱疹病毒Ⅱ型(CyHV-2)和锦鲤疱疹病毒(CyHV-3)相似(Hanson et al.,2011;马杰等,2016)。由于疱疹病毒的宿主嗜性依赖于病毒与细胞间的相互作用,而病毒编码的蛋白激酶在此过程中发挥重要作用(Prichard,2009;Lee and Chen,2010;南星羽等,2021)。因此,阐明AngHV的宿主侵染机理则赖于对AngHV编码蛋白激酶的深入研究。
本研究通過克隆AngHV-FJ株ORF87基因,并进行生物信息学分析,结果显示,AngHV-FJ株ORF87基因与GenBank已发布的参考序列高度同源(相似性为99.72%),仅存在4个碱基突变,其编码蛋白不具信号肽和跨膜结构域,可能在细胞核或细胞质中发挥作用,与PSORT的亚细胞定位预测结果一致。此外,ORF87蛋白具有PKC-like Superfamily蛋白家族的保守结构域,与已发现的疱疹病毒蛋白激酶结构特征(Marschall et al.,2011;Milbradt et al.,2018)一致。此类磷酸蛋白激酶在疱疹病毒中广泛存在,其主要功能是对病毒和宿主细胞的底物进行磷酸化,进而影响病毒DNA复制、病毒粒子组装及出芽等(Li et al.,2012;Chang et al.,2015)。本研究在成功克隆获得AngHV-FJ株ORF87基因的基础上,构建原核表达质粒pET-32a-ORF87,通过在大肠杆菌中诱导表达可获得高纯度的融合蛋白ORF87,然后以纯化的融合蛋白ORF87免疫新西兰大白兔制备ORF87多克隆抗体,ELISA检测显示其抗体效价为1∶16000,具有高效价,可特异性识别AngHV感染EO细胞,识别蛋白约100.0 kD,远高于预期的蛋白分子量(80.0 kD),故推测ORF87基因存在翻译后修饰,但具体原理有待进一步探究。在后续研究中,可利用制备获得的ORF87多克隆抗体,通过亚细胞定位分析及互作蛋白筛选等深入解析ORF87基因在AngHV侵染过程中的作用。
4 结论
经原核表达载体诱导表达获得的AngHV-FJ株源融合蛋白ORF87具有Serine/threonine蛋白激酶活性,以其免疫新西兰大白兔制备获得的ORF87多克隆抗体具有高效价,能特异性识别AngHV感染,可作为亚细胞定位及表达时相分析等蛋白特性研究的工具,用于解析ORF87基因在AngHV侵染过程中的作用。
参考文献:
陈强,李英英,杨金先,宋铁英,葛均青. 2021. 鳗鲡疱疹病毒对欧洲鳗鲡的致病性[J]. 水产学报,45(6):940-947. [Chen Q,Li Y Y,Yang J X,Song T Y,Ge J Q. 2021. Pathogenicity of Anguillid herpesvirus to Anguilla anguilla[J]. Journal of Fisheries of China,45(6):940-947.] doi:10.11964/jfc.20200812370.
葛均青,杨金先,龚晖,林天龙. 2014. 鳗鲡疱疹病毒的分离与鉴定[J]. 水产学报,38(9):1579-1583. [Ge J Q,Yang J X,Gong H,Lin T L. 2014. Isolation and identification of a herpesvirus from cultured European eels Anguilla anguilla in China[J]. Journal of Fisheries of China,38(9):1579-1583.] doi:10.3724/SP.J.1231.2014.49163.
葛均青,杨金先,李友娟,陈强,林天龙. 2012. 鳗鲡病毒性疾病病料中鳗鲡疱疹病毒的PCR检测[J]. 福建农业学报,27(9):961-964. [Ge J Q,Yang J X,Li Y J,Chen Q,Lin T L. 2012. Polymerase Chain reaction for the detection of Anguillid herpesvirus in eel viral disease samples[J]. Fujian Journal of Agricultural Sciences,27(9):961-964.] doi:10.3969/j.issn.1008-0384.2012.09.010.
李英英,楊金先,陈曦,陈强,宋铁英,葛均青. 2021. 鳗鲡疱疹病毒SYBR GreenⅠ实时荧光定量PCR检测方法的建立与应用[J]. 水产学报,45(5):769-777. [Li Y Y,Yang J X,Chen X,Chen Q,Song T Y,Ge J Q. 2021. Establishment and application of SYBR Green Ⅰ real-time fluorescence quantitative PCR for detection of Anguillid herpesvirus[J]. Journal of Fisheries of China,45(5):769-777.] doi:10.11964/jfc.20200712326.
马杰,周勇,范玉顶,刘文枝,江南,曾令兵. 2016. 鲤疱疹病毒Ⅱ型的理化及生物学特性和超微形态发生[J]. 水产学报,40(3):475-483. [Ma J,Zhou Y,Fan Y D,Liu W Z,Jiang N,Zeng L B. 2016. The physical-chemical and biological characteristics of Cyprinid herpesvirus 2 and its ultrastructural morphogenesis in vitro[J]. Journal of Fishe-ries of China,40(3):475-483.] doi:10.11964/jfc.20150 609918.
南星羽,冯梓钊,费越越,余路,罗扬,许丹. 2021. II型鲤疱疹病毒ORF6多克隆抗体的制备与鉴定[J]. 南方农业学报,52(9):2562-2571. [Nan X Y,Feng Z Z,Fei Y Y,Yu L,Luo Y,Xu D. 2021. Preparation and identification of polyclonal antibody against cyprinid herpesvirus-2 ORF6[J]. Journal of Southern Agriculture,52(9):2562-2571.] doi:10.3969/j.issn.2095-1191.2021.09.027.
杨金先,陈强,李英英,宋铁英,葛均青. 2020. 鳗鲡疱疹病毒的生物学及理化特性[J]. 水产学报,44(9):1435-1440. [Yang J X,Chen Q,Li Y Y,Song T Y,Ge J Q. 2020. Bio-logical and physicochemical characteristics of Anguillid herpesvirus[J]. Journal of Fisheries of China,44(9):1435- 1440.] doi:10.11964/jfc.20191112056.
Bandín I,Souto S,Cutrín J M,López-Vázquez C,Olveira J G,Esteve C,Alcaide E,Dopazo C P. 2014. Presence of viruses in wild eels Anguilla anguilla L,from the Albufera Lake(Spain)[J]. Journal of Fish Diseases,37(7):597-607. doi:10.1111/jfd.1392.
Chang C W,Lee C P,Su M T,Tsai C H,Chen M R. 2015. BGLF4 kinase modulates the structure and transport pre-ference of the nuclear pore complex to facilitate nuclear import of Epstein-Barr virus lytic proteins[J]. Journal of Virology,89(3):1703-1718. doi:10.1128/JVI.02880-14.
Donohoe O,Zhang H Y,Delrez N,Gao Y,Suárez N M,Davison A J,Vanderplasschen A. 2021. Genomes of Anguillid herpesvirus 1 strains reveal evolutionary disparities and low genetic diversity in the genus Cyprinivirus[J]. Microorganisms,9(5):998. doi:10.3390/microorganisms9050998.
Haenen O L M,Dijkstra S G,van Tulden P W,Davidse A,van Nieuwetadt A P,Wagenaar F,Wellenberg G J. 2002. Herpesvirus anguillae(HVA) isolations from disease outbreaks in cultured European eel,Anguilla anguilla in the Netherlands since 1996[J]. Bulletin of the European Association of Fish Pathologists,22(4):247-257.
Hanson L,Dishon A,Kotler M. 2011. Herpesviruses that infect fish[J]. Viruses,3(11):2160-2191. doi:10.3390/v3112160.
Jakob E,Neuhaus H,Steinhagen D,Luckhardt B,Hanel R. 2009. Monitoring of Herpesvirus anguillae(HVA) infections in European eel,Anguilla anguilla (L.),in Northern Germany[J]. Journal of Fish Diseases,32(6):557-561. doi:10.1111/j.1365-2761.2009. 01009.x.
Kempter J,Hofsoe P,Panicz R,Bergmann S M. 2014. First detection of Anguillid herpesvirus 1(AngHV1) in European eel(Anguilla anguilla) and imported American eel (Anguilla rostrata) in Poland[J]. Bulletin-European Association of Fish Pathologists,34(3):87-94.
Lee C P,Chen M R. 2010. Escape of herpesviruses from the nucleus[J]. Reviews in Medical Virology,20(4):214-230. doi:10.1002/rmv.643.
Li R F,Wang L Y,Liao G L,Guzzo C M,Matunis M J,Zhu H,Hayward S D. 2012. SUMO binding by the Epstein-Barr virus protein kinase BGLF4 is crucial for BGLF4 function[J]. Journal of Virology,86(10):5412-5421. doi:10.1128/JVI.00314-12.
Marschall M,Feichtinger S,Milbradt J. 2011. Chapter 4—Regulatory roles of protein kinases in cytomegalovirus replication[J]. Advances in Virus Research,80:69-101. doi:10.1016/B978-0-12-385987-7.00004-X.
Milbradt J,Sonntag E,Wagner S,Strojan H,Wangen C,Rovis T L,Lisnic B,Jonjic S,Sticht H,Britt W J,Schl?tzer-Schrehardt U,Marschall M. 2018. Human cytomegalovirus nuclear capsids associate with the core nuclear egress complex and the viral protein kinase pUL97[J]. Viruses,10(1):35. doi:10.3390/v10010035.
Prichard M N. 2009. Function of human cytomegalovirus UL97 kinase in viral infection and its inhibition by maribavir[J]. Reviews in Medical Virology,19(4):215-229. doi:10.1002/rmv.615.
Schang L M,Vincent M R S,Lacasse J J. 2006. Five years of progress on cyclin-dependent kinases and other cellular proteins as potential targets for antiviral drugs[J]. Antiviral Chemistry and Chemotherapy,17(6):293-320. doi:10. 1177/095632020601700601.
van Beurden S J V,Bossers A,Voorbergen-Laarman M H A,Haenen O L M,Peters S,Abma-Henkens M H C,Peeters B P H,Rottier P J M,Engelsma M Y. 2010. Complete genome sequence and taxonomic position of Anguillid herpesvirus 1[J]. Journal of General Virology,91(4):880-887. doi:10.1099/vir.0.016261-0.
van Beurden S J V,Gatherer D,Kerr K,Galbraith J,Herzyk P,Peeters B P H,Rottier P J M,Engelsma M Y,Davison A J. 2012. Anguillid herpesvirus 1 transcriptome[J]. Journal of Virology,86(18):10150-10161. doi:10.1128/JVI. 01271-12.
van Beurden S J V,Leroy B,Wattiez R,Haenen O L,Boeren S,Vervoort J J,Peeters B P H,Rottier P J M,Engelsma M Y,Vanderplasschen A F. 2011. Identification and locali-zation of the structural proteins of Anguillid herpesvirus 1[J]. Veterinary Research,42(1):105. doi:10.1186/1297-9716-42-105.
van Beurden S J V,Peeters B P H,Rottier P J M,Davison A J,Engelsma M Y. 2013. Genome-wide gene expression analysis of Anguillid herpesvirus 1[J]. BMC Genomics,14(1):83. doi:10.1186/1471-2164-14-83.
(責任编辑 兰宗宝)
