乳腺癌患者血清三叶因子1水平及其与乳腺癌新辅助化疗效果和预后的关系▲
2022-05-25张志锋孙业富沈预程汤劲松
张志锋 孙业富 沈预程 汤劲松
(1 扬州市职业大学医学院,江苏省扬州市 225012,电子邮箱:707209832@qq.com;2 南通大学附属海安医院肿瘤科,江苏省南通市 226600;3 江苏省苏北人民医院普外科,扬州市 225009)
乳腺癌是一种严重危害女性健康和生命的恶性肿瘤。在局部晚期乳腺癌的治疗中,新辅助化疗是常用的标准治疗手段之一。但有研究表明,新辅助化疗并非对所有的乳腺癌患者都有效[1]。因此,寻找预测化疗敏感性的指标对于乳腺癌新辅助化疗疗效的评估具有重要意义。三叶因子1(trefoil factor 1,TFF1)是一种胃肠道激素,其主要由消化道黏液细胞分泌[2-3]。有研究发现,TFF1在结肠癌、胃癌、乳腺癌等多种实体肿瘤组织中呈高表达水平,其参与了肿瘤的形成及侵袭行为,且与患者的临床预后密切相关[4-5]。然而,关于血清TFF1水平在乳腺癌中的研究仍较少,其对乳腺癌治疗效果判定和预后评估的研究也鲜有报告。因此,本研究检测乳腺癌患者的血清TFF1水平,探讨其在乳腺癌新辅助化疗效果和预后评估中的作用。
1 资料与方法
1.1 临床资料 选取2012年3月至2014年3月在南通大学附属海安医院接受治疗的90例乳腺癌患者(乳腺癌组),均为女性,年龄(51.4±12.5)岁,均为单侧浸润性乳腺癌。纳入标准:参照《世界卫生组织2012年版乳腺肿瘤组织学分类标准》[6],病理诊断为乳腺癌;未接受除本研究外的其他治疗;无其他系统疾病;治疗前资料(如化验报告、影像学检查资料和病理报告等)及随访资料完整。排除标准:妊娠期或哺乳期乳腺癌患者;双侧乳腺癌患者;自身免疫性疾病或活动性感染患者;合并其他恶性肿瘤患者;合并其他严重疾病患者。选取同期在南通大学附属海安医院诊断为乳腺良性疾病(乳腺纤维腺瘤和/或乳腺囊性增生症)的30例患者(乳腺良性疾病组),均为女性,年龄(52.6±12.3)岁,经组织病理学确诊为乳腺良性疾病,肝、肺、肾功能均正常,无恶性肿瘤疾病史。选取同期在南通大学附属海安医院体检的健康者30例(正常对照组),均为女性,年龄(51.7±11.4)岁,均无肾脏、肝脏、乳腺及其他系统疾病。3组研究对象的年龄差异无统计学意义(P>0.05),具有可比性。本研究获得南通大学附属海安医院医学伦理委员会批准,所有研究对象均签署知情同意书。
1.2 血清TFF1水平检测方法 分别采集正常对照组研究对象体检时,以及乳腺良性疾病组患者、乳腺癌组患者治疗前后的静脉血4 mL,3 000 r/min离心5 min后获取血清,置于-80℃冰箱保存。采用酶联免疫吸附法测定血清TFF1水平,试剂盒采购于Abcam公司(批号:ab277718),严格按说明书进行操作。采用受试者工作特征(receiver operating characteristic,ROC)曲线确定血清TFF1水平诊断乳腺癌的最佳临界点为1.09 ng/mL,以治疗前血清TFF1水平≥1.09 ng/mL的乳腺癌组患者定为高水平组,血清TFF1水平<1.09 ng/mL的乳腺癌组患者定为低水平组[7]。
1.3 治疗方法 90例乳腺癌患者中,71例行改良根治术,19例行保乳术。对临床分期为Ⅱ~Ⅲ期的69例患者在术前进行新辅助化疗,方案为多西他赛75 mg/m2+多柔比星50 mg/m2+环磷酰胺500 mg/m2,均为化疗周期的第1天使用,21 d为1个周期(共治疗4~8个周期),化疗完成后2~4周内实施手术;对于人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性的患者,术前合用曲妥珠单抗,剂量为首次8 mg/kg,之后改为6 mg/kg。
1.4 新辅助化疗的疗效评估 在连续两个化疗周期后和手术前分别进行一次疗效评估,参照实体瘤疗效评价标准1.1版[8]进行评估,分为完全缓解、部分缓解、疾病稳定和疾病进展。依据手术前化疗效果将完全缓解、部分缓解者纳入有效组,疾病稳定、疾病进展者纳入无效组,并于化疗结束后检测这69例乳腺癌患者的血清TFF1水平。
1.5 收集临床资料 包括所有研究对象的性别、年龄,以及乳腺癌患者的临床分期、肿瘤大小、淋巴结转移情况、病理学分级、癌组织的免疫组化检测结果[雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、HER2]。其中,临床分期参照美国癌症联合会第8版原发肿瘤-区域淋巴结-远处转移(tumor-node-metastasis,TNM)分期标准[9],肿瘤大小通过影像学检查进行评估,病理学分级根据Nottingham分级系统[10]进行判断,通过原发灶和转移灶穿刺病理判断淋巴结转移情况。
1.6 随访 对乳腺癌患者进行随访,随访开始时间为首次手术治疗日期,随访结束时间为2019年3月30日。随访采用门诊定期复查和电话回访相结合的方式,随访时间范围为7.3~60.0个月,中位时间为41.7个月,随访终点为患者因乳腺癌死亡,死于其他原因记为截尾值。
1.7 统计学分析 采用SPSS 19.0软件进行统计学分析。呈正态分布的计量资料以(x±s)表示,两组间比较采用两独立样本t检验或配对t检验,多组间比较采用方差分析,进一步两两比较采用LSD-t检验;采用Kaplan-Meier法进行生存分析,生存率的比较采用log-rank检验;采用单因素和多因素Cox回归模型分析影响乳腺癌患者预后的相关因素;采用MedCalc软件绘制ROC曲线。以P<0.05为差异有统计学意义。
2 结 果
2.1 3组研究对象血清TFF1水平的比较 乳腺癌组治疗前的血清TFF1水平均高于乳腺良性疾病组治疗前水平和正常对照组水平(均P<0.05),而乳腺良性疾病组与正常对照组之间差异无统计学意义(P>0.05),见表1。
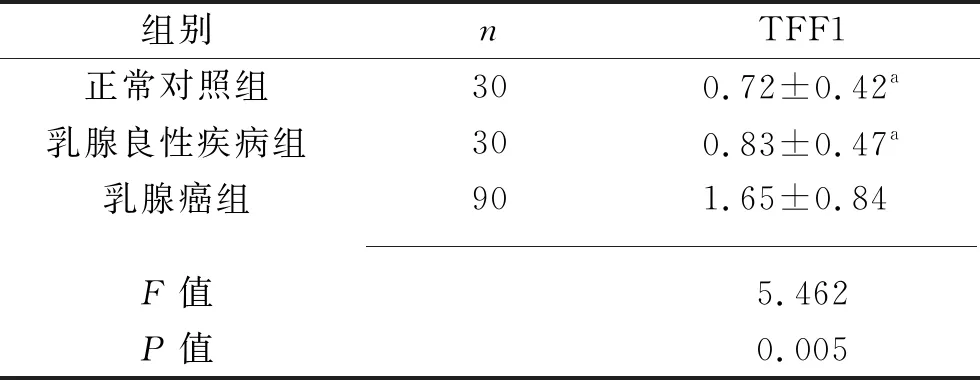
表1 3组研究对象血清TFF1水平的比较(x±s,ng/mL)
2.2 不同临床和病理特征乳腺癌患者血清TFF1水平的比较 不同临床分期、病理学分级患者血清TFF1水平差异有统计学意义(均P<0.05),其中临床分期Ⅲ期的乳腺癌患者的血清TFF1水平高于临床分期Ⅰ期患者,病理学分级Ⅲ期乳腺癌患者的血清TFF1水平高于病理学分级Ⅰ+Ⅱ期患者(均P<0.05)。不同年龄、肿瘤大小、淋巴结转移情况,以及ER、PR、HER2状态乳腺癌患者之间血清TFF1水平的比较,差异均无统计学意义(均P>0.05)。见表2。
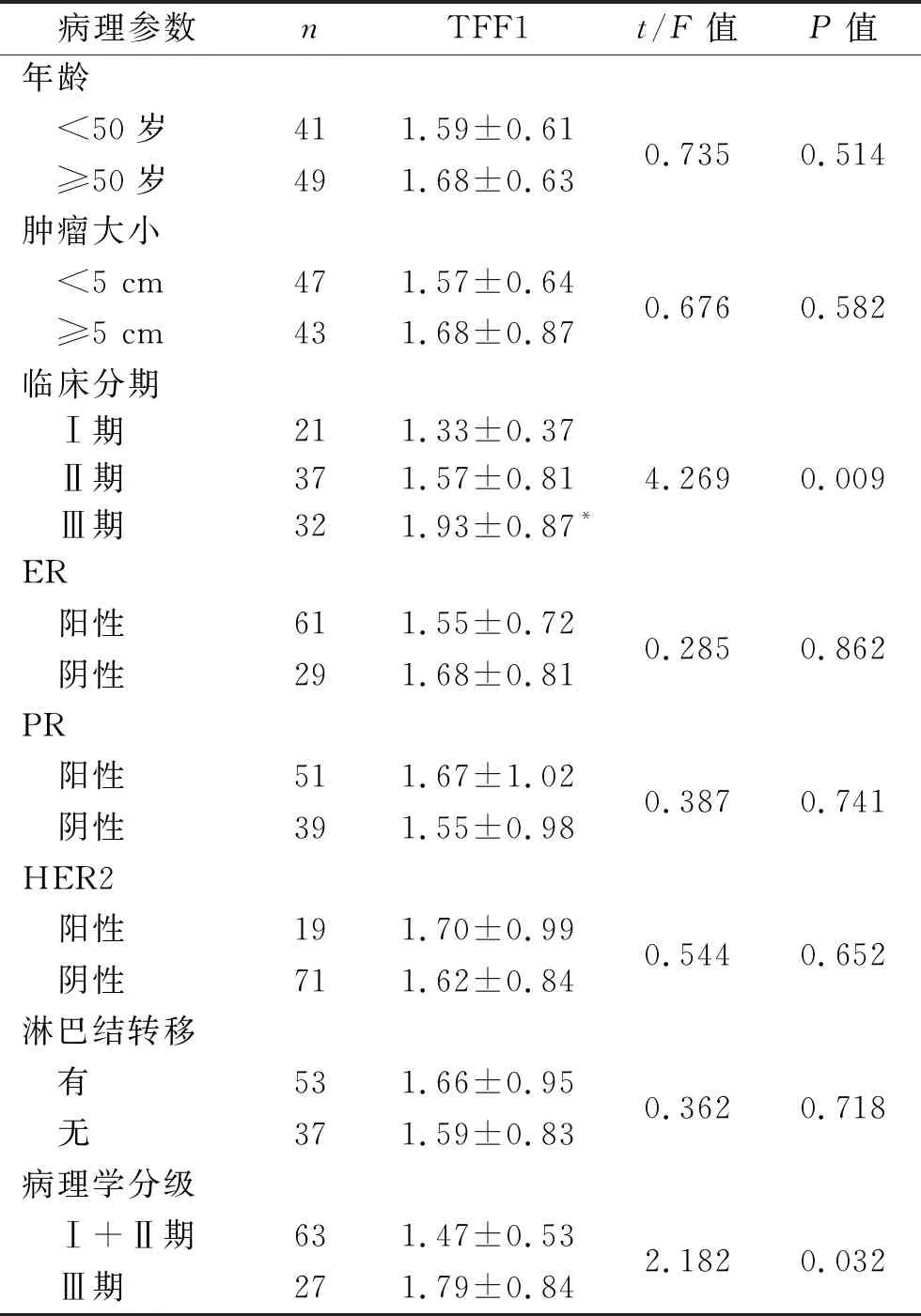
表2 不同临床和病理特征乳腺癌患者血清TFF1水平的比较(x±s,ng/mL)
2.3 乳腺癌患者新辅助化疗前后的血清TFF1水平的比较 69例临床分期Ⅱ~Ⅲ期的乳腺癌患者行新辅助化疗后的血清TFF1水平为(1.35±0.49)ng/mL,低于化疗前的(1.72±0.81)ng/mL(t=3.247,P=0.002)。
2.4 不同新辅助化疗效果的乳腺癌患者血清TFF1水平的比较 分别有32例、37例患者纳入有效组与无效组。两组化疗前血清TFF1水平差异无统计学意义(P>0.05);化疗后,有效组血清TFF1水平均低于化疗前和无效组(均P<0.05),而无效组化疗前后血清TFF1水平比较差异无统计学意义(P>0.05)。见表3。

表3 不同新辅助化疗效果的乳腺癌患者血清TFF1水平的比较(x±s,ng/mL)
2.5 血清TFF1水平与乳腺癌患者5年生存率的关系 90例乳腺癌患者中,高水平组32例,随访期间死亡12例,中位生存期为37.6个月,5年生存率为62.5%;低水平组58例,随访期间死亡10例,中位生存期为48.7个月,5年生存率为82.8%。低水平组5年生存率高于高水平组(χ2=5.377,P=0.021)。见图1。

图1 不同血清TFF1水平乳腺癌患者的Kaplan-Meier生存曲线
2.6 乳腺癌患者生存情况的影响因素 将年龄、肿瘤大小、病理学分级、淋巴结转移、临床分期、免疫组化指标(ER、PR、HER2)阳性情况,以及治疗前血清TFF1水平作为自变量(变量赋值见表4),将乳腺癌患者的生存情况作为因变量(变量赋值见表4),进行Cox单因素回归分析,结果显示病理学分级、淋巴结转移情况、临床分期和治疗前血清TFF1水平可能与乳腺癌患者生存情况相关(均P<0.05),见表5。再将上述因素纳入多因素 Cox回归分析,结果显示淋巴结转移情况、临床分期与治疗前血清TFF1水平与乳腺癌患者生存情况相关(均P<0.05),见表6。

表4 变量赋值情况

表5 单因素Cox回归分析结果
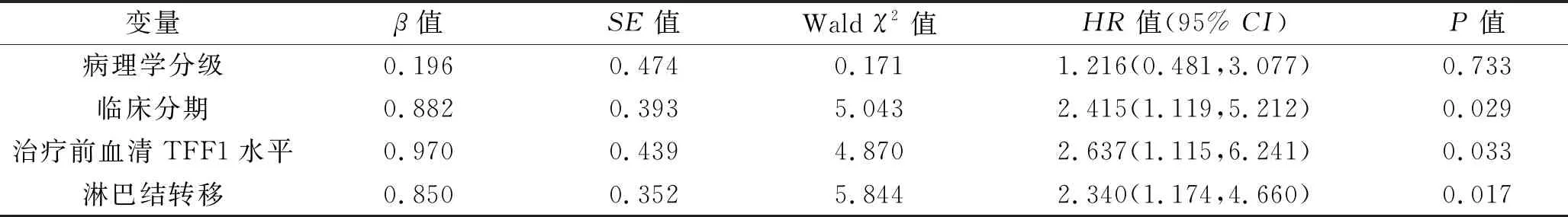
表6 多因素Cox回归分析结果
3 讨 论
TFF1正常情况下主要表达于胃肠道黏膜,其在机体多种生理活动中发挥重要作用,如中枢神经调节、胃肠道蠕动、创伤愈合,以及胃肠黏膜保护等[11-12]。研究表明,TFF1是一种重要的癌基因,在多种肿瘤组织和癌症患者血清中呈高表达水平,能够参与肿瘤细胞增殖和凋亡的调控,且在癌细胞转移和肿瘤血管形成中也发挥了重要作用[13-14]。虽然Leung等[15]研究发现TFF1在胃癌组织中的表达水平低于癌旁组织和正常胃黏膜,且胃癌组织、癌旁组织、正常胃黏膜中TFF1阳性率依次升高,这表明TFF1进行性缺失与早期胃癌的发生有关。但是与在胃癌不同,TFF1 在其他多种肿瘤组织和其他癌症患者血清中呈高表达水平[16]。例如,Kornprat等[17]报告TFF1在原发性和转移性胆囊癌中的表达水平显著高于正常胆囊黏膜和有炎症的胆囊黏膜;Emami等[18]研究发现TFF1在结肠癌中的表达水平显著增高;Ishibashi等[19]研究发现TFF1在乳腺癌患者血清中呈高表达水平,其参与了乳腺癌的发生和发展,在诊断乳腺癌方面有一定的价值。本研究结果显示,乳腺癌组血清TFF1水平高于乳腺良性疾病组和正常对照组(均P<0.05),这提示TFF1在乳腺癌的发生中可能发挥了重要的作用。此外,本研究结果显示,临床分期Ⅲ期的乳腺癌患者的血清TFF1水平高于临床分期Ⅰ期者,病理学分级Ⅲ期患者的血清TFF1水平高于病理学分级Ⅰ+Ⅱ期者(均P<0.05),这提示血清TFF1水平与乳腺癌的临床分期和病理学分级有一定的关系,表明血清TFF1水平可能有助于评估乳腺癌患者的临床分期和病理学分级。
目前临床上主要采用临床评价和病理组织学评价两种方法评估乳腺癌新辅助化疗的效果,前者主要包括临床触诊和影像学检查。以上检查方法均存在各自的优缺点:临床触诊简单常用,但影响因素多,准确性不高;影像学检查虽具有无创、便捷、可重复监测等优点,但也存在如钼靶X线对致密型乳腺癌病变的反映不准确、PET/CT和MRI费用昂贵且难以普及应用等缺点;病理组织学评价的优点是准确性高,但是需要在手术后才能够实施,因此疗效评估较迟,无法及时了解化疗药物效果的敏感度,导致化疗方案得不到及时调整,延误治疗。而血清肿瘤标志物检测简便、迅速且经济,可对乳腺癌化疗效果进行有效评价[20]。本研究结果显示,临床分期Ⅱ~Ⅲ期的乳腺癌患者新辅助化疗后血清TFF1水平低于化疗前水平,且有效组患者化疗后的血清TFF1水平均低于化疗前和无效组(均P<0.05),但无效组患者化疗前后的血清TFF1水平无明显变化(P>0.05)。这提示血清TFF1水平能够反映乳腺癌患者的新辅助化疗效果,或可作为评估乳腺癌新辅助化疗效果的监测指标。
准确评估患者预后对于乳腺癌辅助治疗方案的拟定具有重要价值。本研究将乳腺癌患者按治疗前血清TFF1水平分为高水平组和低水平组,结果显示低水平组5年生存率高于高水平组(P<0.05);Cox回归分析结果显示,治疗前血清TFF1水平为乳腺癌患者生存情况的独立影响因素(P<0.05)。这提示治疗前血清TFF1水平升高的乳腺癌患者的预后较差,死亡风险增加。目前,临床上主要通过患者的一些临床病理参数,如肿瘤大小、远处转移情况、组织学分级、分子分型等对乳腺癌患者进行预后评估,这些指标与乳腺癌的预后有着密切的关系,但是获得这些指标费时费力,而且价格比较昂贵,极大地限制了其在临床中的应用。血清TFF1水平检测具有取材容易、操作简便、检测成本较低且可重复等优点,或可为乳腺癌患者预后评估提供有用的信息。
综上所述,乳腺癌患者的血清TFF1水平上调,其有助于评估患者的临床分期和病理学分级;血清TFF1水平在乳腺癌新辅助化疗效果及预后评估方面有一定的临床意义,治疗前血清TFF1水平升高的患者,乳腺癌新辅助化疗的效果及预后均相对较差。本研究也存在一定的不足:首先本研究样本量较小,需扩大样本量进一步确认血清TFF1水平对乳腺癌新辅助化疗效果及预后的评估作用;其次,本研究未对乳腺癌术后患者血清TFF1水平进行动态监测,下一步将动态监测血清TFF1水平,进一步研究TFF1在乳腺癌中的应用价值。
