高内相乳液的制备及在食品中的应用
2022-05-25陈雨露高彦祥毛立科
卫 姣,陈雨露,高彦祥,毛立科,袁 芳
(中国农业大学食品科学与营养工程学院 北京 100083)
乳状液(Emulsion),简称乳液,是由两种液相组成的热力学不稳定体系,其中被分散的相称为分散相(Dispersed phase),分散其它相的物质的相称为连续相(Continuous phase)[1]。通常为了稳定乳液需加入第3 种组分——乳化剂,其可降低混合体系中各组分的界面张力,从而阻碍分散相的聚集,获得更加稳定的乳液[2]。乳液通常分为水包油(O/W)、油包水(W/O)及多重乳液等类型,在食品、化妆品、工业和医药等领域应用广泛。特别是在食品领域中,一些由两种不互溶的液相或假液相组成的食品,均可看作是乳化体系,如牛奶、乳饮料、沙拉酱、蛋黄酱、冰淇淋和巧克力等可看作O/W 乳状液[3];黄油、人造黄油和奶油等可看作W/O 乳状液。
高内相乳液(High internal phase emulsions,HIPEs)又称作超浓乳液,是指分散相体积分数在74.05%以上的乳液[4]。这一概念由Lissant 于20世纪60年代提出。高内相乳液和普通乳液一样,主要包括水包油(O/W)[5]、油包水(W/O)[6]和超临界CO2(C/W)[7]3 种类型。如图1所示,一般乳液的分散相体积分数为30%~50%,以互不相连的球形液滴分散在连续相中;当分散相的体积分数达到74.05%的临界密度时,分散相液滴将紧密堆积成相互连接的球形;进一步增大分散相体积分数,分散相液滴将相互挤压、变形成为多边形,此时的乳液即HIPEs[8]。近年来HIPEs 成为食品、化妆品、组织工程、制药和石油工业领域的研究热点[9-14]。
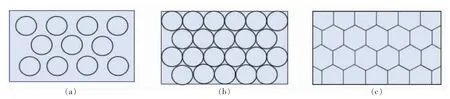
图1 (a) 分散相体积分数φ=30%~50%;(b) 分散相体积分数φ=74.05%;(c) 分散相体积分数φ ≥74.05%[8]Fig.1 (a) volume fraction of dispersed phase φ=30%~50%;(b) volume fraction of dispersed phase φ=74.05%;(c) volume fraction of dispersed phase φ ≥74.05%[8]
当使用小分子表面活性剂作为乳化剂稳定HIPEs 时,由于小分子表面活性剂本身的动力学不稳定性质,导致其在油-水界面黏附作用弱,容易流失,因此一般需要大量的乳化剂来稳定HIPEs[15]。此外,小分子表面活性剂的潜在毒性和生物相容性等问题也不容忽视。近年来小分子表面活性剂逐渐由双亲性生物大分子和有机或无机固体颗粒所取代[16]。由固体颗粒稳定的乳液称之为皮克林(Pickering)乳液,由Ramsden[17]于1903年首次提出,随后由Pickering[18]首次公开描述这一现象。与传统的小分子表面活性剂稳定的HIPEs 相比,Pickering 乳液具有以下优点:1)颗粒不可逆地吸附在油-水界面上或在油-水界面上自组装,形成阻碍液滴合并、奥斯瓦尔德熟化和结霜的刚性层[19-20];2)Pickering 乳液非常稳定,保质期稳定在几个月到几年之间[21-23];3)与表面活性剂相比,胶体颗粒对人体的毒性要小得多,且更环保[24-25]。基于上述研究背景,本文综述稳定高内相乳液的乳化剂种类,尤其是稳定食品级HIPEs 的颗粒种类(多糖、蛋白和多糖-蛋白)及其研究现状,简述高内相乳液的制备方法及在食品领域的应用和发展前景。
1 表面活性剂稳定的高内相乳液
1.1 小分子表面活性剂
传统上HIPEs 由小分子的表面活性剂所稳定,主要有十二烷基硫酸钠(Sodium dodecyl sulfate,SDS)、司盘80(Span 80)、十六烷基三甲基溴化 铵 (Hexadecyl trimethyl ammonium bromide,CTAB)等[15]。由于小分子表面活性剂本身的动力学不稳定性,一般需要较高浓度(20%左右)的表面活性剂用于稳定HIPEs。过量的非食品级乳化剂的使用会对人体健康造成危害,在后续使用中必须除去,以免影响之后乳液的应用。因此,小分子表面活性剂逐渐被生物大分子和固体颗粒所取代。
1.2 生物大分子
利用蛋白质的双亲性、多糖的增稠性可稳定HIPEs。蛋白质的分子结构两端有亲水和疏水基团,分散在乳液的油水界面起乳化剂的作用。常用作乳化剂的蛋白为植物蛋白,与动物蛋白相比,植物蛋白更健康、更环保,并且具有多种生理保健功能,如降低胆固醇、抗氧化和降血压等[26]。一些具有双亲性的多糖或对多糖进行改性之后也可作为乳化剂或增稠剂,降低油水表面张力或提高水相的黏度,从而提高乳液的稳定性。在最近一项研究中,以豌豆蛋白为乳化剂,8 种多糖为稳定剂,葵花籽油为油相制备O/W HIPEs(φ=80%),研究了植物蛋白和不同多糖在稳定乳液中的协同作用,通过分析贮藏稳定性、流变和粒径等性质,得出由豌豆蛋白和卡拉胶、黄原胶、塔拉胶稳定的HIPEs最为稳定,并且在食品配方中有作为脂肪替代物的应用前景[5]。
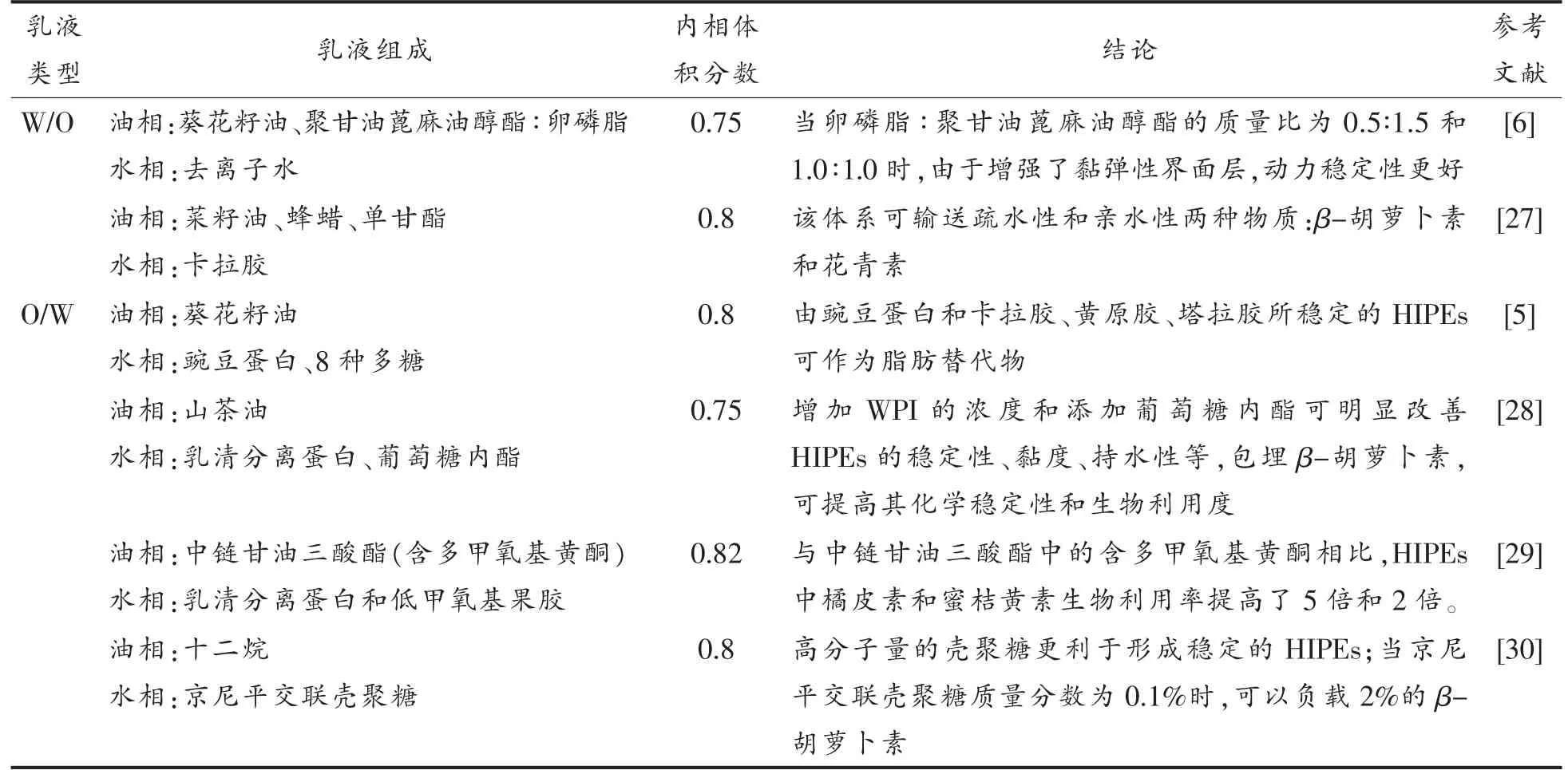
表1 由生物大分子稳定的HIPEsTable 1 HIPEs stabilized by biomolecules
2 固体颗粒稳定的高内相乳液
固体颗粒的种类主要可分为无机颗粒和有机颗粒[31]。无机颗粒中主要包括改性二氧化硅[32-34]、羟基磷灰石[35]、二氧化钛颗粒[36]、石墨烯[37]和氧化锌[38]等。虽然由无机颗粒稳定的Pickering HIPEs的稳定性得到改善,但是生物相容性较差,限制了其在生物医药、食品等领域的应用。生物来源的固体颗粒具有环境友好、可再生、可生物降解等优点,固体颗粒性质的研究及新型固体颗粒的研发是目前的研究热点。生物来源的固体颗粒主要分为:1)多糖颗粒:纤维素纳米晶[39-40]、淀粉[41-42]、壳聚糖[30]等;2)蛋白质颗粒:乳清蛋白[43]、醇溶蛋白[44-47]、大豆蛋白[48-50]、小麦面筋蛋白[51]、牛血清白蛋白[52-53]、玉米肽[54]、卵转铁蛋白[55-56]等;3)多糖-蛋白质复合颗粒[57-59]。
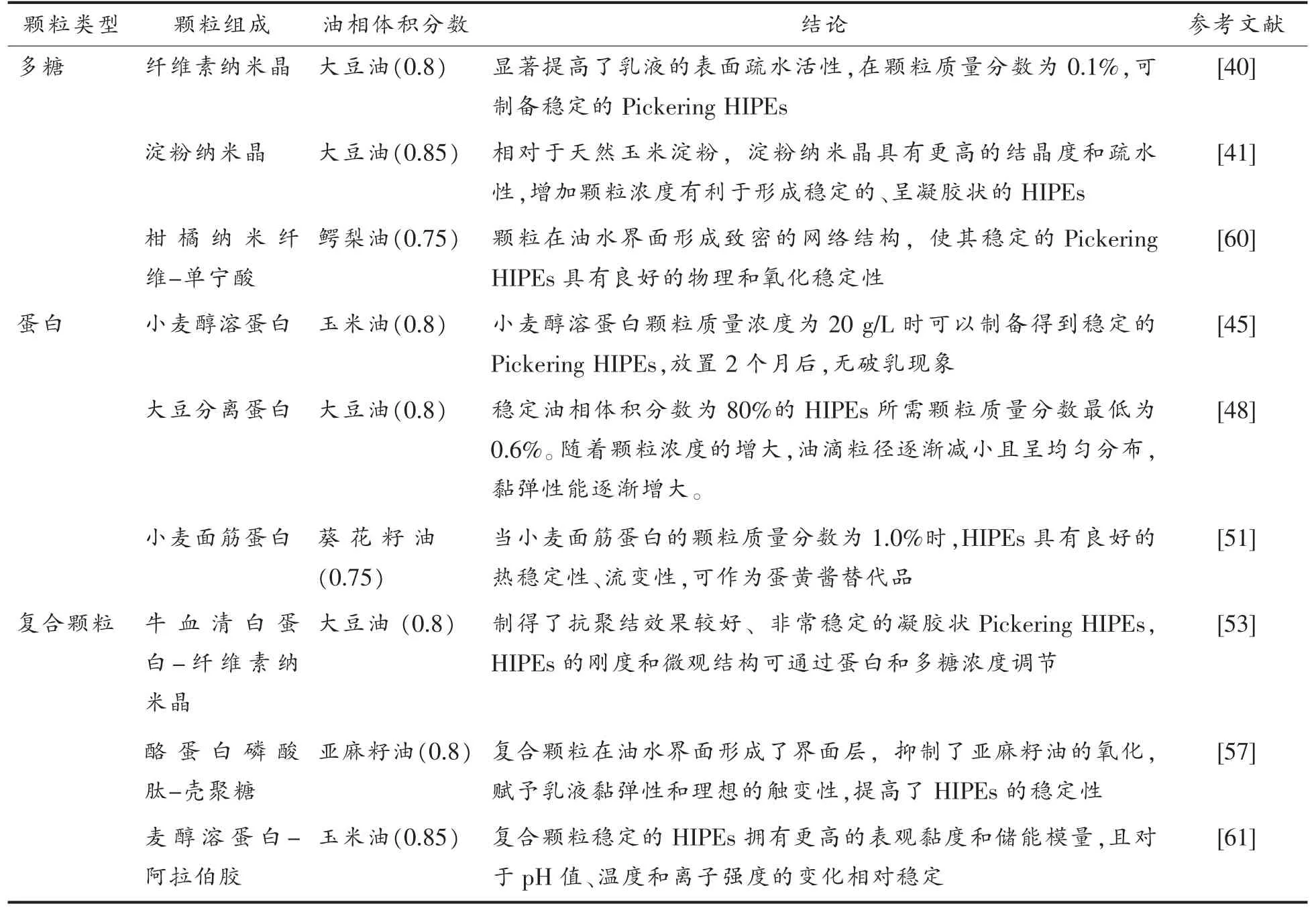
表2 由颗粒稳定的Pickering HIPEsTable 2 Pickering HIPEs stabilized by granules
2.1 多糖颗粒
大多数多糖为亲水性生物大分子,通常情况下需要对其进行疏水修饰才能应用于稳定Pickering HIPEs。Yang 等[41]使用硫酸水解天然糯玉米淀粉制备淀粉纳米晶作为O/W HIPEs 的有效稳定剂,在颗粒质量分数为1.0%,内相体积分数为75%~85%时,可形成稳定性较好、硬度良好的HIPEs,颗粒浓度与凝胶状乳液的硬度成正比。此外,Capron 等[39]也成功地在50 mmol/L NaCl 中制备了仅由纤维素纳米晶稳定的HIPEs。除了淀粉和纤维素纳米晶外,壳聚糖也可作为固体颗粒稳定HIPEs,使用京尼平交联壳聚糖微凝胶稳定HIPEs,当壳聚糖的分子质量为50,100,150 ku时,壳聚糖与京尼平的所有质量比都能用于形成稳定的HIPEs[30]。
2.2 蛋白质颗粒
大多数蛋白都为颗粒状,具有高营养价值,且基本为双亲性生物大分子,具有良好的乳化性能,可以吸附在油水界面,在生产稳定的、可生物降解的食品级Pickering HIPEs 具有双重优势。其中,球状蛋白质是水包油乳液良好的乳化剂和稳定剂,当它吸附在油水界面时,趋于发生结构展开和重排,形成了黏弹性界面膜[26]。在最近一项研究中,以β-伴大豆球蛋白颗粒作为乳化剂制备了以十二烷为油相的O/W HIPEs(φ=80%),如图2所示,通常以三聚体形式存在的β-伴大豆球蛋白可作为HIPEs 稳定剂,其原因是β-伴大豆球蛋白在油水界面发生亚基解离,再进行有序堆积形成稳定的Pickering HIPEs,使得制备的HIPEs 为凝胶网络状,且在加热或延长储存时间长达60 d 后都非常稳定[49]。
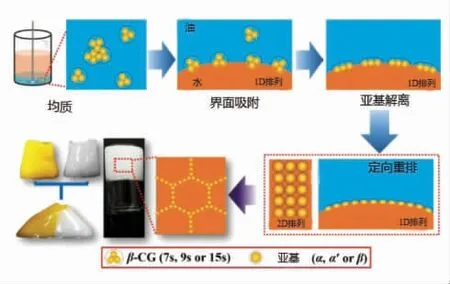
图2 β-伴大豆球蛋白稳定Pickering HIPEs的机理[49]Fig.2 Mechanism of Pickering HIPEs stabilization with soy globulin[49]
2.3 复合颗粒
与单独使用多糖和蛋白质相比,多糖和蛋白质复合颗粒同时具有多糖和蛋白质的优点,如良好的乳化特性和较强的空间稳定性。对于多糖颗粒,与蛋白质的络合可以增强液滴堆积效应和界面桥联影响,大大提高其乳化性能[52]。另一方面,对于使用单一蛋白质颗粒稳定的HIPEs,与多糖(如:果胶)的络合也可以改进乳化性能和界面稳定性[62]。以牛血清白蛋白和海藻糖复合稳定HIPEs,在海藻糖存在下,牛血清白蛋白的界面稳定性得到显著改善,促进了桥联液滴的形成,当海藻糖质量分数为40%时,在蛋白核心周围形成了核-壳纳米结构,极大地促进了界面的稳定性[52]。单一的玉米醇溶蛋白颗粒由于疏水性太强不能有效附着在油水表面,通过添加多糖可改善其乳化性能。吴滋灵[58]通过简单的反溶剂方法制备了玉米醇溶蛋白和果胶的复合颗粒,并制备了油相高达80%的HIPEs,该HIPEs 能够稳定4 个月以上,能够耐受较大离心力而不破乳,具有较强的凝胶网络结构。
除了多糖与蛋白的复合颗粒外,溶菌酶也可提高由蛋白质稳定HIPEs 的稳定性,Wei 等[55]制备由卵转铁蛋白和溶菌酶形成的复合颗粒稳定HIPEs,当pH 值为9.3 时,卵转铁蛋白/溶菌酶比例为8∶1 的卵转铁蛋白-溶菌酶颗粒满足Pickering 稳定剂的基本要求,可稳定油相体积分数为75%的HIPEs。
3 高内相乳液的制备方法
高内相乳液的制备方法主要包括一步乳化法、两步乳化法和浓缩法,其中一步乳化法制备HIPEs 操作简便,简单易行,为最常用的制备方法[63]。
3.1 一步乳化法
一步乳化法制备HIPEs 包括高速剪切均质、超声处理及手摇/涡旋等,其中高速剪切均质为最常用的制备方法[63]。将分散相一次性加入到连续相中,使用高速剪切机对混合物进行剪切均质,通过控制剪切速率和剪切时间制备得到稳定的HIPEs。Yang 等[41]将淀粉纳米晶的水悬浮液和大豆油混合后,在13 500 r/min 转速下剪切120 s,制备得到均匀的凝胶状O/W HIPEs。对于内相体积分数较高的HIPEs,在剪切过程中将分散相逐滴加入连续相中更易制备得到HIPEs,不易发生相转。在最近一项研究中,在14 000 r/min 的转速下,使用蠕动泵将水相以2.5 mL/min 的流速滴加到油相中,在水相完全并入乳液后,在11 000 r/min 下剪切4 min,可制备得到均匀的内相体积分数为75%的W/O HIPEs[6]。在使用高速剪切机均质的过程中,剪切速率和剪切时间会通过影响乳液粒径的大小、分散性和界面吸附性来影响乳液的流变学行为和稳定性。Tripathi 等[64]探究了剪切时间对HIPEs 流变学行为和稳定性的影响,试验证明,剪切速率的提高和剪切时间的延长会减小液滴粒径,增加液滴的分散性,从而增加乳液的储能模量和黏度等流变行为,影响乳液的稳定性。
3.2 两步乳化法
两步乳化法是先以高能量输入的方式(微射流、高压均质、超声等)制备内相体积分数较低的初始乳液,再以低能量输入的方式(高速剪切)在初始乳液中增加分散相的体积分数剪切制备得到HIPEs。在最近一项研究中,陈业宝[65]对比了一步乳化法和两步乳化法对HIPEs 流变及稳定性的影响,结果表明两步乳化法明显增强了HIPEs 的凝胶网络结构,并且微射流的高能量输入影响了蛋白的疏水性,使得更多的蛋白吸附在油水界面,从而影响了HIPEs 的冻融稳定性。此外,两步乳化法也显著提高了HIPEs 的储藏稳定性和热稳定性,微观结构表明初始乳液中形成的大量微乳滴可以吸附在大乳滴界面上,增加蛋白的界面吸附,在一定程度上可以起到Pickering 颗粒的作用,对乳液的稳定性起到了协同作用[66]。然而当初始乳液的粒径小到一定程度时,对于同体积的初始乳液,微乳滴的数量会剧增,从而超过HIPEs 桥联絮凝的颗粒浓度阈值,使其转变成流动性更强的空缺絮凝状态,弹性和稳定性反而会下降。

图3 采用一步乳化法和两步乳化法制备HIPEs 的机理图[65]Fig.3 The mechanism diagram of HIPEs prepared by one-step and two-step emulsification[65]
3.3 浓缩法
浓缩法制备HIPEs 是先通过高速剪切、高压均质等方式制备出内相分数较低的初始乳液,后将初始乳液经过高速离心、真空蒸发等方式除去多余的外相来制备HIPEs,计算确定最终的内相体积分数。Matos 等[67]采用膜乳化法制备了O/W 初始稀乳液(φ=16%),后将初始乳液采用真空蒸发法除去水分,制备得到稳定的O/W HIPEs (φ=75%)。Zou 等[46]先使用高速剪切机在20 000 r/min的转速均质2 min 制备O/W 初始乳液(φ=50%),后将初始乳液在2 000~7 000×g 下高速离心10 min,除去多余水相,增加油相的体积分数,收集制备得到O/W HIPEs,使用二乙醚将O/W HIPEs 的油水相分离,计算得到油相的体积分数(φ=72%~87%)。浓缩法相对于一步乳化法操作复杂,油水相体积分数不易确定,目前应用较少。
4 高内相乳液在食品领域中的应用
近年来,对于分散相体积分数大于74%的HIPEs,其高负载能力和特殊的流变学行为在食品及生命科学领域备受关注[68]。此前,以HIPEs 为模板,通过不同的路线合成多孔材料已得到较大的发展,HIPEs 聚合得到的多孔材料称为PolyHIPEs[69],可通过改变HIPEs 中表面活性的种类、浓度或两相组成及比例控制PolyHIPEs 的结构和物理性质,使其具有高孔隙率、极低泡沫密度、高比表面积等独特性能,PolyHIPEs 已在气体吸附[70-71]、分离[72]、组织工程[73]、传感[74]、储能[75]和催化剂载体[76]等领域应用广泛。近年来,使用淀粉、蛋白质、纤维素等生物来源的、生物相容性高、环境友好、无毒的天然高分子物质稳定HIPEs 成为研究热点,食品级HIPEs 作为活性物质的传递体系或作为脂肪替代物都具有巨大的潜力。与其它乳液体系相比,O/W HIPEs 的含水量较低,因此具有较长的保质期[77]。
4.1 递送功能成分
HIPEs 在食品中的一个广泛应用是包埋和传递功能性成分,如β-胡萝卜素、酚类物质及益生菌等。一些生物活性物质由于其水溶性和稳定性差等原因导致其生物利用度低,HIPEs 的封装可以有效解决上述问题。此外,由于HIPEs 内相体积较高,可提高活性物质的负载量,同时具有更好的贮藏稳定性和保质期。
4.1.1 类胡萝卜素 β-胡萝卜素是一种脂溶性物质,具有抗氧化、抗癌等生理作用。然而天然类胡萝卜素的水溶性较低,不饱和共轭双键的存在,使其遇光、热、氧气易发生氧化分解,使得天然类胡萝卜素的生物利用度较低,最终限制了其在食品领域的应用。已有研究证实,使用脂质体、环糊精、微胶囊等食品传递体系封装β-胡萝卜素可以有效解决上述难题[78]。
Li 等[30]用京尼平交联壳聚糖微凝胶稳定的HIPEs 显著提高了β-胡萝卜素的载量,仅用0.1 wt%微凝胶乳化剂的载量可达2wt%。在乳化剂用量远小于常规用量(约10wt%)的情况下,β-胡萝卜素在乳状液体系中的负载量比文献报道的提高了10 倍以上,同时包埋之后的β-胡萝卜素对紫外光照射、热处理、铁离子和过氧化氢的稳定性也有显著提高。此外,通过构建体外消化模型可模拟在体内的生物利用率,最近一项研究采用预热的乳清分离蛋白和葡萄糖内酯稳定O/W HIPEs 以期提高β-胡萝卜素的稳定性和生物利用率,在添加葡萄糖内酯之后,β-胡萝卜素保留率和生物利用率得到显著提高(88.34%±0.77%)。同时,HIPEs的凝胶网络结构也延缓了β-胡萝卜素在胃肠道中的降解[28]。
4.1.2 酚类物质 酚类物质广泛存在于水果、蔬菜及谷物中,具有降低冠心病和其它慢性疾病的作用,而酚类物质较低的水溶性,在肠胃道环境中的不稳定性,及其被动扩散进入细胞的方式,降低了其在人体中的生物利用度。有研究学者使用卵转铁蛋白和溶菌酶复合颗粒稳定的O/W HIPEs(φ=75%)可作为姜黄素的有效载体,与中链甘油三酸酯中的脂解程度 (32.1%) 相比,O/W HIPEs中姜黄素的脂解程度(71.5%)提高了39.4%,其生物利用度也从16.1%提高到38.3%,表明该HIPEs可作为姜黄素的有效载体[55]。此外,在壳聚糖-酪蛋白磷酸肽纳米颗粒稳定O/W HIPEs 中,姜黄素的生物利用度也提高到40.91%[57]。
Wei 等[56]通过京尼平交联卵转铁蛋白颗粒制备的Pickering HIPEs 对橙皮苷进行包埋,与菜籽油中橙皮苷的生物利用度(54.5%)相比,京尼平交联卵转铁蛋白颗粒的生物利用度(61.9%)提高了13.6%,显著改善了脂解程度和生物利用度。HIPEs也被证明适合作为黄酮类化合物的传递体系,通过制备乳清分离蛋白-低甲氧基果胶复合物稳定的HIPEs 用于包埋黄酮类化合物,与MCT 油相比较,橘皮素和蜜桔黄素的生物利用度分别增加了5 倍和2 倍[29]。
4.1.3 益生菌 益生菌因其对宿主肠道菌群有积极的生理作用而在功能食品中受到广泛的欢迎,由于其活性较低,使其应用受到限制,通过对益生菌进行包埋是一种理想的解决办法。有研究表明,将鼠李糖乳杆菌包埋到油包水的凝胶乳液中,此时益生菌的活力大于77%,在未添加凝胶剂的油包水乳液中,益生菌的活力下降到66%,油包水体系能有效地保护益生菌免受口服和胃环境的侵害,并能安全地将益生菌输送到小肠,该研究说明使用油包水凝胶乳液可以提高益生菌的活力,为HIPEs 作为益生菌的传递体系奠定基础[79]。Su 等[80]使用微凝胶稳定的HIPEs 包埋植物乳杆菌可以成功地提高巴氏杀菌后细胞存活率。通过HIPEs 包埋益生菌,可以显著提高益生菌的活性,而目前关于此方面的研究较少,通过HIPEs 对益生菌进行包埋以提高其活性的研究还需要进一步探索。
4.2 脂肪替代品
高内相乳液是一种半固体的材料,可以用来仿制饱和脂肪酸的质构特性,用于制备低脂食品。生活中常见的蛋黄酱是以植物油作为油相,蛋黄、食醋以及一些调料作为水相制备而成,可看作一种典型的O/W HIPEs。在蛋黄酱成分中,蛋黄对乳液的稳定性和感官特性起着至关重要的作用[81],然而蛋黄中高水平的胆固醇和饱和脂肪会增加肥胖的风险,且不适合一些患有高胆固醇血症的人群食用。此外,动物蛋白的供应难以跟上不断增长的世界人口,集约化畜牧业又会破坏生态环境,使用植物蛋白代替饮食中的动物蛋白可以应对上述问题并促进食品的可持续发展[82]。
在最近一项研究中,以小麦面筋蛋白为原料制备了稳定的O/W HIPEs(φ=75%),与蛋基蛋黄酱相比,HIPEs 表现出与其非常相似的液滴尺寸分布、流变行为、近乎完美的触变恢复率和摩擦学性能,表明HIPEs 和蛋黄酱具有相似的感官特性和质地,如奶油味、平滑度和黏稠度,HIPEs 的热稳定性也远优于蛋黄酱[51]。此外,HIPEs 代替蛋黄酱也改善了蛋黄酱较差的冻融稳定性,使用大豆分离蛋白热聚集颗粒稳定O/W HIPEs,当其100%替代湿蛋黄液时,可制备得到冻融稳定性良好的类蛋黄酱,将其与市售的蛋黄酱相比,在冻融稳定性较好的情况下又降低了胆固醇的含量(图4)[63]。除了使用植物蛋白稳定的HIPEs 外,在植物蛋白中加入膳食纤维也可作为蛋黄酱的替代品,以柑橘纤维和玉米肽为基础制备的HIPEs (φ=75%)作为蛋黄酱的替代品,不仅提高了乳制品中膳食纤维的含量,又表现出超低摩擦特性,与以鸡蛋为基础的蛋黄酱相比,可以提供更多的奶油味和平滑度[54]。
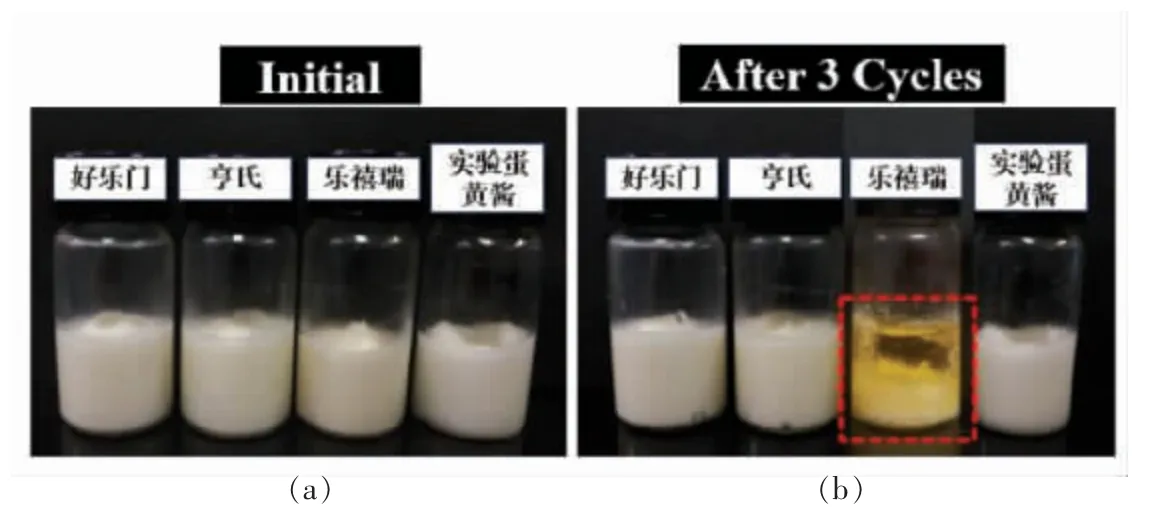
图4 商业蛋黄酱与实验蛋黄酱经过3 次冻融循环后的外观[54]Fig.4 Appearance of commercial and lab mayonnaise initial and after three freeze-thaw cycles[54]
除了作为蛋黄酱的替代品外,HIPEs 还可作为部分氢化植物油 (Partially hydrogenated oils,PHOs)的替代品。加工食品中的反式脂肪酸大多来源于PHOs,人造反式脂肪酸的主要来源为人造黄油、起酥油、烘焙食品和油炸快餐等[83]。美国食品药品监督管理局于2018年禁止在食品生产中使用PHOs,因此,寻求零反式脂肪酸的PHOs 替代品已经成为现代食品产业亟待解决的问题。具有绿色标签的HIPEs 与人造黄油相似,可作为人造黄油(含PHOs)的替代品。使用醇溶蛋白/壳聚糖复合颗粒作为乳化剂的HIPEs,形成的3D 网络结构使HIPEs 具有独立的黏弹性,开辟了液态油转化为零反式脂肪酸的黏弹性软固体的路径,可作为PHOs 的潜在替代品[84]。今后对于HIPEs 在真实食品中的性能及其取代PHOs 的感官特性也需要进一步研究。
5 结语与展望
高内相乳液由于其高负载能力和特殊的流变学行为在材料、食品、化工、生命科学和石油工业等领域应用广阔。近年来,由生物来源的大分子物质或固体颗粒稳定的HIPEs 在食品领域取得了较大的发展,使用多糖和蛋白稳定的O/W HIPEs 内相体积分数可达到85%以上,并且具有较好的物理和储存稳定性,作为传递体系负载脂溶性活性物质(β-胡萝卜素、酚类物质),可以显著提高脂溶性活性物质的稳定性和生物利用度。然而,利用生物来源的大分子或固体颗粒制备W/O HIPEs 还处于起步阶段,由于水相和油相的黏度较低且乳化剂有限,W/O HIPEs 内水相体积分数较低,容易发生相反转,稳定性较差等问题有待解决。
因此,今后关于高内相乳液的研究可侧重以下方面:1)可通过在油水两相中添加结构剂形成凝胶,提高两相黏度,以期提高W/O HIPEs 乳液的稳定性,或对固体颗粒进行加热、物理或化学改性,改变固体颗粒的湿润性,探索更多、更适合稳定W/O HIPEs 的固体颗粒;2)深入探索HIPEs 稳定性的影响因素,改善由于内相体积的增加引起的相反转现象;3)HIPEs 作为功能因子的传递体系,提高功能因子的包埋率、稳定性和生物利用度也具有一定的挑战性,此外可建立全方位的体外消化模型、细胞模型,来检测不同功能因子的生物利用度;4)将HIPEs 作为脂肪替代品或取代PHOs的稳定性、流变、感官特性和风味也有待进一步研究。
