pH值对“L-抗坏血酸-L-半胱氨酸-甘氨酸”体系挥发性物质形成的影响
2022-05-25刘双双余爱农
冯 亮,余 科,杨 艳,刘双双,余爱农
(湖北民族大学化学与环境工程学院 生物资源保护与利用湖北省重点实验室 湖北 恩施 445000)
风味是食品品质的基本属性之一,也是影响消费者喜好的关键因素[1-3]。食品的特征风味形成途径较多,有些在加工过程中形成,其中较为重要的一类反应是美拉德反应[4-6]。美拉德反应的本质是氨基酸与羰基化合物之间的反应。由于L-抗坏血酸(L-ascorbic acid,ASA)具有潜在的羰基结构且广泛存在于食物中,因此对于其美拉德反应的研究成为热点[7-14]。目前,多数研究仅限于2 组分美拉德反应,即L-抗坏血酸与1 种氨基酸的反应,这种模拟反应比较简单[15-17]。而食品工业中涉及的美拉德反应较为复杂,各反应物之间相互作用,使得实际结果与模拟结果存在很大差异。研究L-抗坏血酸与2 种及以上的氨基酸并存的美拉德反应模拟体系,具有非常重要的现实意义。
食品中的美拉德反应受多方面因素影响,其中最直接的影响因素是氨基酸种类[18-19],是否有含硫氨基酸参与反应,对体系挥发性化合物的形成影响很大[20-21]。其次是反应环境,其中pH 值对美拉德反应中挥发性物质形成与分布的影响至关重要[22-23]。本研究主要关注美拉德复杂体系的反应因素,特别是反应体系在不同pH 值条件下对挥发性化合物的生成与释放的影响。选取普通氨基酸代表——甘氨酸 (Glycine,Gly) 和含硫氨基酸代表——L-半胱氨酸(L-cysteine,Cys),两者都是食品工业中非常重要的基础物质,如用作食品调味剂、面粉改良剂等[24-25]。以这2 种氨基酸为反应模型,考察它们与L-抗坏血酸之间的美拉德反应,模拟食品工业中美拉德反应的复杂反应体系。在对它们自降解及2 组分体系相互反应的基础上,探讨pH 值对L-抗坏血酸-L-半胱氨酸-甘氨酸3组分体系挥发性物质形成与分布的影响,并探讨各挥发物质可能的生成机制。
1 材料与方法
1.1 材料与设备
L-抗坏血酸、L-半胱氨酸、甘氨酸、十二水合磷酸氢二钠、二水合磷酸二氢钠、氢氧化钠、氯化钠均为分析纯级,上海国药集团化学试剂有限公司;C5-C20正构烷烃、3-氯-2,5-二甲基吡嗪,美国Sigma-Aldrich 公司;试验用水均为自制二次蒸馏水。
DF-101S 集热式恒温磁力搅拌器,河南予华仪器有限公司;P160001 厚壁耐压瓶,北京欣维尔玻璃仪器有限公司;20 mL 顶空瓶、CONCEPT 多功能样品前处理系统,德国PAS 公司;SZ-93 自动双重蒸馏水器,上海亚荣生化仪器厂;BS-124S 电子天平、PB-21 pH 计,德国赛多利斯公司;GC6890N-MS5975I 气相色谱质谱联用仪、HP-5(30 m) 毛细管色谱柱,美国安捷伦公司;65 μm二乙基苯/碳分子筛/聚二甲基硅氧烷DVB/CAR/PDMS 固相萃取头,美国Supelco 公司。
1.2 试验方法
1.2.1 反应液的配制 根据课题组之前的报道[8-10],发现提高反应温度和延长反应时间有利于挥发性化合物的生成,因此本研究选择固定的反应时间120 min 和温度150 ℃,用磷酸盐缓冲溶液配制不同pH 值 (4.5,5.8,7.0,8.0,9.5) 的反应溶液,各体系原料浓度为0.05 mol/L。试验分组如表1所示。每组试验平行反应3 次,结果取平均值。
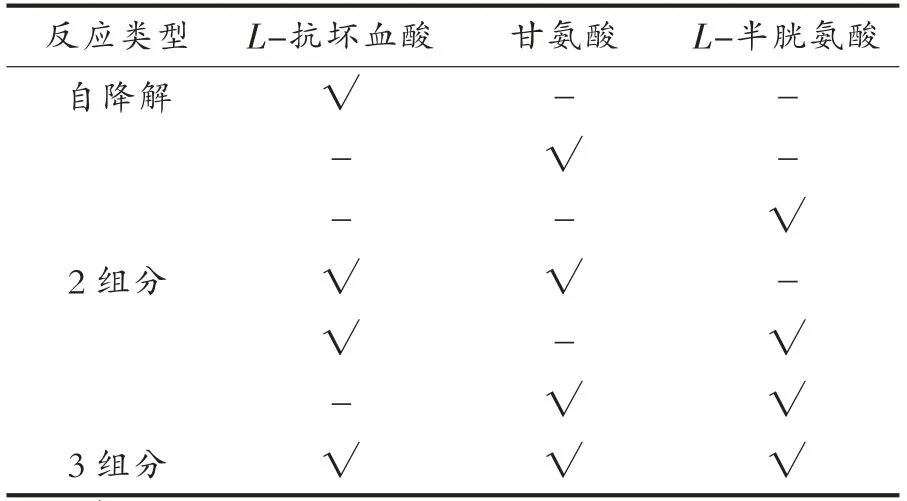
表1 试验列表Table 1 Experiment list
1.2.2 检测分析方法 采用多功能前处理系统和顶空固相微萃取-气相色谱-质谱(HS-SPME-GCMS)联用分析技术,对反应液的挥发性物质进行定性、定量检测,检测方法与条件参数参考课题组之前的报道[8-10]。
采用内标法和标准物质进行物质定量。通过内标物质(3-氯-2,5-二甲基吡嗪)的标准曲线[A=37885.51C+8863280,式中,C——质量浓度(mg/L),R2=0.9996],结合检测样品的峰面积,计算各挥发性化合物的浓度。
在相同萃取及GC-MS 参数条件下,对C5-C20正构烷烃进行检测,依此计算各物质的保留指数(Linear Retention index,RI)。各样品GC-MS 分析结果与NIST 20 数据库进行对比筛选,然后对比样品保留指数以及文献报道保留指数,部分化合物用标准物质进行对比,最终确定化合物。
2 结果与分析
2.1 自降解反应
由于各原料自降解过程所产生的物质是其发生美拉德反应的基础,因此对各物质的自降解研究就显得尤为重要。同时单独分析各原料物质的自降解挥发性产物,有利于探究复杂美拉德反应体系挥发性物质的生成机制[26]。经试验初探分析,发现甘氨酸比较稳定,受热无挥发性物质生成[27]。在此主要探讨L-抗坏血酸和L-半胱氨酸自降解过程挥发性物质的生成情况,如表2所示。
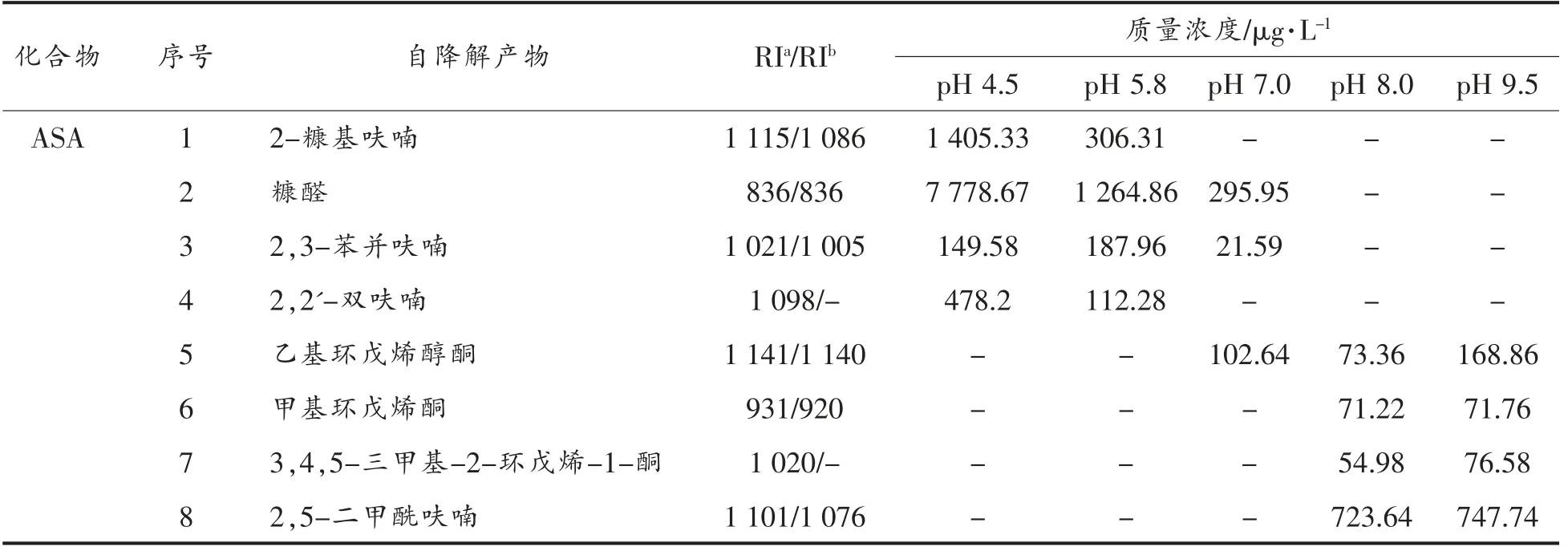
表2 L-抗坏血酸、L-半胱氨酸自降解挥发性物质的生成Table 2 The volatile formation form the self-degradation reaction of ASA and Cys
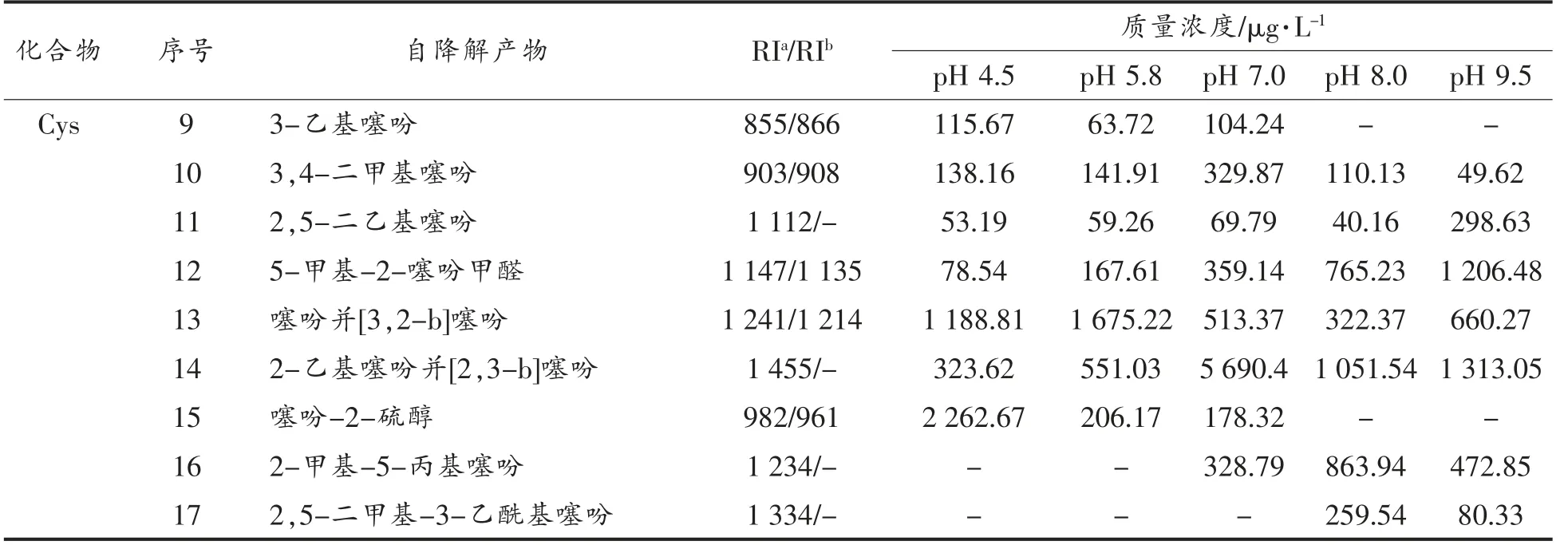
(续表2)
由于L-抗坏血酸具有五元环内酯结构,很容易发生水解开环,继而发生裂解反应。由表2可知,L-抗坏血酸在不同pH 值条件下生成了不同种类和含量的挥发性物质。在酸性条件下,L-抗坏血酸主要生成糠醛以及呋喃类化合物;当溶液pH值逐渐升高,趋于中、碱性时,L-抗坏血酸自降解主要生成环戊烯酮类化合物以及2,5-二甲酰呋喃。
L-半胱氨酸是含硫氨基酸的代表,因硫的原子半径比较大,其最外层电子受原子核影响较小,反应活性高。从表2可知,L-半胱氨酸自降解产物主要以噻吩类化合物为主,且大多数化合物在酸、碱条件下均可生成。一些简单结构化合物如3-乙基噻吩和噻吩-2-硫醇,更容易在酸性环境下生成。
2.2 2 组分美拉德反应
基于L-抗坏血酸与氨基酸的美拉德反应报道较多,由于甘氨酸与L-半胱氨酸的2 组分反应中甘氨酸并不活跃,L-半胱氨酸为主要反应原料,因此本试验主要讨论L-抗坏血酸与甘氨酸、L-抗坏血酸与L-半胱氨酸2 组分美拉德反应的挥发性物质生成情况,如表3~4 所示。
2.2.1 L-抗坏血酸/甘氨酸美拉德反应 L-抗坏血酸与甘氨酸的美拉德反应生成的挥发性物质如表3所示。
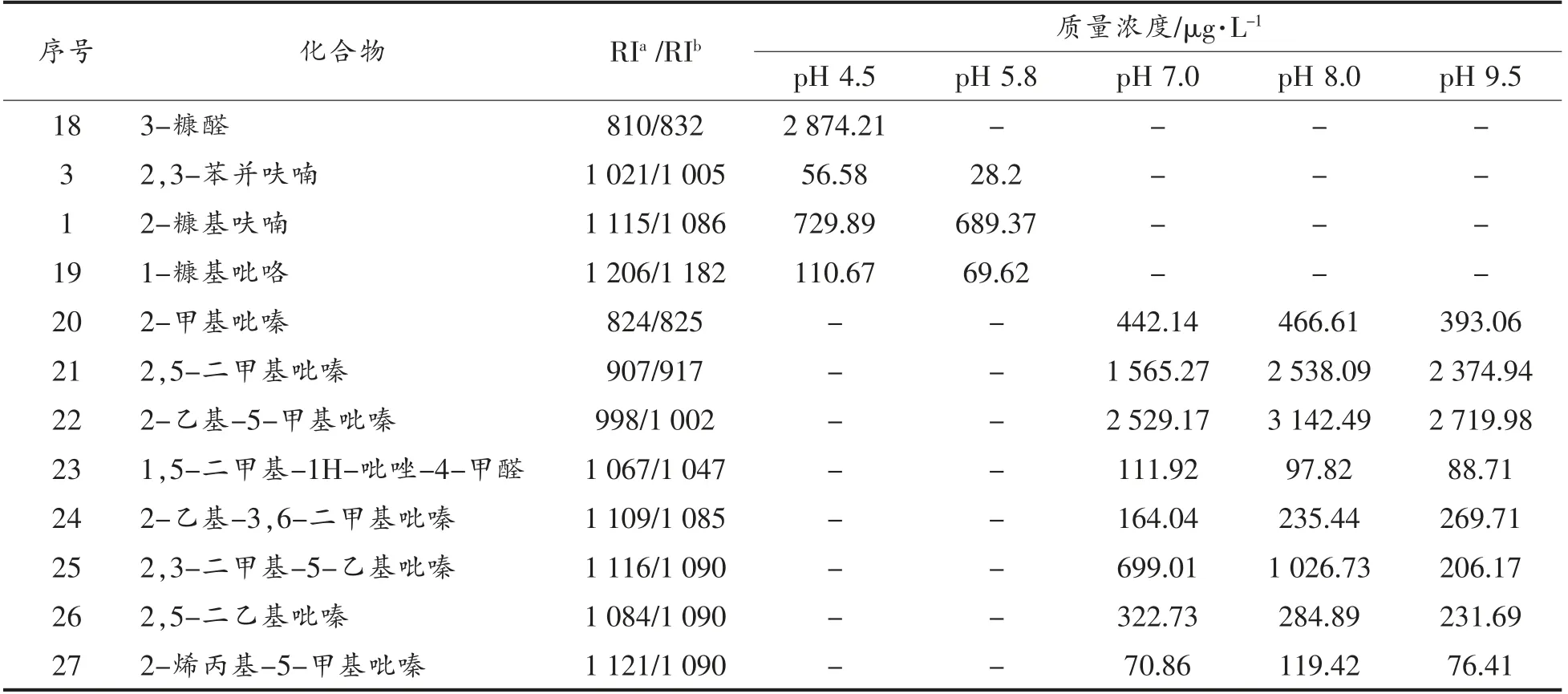
表3 L-抗坏血酸/甘氨酸美拉德反应挥发性物质的生成Table 3 The volatile formation in Maillard reaction of ASA/Gly
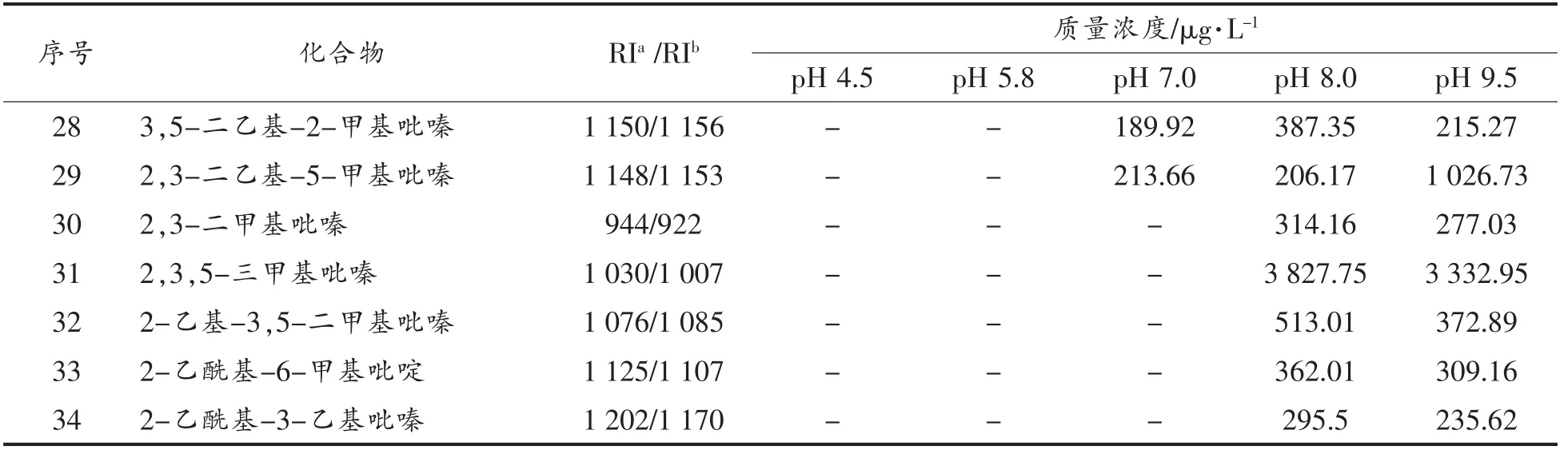
(续表3)
从表3可知,L-抗坏血酸与甘氨酸经美拉德反应生成的挥发性物质除少数吡啶、吡咯和呋喃类化合物外,其它主要为吡嗪类衍生物,而且pH值对此体系挥发生物质的生成与分布影响较大。与表2对比发现,在酸性条件下,挥发性物质主要来自L-抗坏血酸的自降解产物,而在碱性条件下主要为吡嗪类化合物。这说明在酸性条件下,甘氨酸不能提供美拉德反应所需氨基前体物,而碱性条件下可以。
2.2.2 L-抗坏血酸/L-半胱氨酸美拉德反应 与L-半胱氨酸有关的美拉德反应模型常用来模拟研究肉香味化合物的形成,肉香味的来源主要是其反应生成了一些含硫挥发性化合物。不同pH 值条件下L-抗坏血酸/L-半胱氨酸美拉德反应生成的挥发性物质如表4所示。
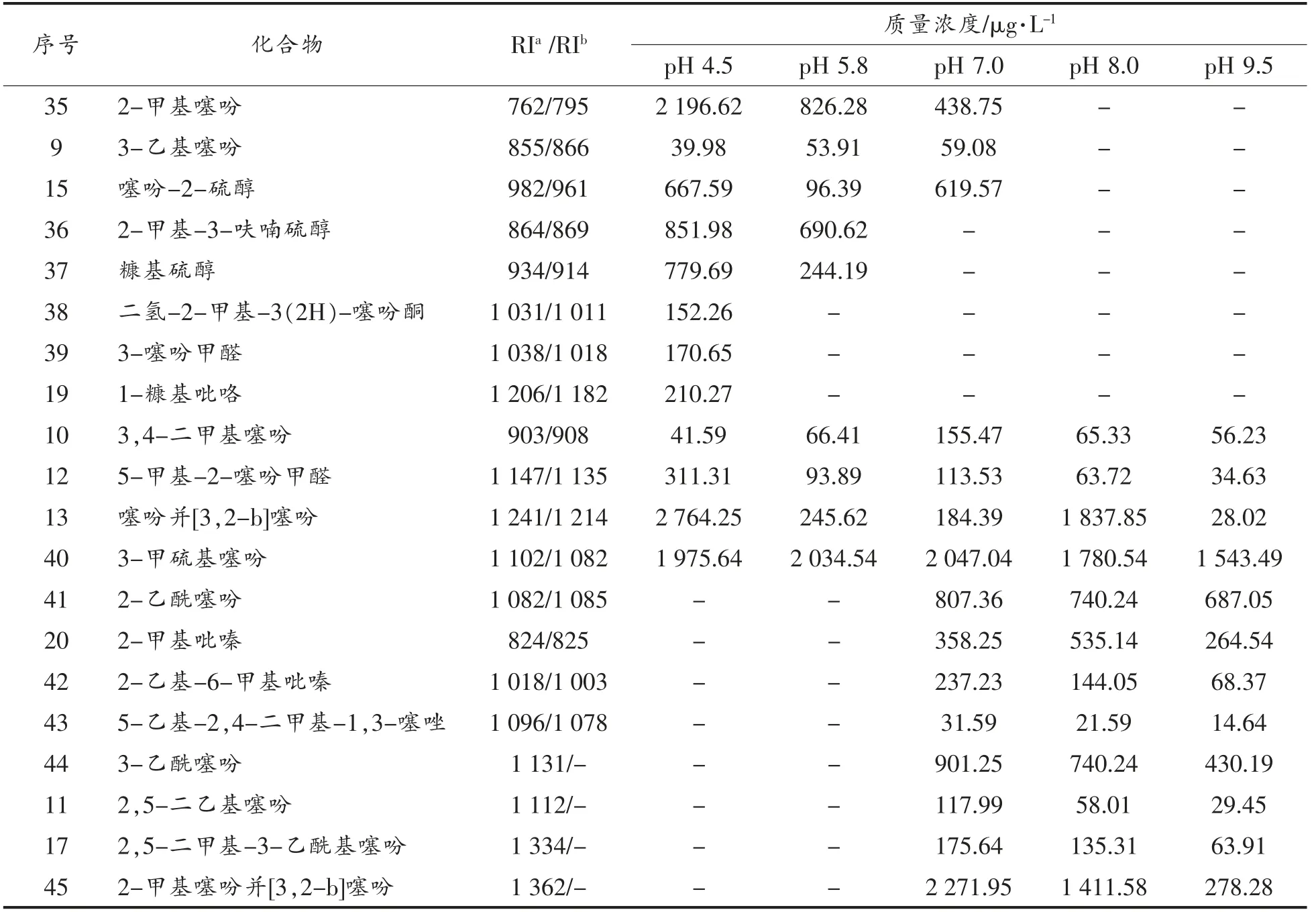
表4 L-抗坏血酸/L-半胱氨酸美拉德反应挥发生物质的生成Table 4 The volatile formation in Maillard reaction of ASA/Cys
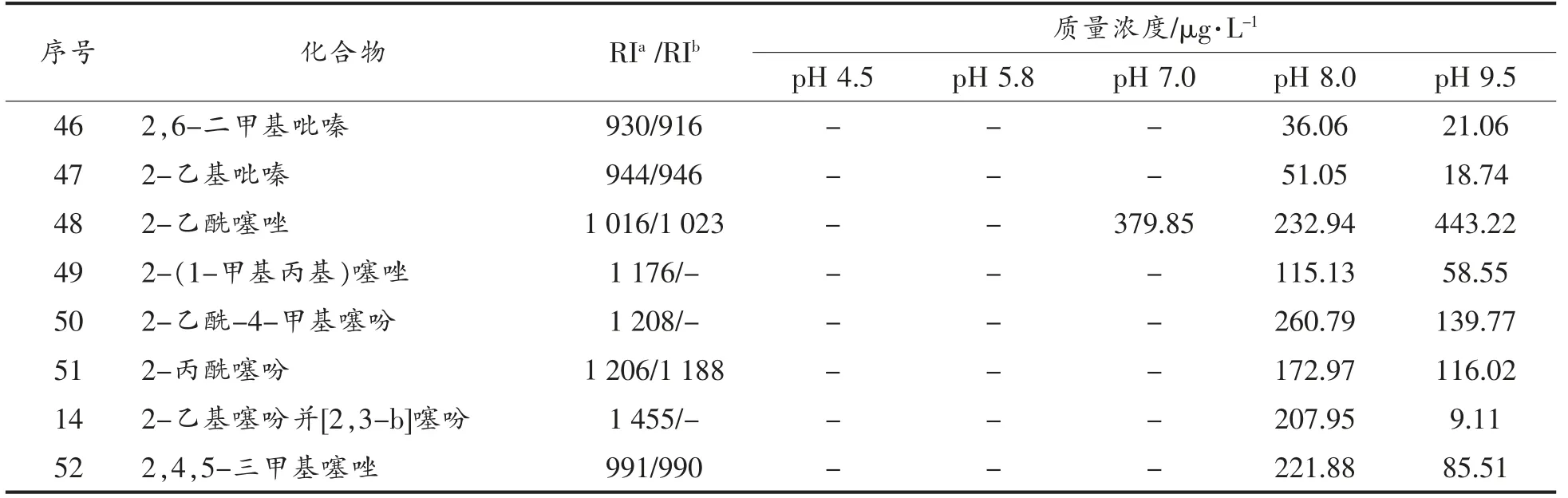
(续表4)
由表4可知,L-抗坏血酸与L-半胱氨酸反应生成的挥发性化合物主要是含硫的噻吩、噻唑、硫醇类化合物,以及含氮的吡嗪化合物。噻吩类化合物作为主要生成物,在酸、中、碱性条件下均有生成,这可能与硫元素有较好的化学活性有关。吡嗪类化合物是美拉德反应的标志性化合物,主要在碱性条件下生成,这可能是由于吡嗪的生成需要氨基前体化合物,而氨基前体化合物在碱性条件下更容易生成。
综合分析表3和表4可知,氨基前体物在碱性条件下更容易生成,吡嗪类化合物的生成依赖于氨基前体物的生成。
2.3 L-抗坏血酸/L-半胱氨酸/甘氨酸美拉德反应
L-抗坏血酸、L-半胱氨酸和甘氨酸是3 种各具代表性的化合物,用来模拟美拉德复杂反应体系有非常重要的现实意义。3 组分体系生成的挥发性化合物如表5所示。
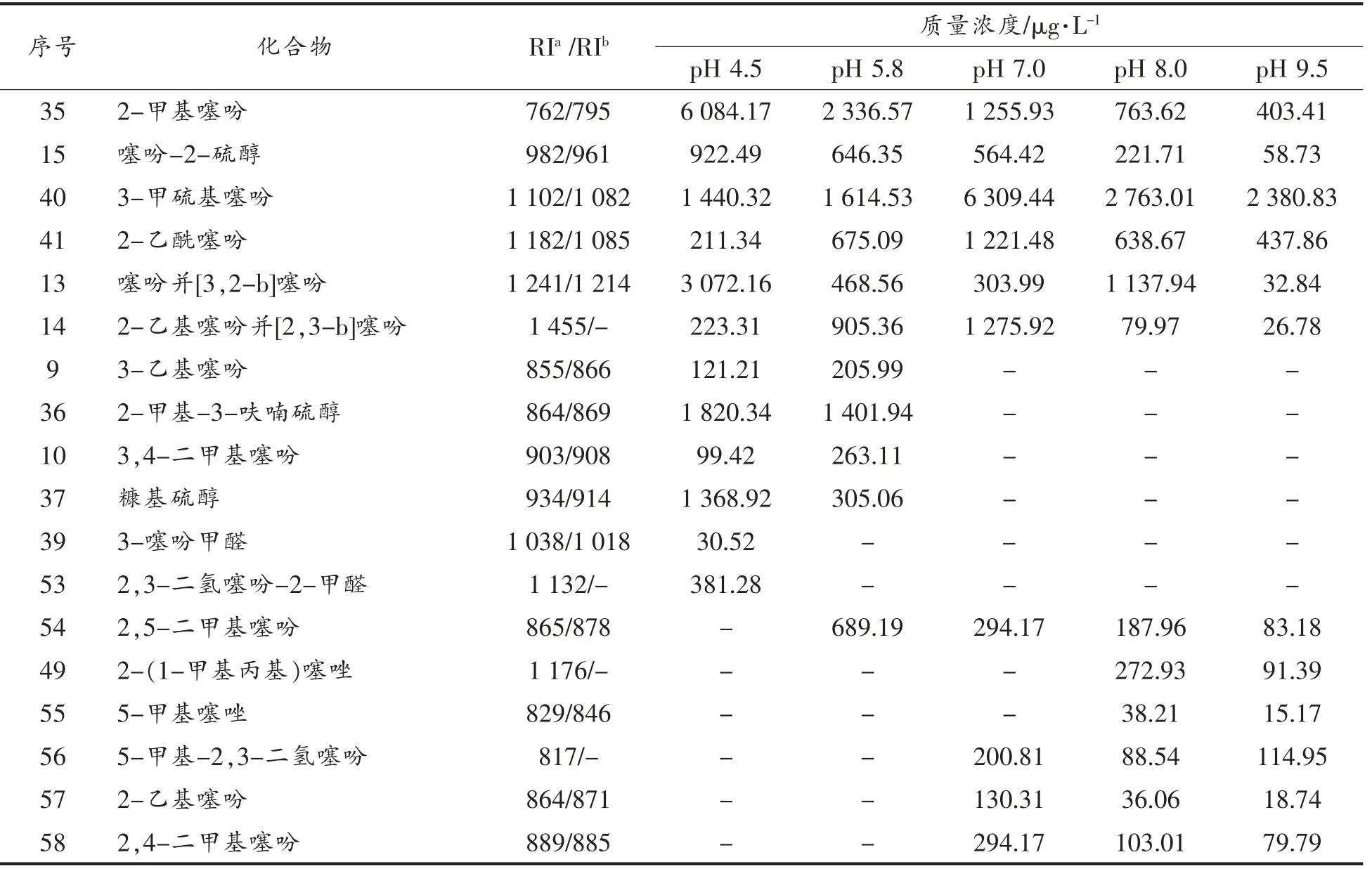
表5 L-抗坏血酸/L-半胱氨酸/甘氨酸美拉德反应挥发生物质的生成Table 5 The volatile formation in Maillard reaction of ASA/Cys/Gly
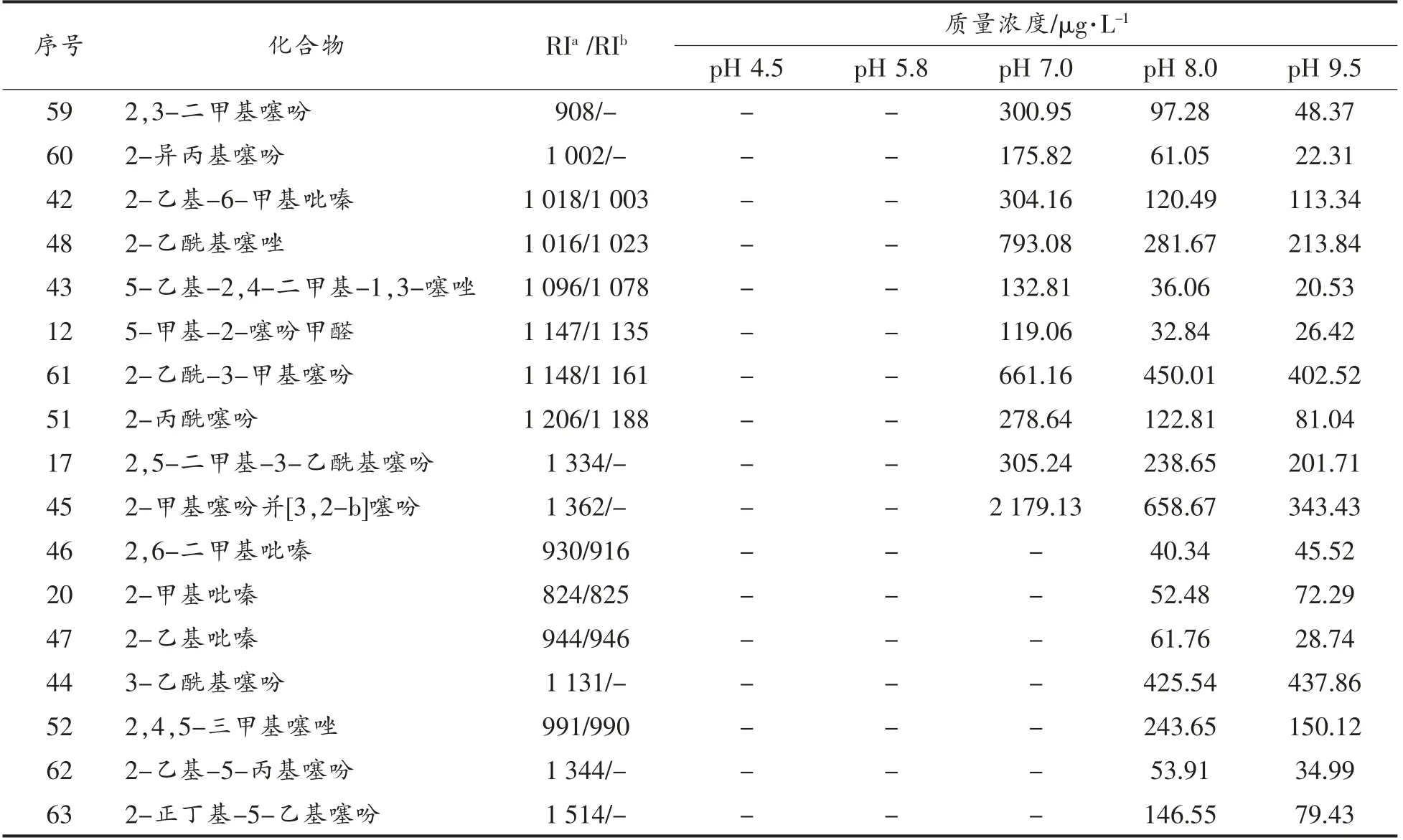
(续表5)
分析表5发现,3 组分复杂美拉德反应体系的挥发性物质主要是噻吩、噻唑和吡嗪类化合物,且体系的pH 值对各化合物的分布及生成有较大影响。噻吩类化合物在不同pH 值体系中均能生成;在酸性条件下,主要生成结构简单的噻吩类化合物和硫醇类化合物,几乎没有吡嗪类化合物生成。这与L-抗坏血酸/L-半胱氨酸2 组分反应体系比较相似,其原因可能是由于甘氨酸在酸性条件下比较稳定,没有参与到反应中去;在中碱性条件下,主要生成物是噻吩和噻唑类化合物,而吡嗪类化合物仅有少量生成。相比于L-抗坏血酸/甘氨酸体系有大量吡嗪类化合物生成,说明噻吩和噻唑类化合物的生成与吡嗪类化合物的生成具有明显的竞争关系,且噻吩和噻唑的生成占有较大优势。
由于L-抗坏血酸/L-半胱氨酸2 组分体系和L-抗坏血酸/L-半胱氨酸/甘氨酸3 组分体系在挥发性物质的生成种类分布上有相似之处,其挥发性物质的生成机制可能也类似,因此对比分析了两体系的挥发性物质生成情况雷达图,如图1所示。
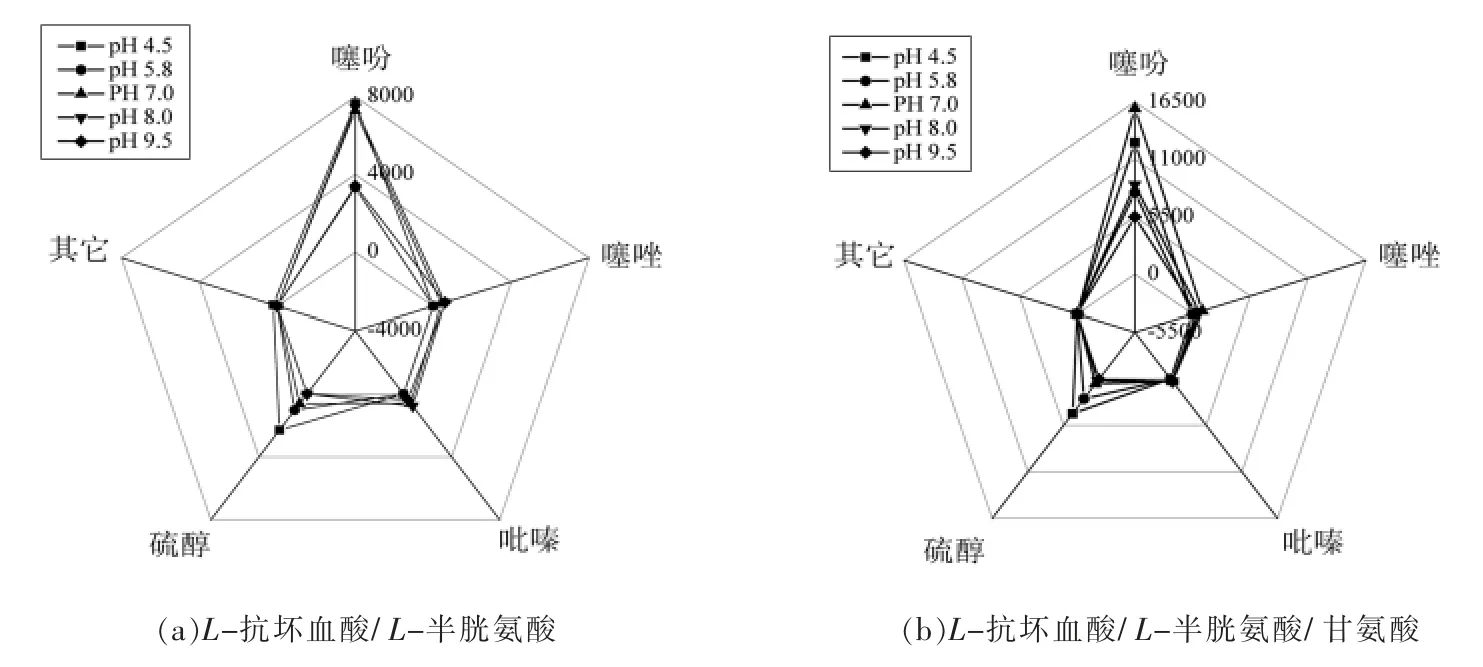
图1 不同pH 值条件下美拉德反应产物雷达图Fig.1 Radar chart of Maillard reaction products under different pH values
整体来看,2 个体系生成物的种类分布非常相似,生成物均以噻吩、噻唑、硫醇和吡嗪类化合物为主,其中,噻吩和硫醇类化合物的含量较高。在3 组分体系中由于甘氨酸的参与,氮源更加丰富,吡嗪类物质浓度可能会提高,然而对比表3~5数据发现,3 组分体系吡嗪类化合物的浓度并没有明显增加,而含硫化合物的含量有大幅增加。此结果表明含硫化合物的生成相比于吡嗪类化合物的生成在各反应体系中具有更大优势。
2.4 反应机理分析
根据不同条件下的试验结果,提出了L-抗坏血酸、L-半胱氨酸体系挥发性化合物可能的生成机制,如图2所示。
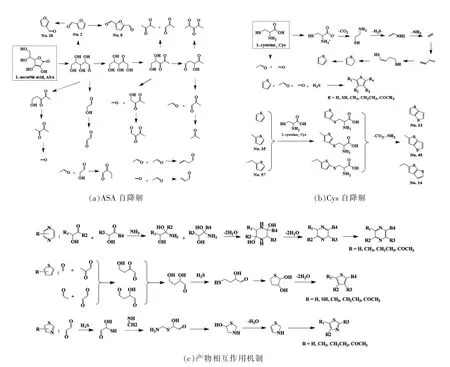
图2 L-抗坏血酸、L-半胱氨酸自降解挥发性物质的生成及其产物相互作用机制Fig.2 The volatile formation form the self-degradation of ASA and Cys and the reaction mechanism between different products
L-抗坏血酸是一个五元内酯结构,很容易水解开环、脱羧,生成阿拉伯糖或木糖等五碳糖结构。五碳糖进一步裂解,生成羟基乙醛、乙二醛、1,3-丁二酮、甲醛和乙醛等带有活泼羰基的结构,这些小分子作为活性中间体会进一步相互反应,最终生成各种挥发性化合物。L-半胱氨酸是两性化合物,大部分以离子形态存在。加热时,L-半胱氨酸发生Strecker 降解,生成氨气、硫化氢以及巯基乙醛,进一步降解生成甲醛、乙醛等小分子活性物质。L-半胱氨酸也可以通过脱羧生成2-氨基乙硫醇,再脱去硫化氢、氨气生成乙炔。乙炔在硫化氢作用下发生加成反应生成噻吩,噻吩再与各种小分子反应生成各种噻吩衍生物。
吡嗪、噻吩和噻唑类化合物的生成如图2c 所示。含有羰基的活性中间体组成目标分子的碳骨架,再由含有杂原子的硫化氢、氨气取代,最后经过脱水、环化、还原等步骤生成目标分子。
各挥发性化合物在酸、中、碱性条件下的生成机理如图3所示。在酸性条件下生成的挥发性化合物种类相对较少,主要为噻吩和硫醇类化合物。噻吩类化合物由噻吩母体结构与甲醛、乙醛发生取代反应,生成噻吩衍生物;而硫醇类化合物则是硫化氢取代氧原子生成的。在中、碱性条件下,吡嗪、噻吩和噻唑均有生成,由于各自侧基结构不同,导致最终的挥发性物质种类繁多。这些化合物侧基多为甲基、乙基和乙酰基,少数侧基为大于2个碳数的饱和/不饱和烃基。此反应过程涉及较多的亲核加成、取代、脱水及消去反应等。其中,多为2-羟基乙醛、乙二醛及其衍生物与氨气、硫化氢间的亲核加成或亲核取代反应,生成含氮、硫的中间产物,然后经过脱水环化、还原反应生成吡嗪、噻吩、噻唑、硫醇类化合物。
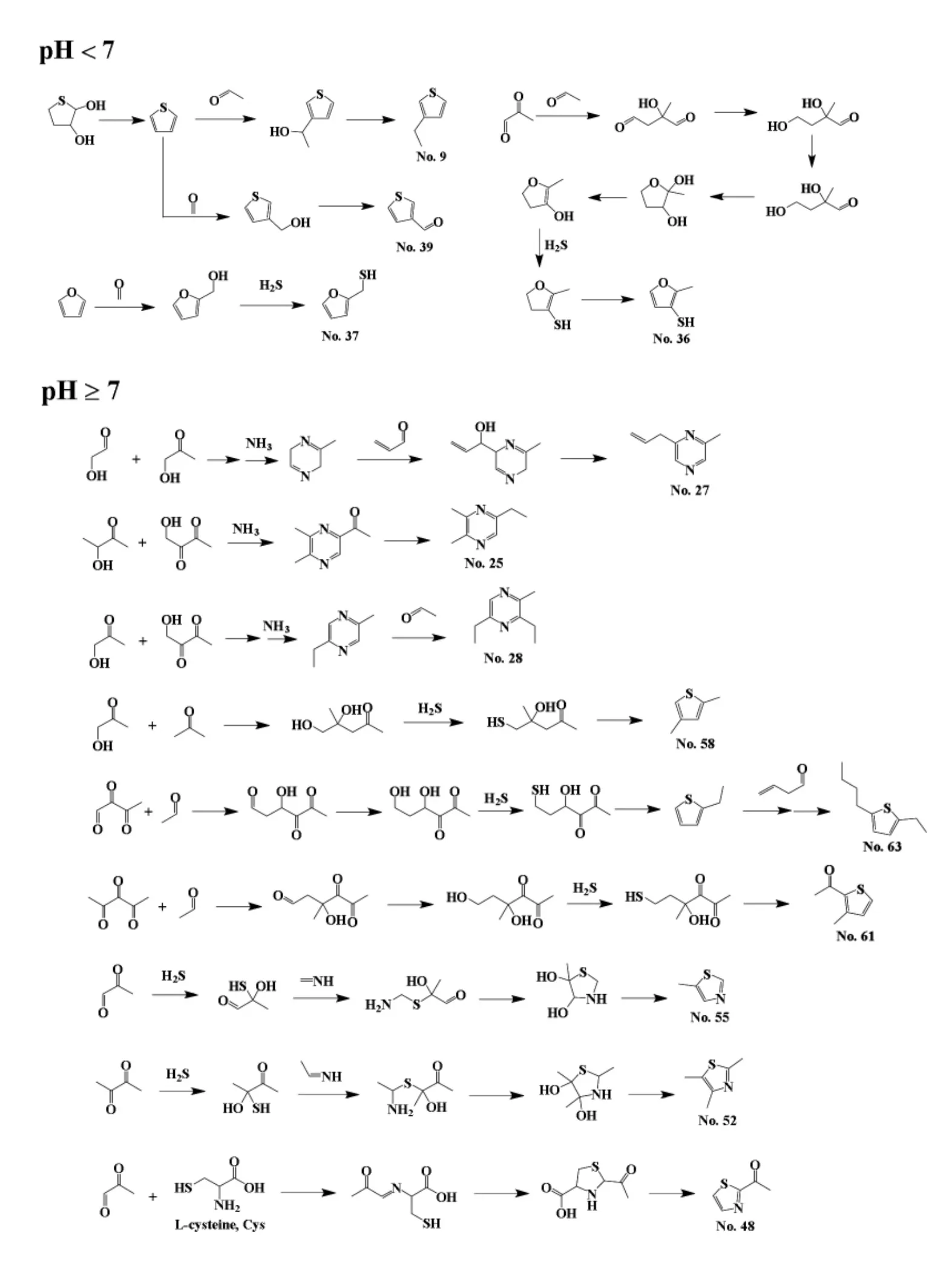
图3 酸、中、碱性条件下挥发性物质生成机制Fig.3 The formation mechanism of different volatile under acid,medium and alkaline conditions
3 结论
3 组分复杂美拉德反应体系与单组分及2 组分反应体系在挥发性物质种类与分布上有较大区别;反应体系中吡嗪类化合物和含硫类化合物存在竞争关系。从生成物的种类、分布与含量等分析发现,L-抗坏血酸自降解主要生成呋喃类化合物;L-半胱氨酸自降解主要生成噻吩类化合物;L-抗坏血酸/甘氨酸美拉德反应主要生成丰富的吡嗪类化合物;L-抗坏血酸/L-半胱氨酸美拉德反应主要生成噻吩、噻唑、吡嗪、硫醇类化合物,吡嗪类化合物种类和浓度较少;L-抗坏血酸/L-半胱氨酸/甘氨酸3 组分美拉德反应生成物的分布与L-抗坏血酸/L-半胱氨酸2 组分体系比较相似,而3 组分体系生成的物质含量更多。从反应机制上看,不含硫氨基酸的美拉德反应生成物主要为吡嗪类物质;而含硫氨基酸的美拉德反应生成物主要为含硫的噻吩、噻唑以及硫醇类化合物;当这2 种氨基酸同时存在发生美拉德反应时,二者存在竞争反应,然而由于硫原子反应活性较高,生成物仍以含硫化合物为主,伴有少量吡嗪类化合物存在。
