L-精氨酸与PD-1抗体联合调控乳腺癌小鼠免疫应答的研究①
2022-05-25王耀坤聂姗姗邱梓峰杜云婷
王耀坤,聂姗姗,邱梓峰,陈 颖,徐 兰,杜云婷
(1.佳木斯大学医学部,黑龙江 佳木斯 154007;2.佳木斯大学附属第一医院,黑龙江 佳木斯 154003;3.中国医科大学肿瘤医院,辽宁省肿瘤医院检验科,辽宁 沈阳 110042)
乳腺癌仍然是影响女性健康的最主要的恶性肿瘤之一,每年死亡的女性约占458,000人[1]。多年以来,乳腺癌在经济发达国家的发病率一直居高不下。有报道指出乳腺癌可能超过宫颈癌成为发展中国家妇女与癌症相关的主要死亡原因[2]。因此,迫切需要更有效的治疗方案来治疗和控制乳腺癌。截至目前,乳腺癌的治疗手段包括放射治疗,靶向治疗,化学治疗和内分泌治疗。对于是否成功防止治疗后复发主要取决于机体的免疫应答的及时性和效应性。因此,临床上任然需要探究有效的治疗方。L-arg是成年人的有条件必需氨基酸,在调节免疫反应中起着关键作用,研究表明使用L-arg促进乳腺癌细胞死亡[3]。细胞程序性细胞死亡蛋白1(PD-1)是一种T淋巴细胞表面受体,负性调节T细胞抗原受体信号,抑制免疫系统和T细胞炎症反应,促进自身免疫耐受[4]。有研究指出,免疫治疗对乳腺癌患者有积极作用[5]。
本研究旨在确定L-arg和PD-1抑制剂联合疗法对乳腺癌患者免疫应答及功能的影响。
1 材料与方法
1.1 实验动物和4T1荷瘤小鼠模型构建
6~8周龄雌性BALB/c小鼠,给予适宜温度和标准饲料喂养,4T1细胞在37°C的含10%胎牛血清(FBS)的RPMI 1640培养基中和含有5%CO2的培养箱中生长。将2×105个4T1乳腺癌细胞悬液经皮下注射到每只小鼠的腹侧,建立了4T1荷瘤小鼠模型,根据小鼠肿瘤体积的测量公式(0.5×长×宽2)于成瘤后第7~10天测肿瘤体积在150~200mm3间,进而确定造模成功。
1.2 主要仪器和试剂
4T1乳腺癌细胞系购自中国科学院上海细胞库,L-arg和胶原酶IV购自美国Sigma公司,PD-1抑制剂(clone 29F.1A12)和对照组的IgG单抗(clone 2A3)购自美国 Bioxcell 公司,异硫氰酸荧光素(FITC)标记的抗小鼠CD4(anti-CD4-FITC)、藻红蛋白(PE)标记的抗小鼠CD11b单克隆抗体(anti-CD11b-PE)、多甲藻叶绿素(PerCP)标记的抗小鼠CD8单克隆抗体(anti-CD8-PerCP),别藻蓝蛋白(APC)标记的抗小鼠Gr-1单克隆抗体(anti-Gr-1-APC)购自美国BD Biosciences公司。
1.3 4T1荷瘤小鼠分组及治疗
32只BALB/c随机分为4组,每组8只:4T1荷瘤组(PBS组),荷瘤后治疗组(L-arg组、anti-PD-1组、L-arg + anti-PD-1组)。于成瘤后第10天(150~200mm3)开始治疗。L-arg组小鼠灌胃L-arg[1.5g/(kg·d),连续20d][6];PD-1抑制剂组小鼠经腹膜内注射anti-PD-1[250μg/只,于成瘤后第10,14,18天治疗][7];PBS组在相同的时间点以等体积的PBS和IgG单克隆抗体治疗。
1.4 流式细胞术分析脾脏和细胞
荷瘤后第30天每组各处死3只小鼠,脾脏在无菌条件环境取下并通过200目无菌不锈钢滤网研磨,每个脾脏用10mL 10%胎牛血清溶液(fetal calf serum,FCS),25mmol/L HEPES缓冲液,0.12%庆大霉素和2mmol/L谷氨酰胺的RPMI 1640培养基制成细胞悬液。室温调至离心机350×g离心10min 后,用冰的红细胞裂解液裂解红细胞,RPMI 1640反复洗涤2次,用含10% FCS的RPMI 1640 将每个脾细胞终浓度调整至1×107个/mL,加入流式细胞管1×106个/(管·100μL)。进行anti-CD4-FITC和anti-CD8-PE进行表面染色,4 ℃避光孵育30 min,BD流式细胞仪上机检测并计数。用Flowjo v7.6.2 6.1软件进行数据分析。
1.5 流式细胞术分析肿瘤组织MDSCs(CD11b+Gr-1+)数量
荷瘤后第30天每组各处死3只小鼠,肿瘤组织取出后切成小块,用500U/mL胶原酶IV型在37°C温箱搅拌下消化1h。使所得细胞通过200目无菌不锈钢滤网研磨并用PBS缓冲液洗涤活细胞。用含10% FCS的RPMI 1640将每个肿瘤细胞终浓度调整至1×107个/mL,加入流式细胞管1×106个/(管·100μL)。进行anti-CD11b-FITC和anti-Gr-1-PE进行表面染色,4 ℃避光孵育30min,BD流式细胞仪计数。用Flowjo v7.6.2 6.1软件进行数据分析。
1.6 实时荧光定量 PCR(qRT-PCR)分析肿瘤组织IFN-γ和Treg相对表达量
小鼠处死后取出肿瘤组织,将100mg组织放于1mL TRizol中,组织匀浆后加入0.2mL氯仿将反复混合,4℃下12,000×g离心20min,将水层转移到新Ep管中。用0.5mL异丙醇0.5mL上下颠倒混匀后静置10min,4℃下12,000×g离心10min。缓慢倒掉上清,轻轻的沿离心管壁加入lmL 75%的乙醇,涡旋震荡,12,000g 4℃离心5 min后小心弃去乙醇。室温干燥沉淀5min左右,25μL RNase-free溶解沉淀,56℃ 10min 水浴后进行 RNA定量,于-80℃保存。总RNA用寡聚(dT)引物进行逆转录。将得到的cDNA样品用于进行qRT-PCR测定,SYBR Green PCR试剂盒用于测定IFN-γ和TNF-α。此处使用的引物序列见表1。PCR在ABI PRISM 7500装置上进行40个循环。计算阈值并使用PE Biosystem软件量化mRNA。β-actin是用作内参来确定每个目标基因的相对比例。通过熔解曲线分析PCR数值。引物序列:β-actin:上游引物5’-GATTACTGCTCTGGCTCCTAGC-3’,下游引物5’-GACTCATCGTACTCCTGCTTGC-3’。IFN-γ:上游引物5’-GTTACTGCCACGGCACAGTCATTG-3’,下游引物5’-ACCATCCTTTTGCCAGTTCCTCCAG-3’。TNF-α:上游引物5’-GCAAGCTTCGCTCTTCTGTCTACTGAACTTCGG-3’,下游引物5’-GCTCTAGAATGAGATAGCAAATCGGCTGACGG-3’。
1.7 统计学方法
采用SPSS17.0进行统计学分析,采用独立样本t检验分析各组小鼠血脑屏障通透性及流式细胞数据。检验水准为α=0.05。
1.8 伦理批准和患者知情同意
本研究的动物实验使用遵循实验动物相关规范,不涉及患者知情同意。
2 结果
2.1 不同组别小鼠的肿瘤大小,生存期,及肿瘤重量比较
荷瘤后第28-56天,PBS组肿瘤体积显著高于L-arg + anti-PD-1组(P<0.05)。PBS组小鼠PBS组小鼠死亡发生在荷瘤后第13天至第56天;L-arg组、anti-PD-1组、L-arg + anti-PD-1组死亡均发生于荷瘤后第16,28和53天;同时,荷瘤后第70天,PBS组与L-arg组小鼠全部死亡,而anti-PD-1组、L-arg + anti-PD-1组各有25%和43%的小鼠存活。见图1。
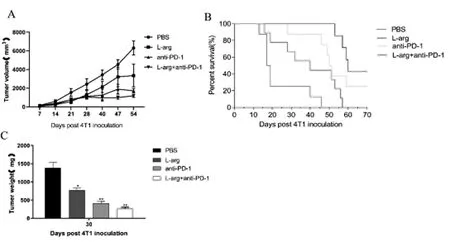
图1 4T1荷瘤小鼠经L-arg、anti-PD-1治疗后的肿瘤体积,生存期,肿瘤重量分析
2.2 脾脏中和细胞的流式细胞术结果
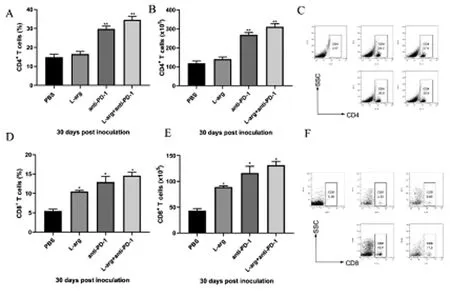
图2 4T1荷瘤小鼠经L-arg、anti-PD-1治疗后的脾脏中和细胞的百分比、绝对数和散点图
2.3 肿瘤中MDSCs细胞的流式细胞术结果
流式细胞术检测小鼠荷瘤30d肿瘤组织中MDSCs细胞百分比和绝对数,结果显示PBS组(28.91±3.00)%高于L-arg组(21.35±3.00)%(t=3.89,P< 0.05)和L-arg+anti-PD-1组(15.3±1.13)%(t=7.34,P<0.01)但与anti-PD-1组(22.08±4.50)%(t=2.18,P>0.05)无统计学意义。见图3。
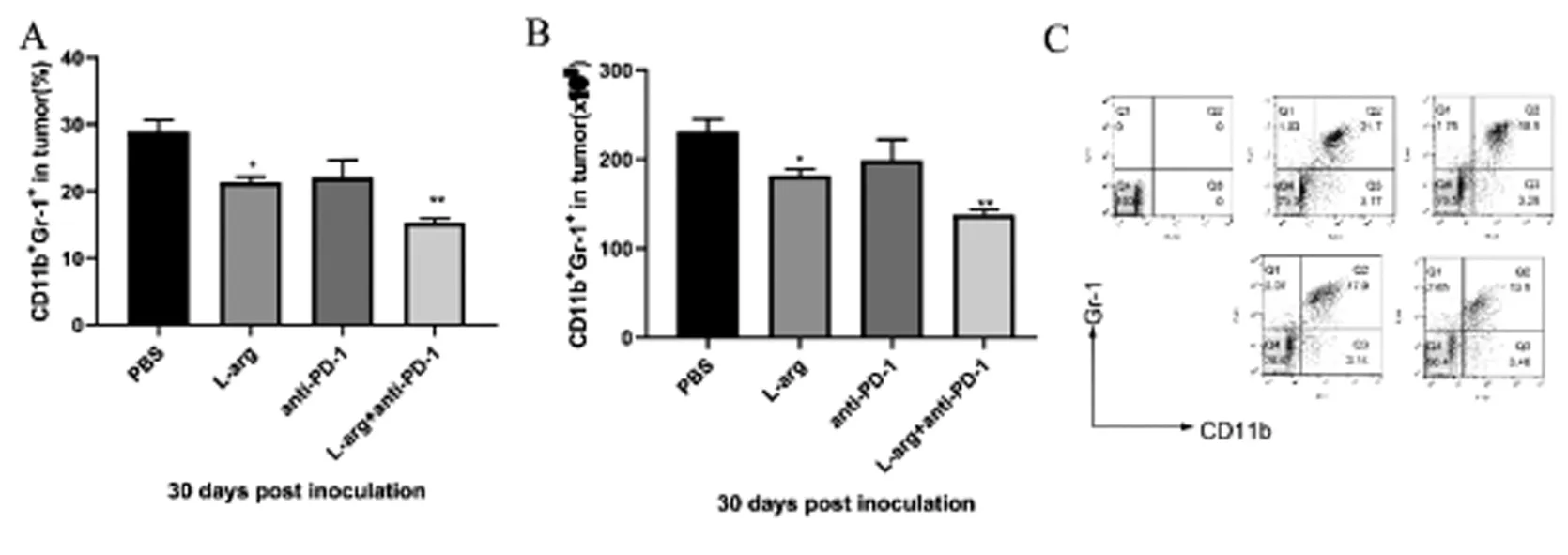
图3 4T1荷瘤小鼠经L-arg、anti-PD-1治疗后的肿瘤组织中MDSCs细胞的百分比、绝对数和散点图
2.4 肿瘤中IFN-γ和TNF-α相对表达量
实时定量PCR中检测小鼠荷瘤30d肿瘤组织中IFN-γ和TNF-α的mRNA相对表达量,结果显示PBS组(1.39±0.39)% IFN-γ的mRNA相对表达量均低于L-arg组(2.41±0.32)%(t=3.47,P<0.05),anti-PD-1组(3.83±0.97)%(t=4.03,P<0.05),L-arg+anti-PD-1组(6.08±0.50)(t=12.71,P<0.01),PBS组(1.31±0.28)% 中TNF-α的mRNA相对表达量均低于L-arg组(5.08±0.55)%(t=9.43,P<0.01),anti-PD-1组(7.16±1.02)%(t=9.57,P>0.01),L-arg+anti-PD-1组(8.77±0.72)%(t=16.64,P<0.01)。见图4。
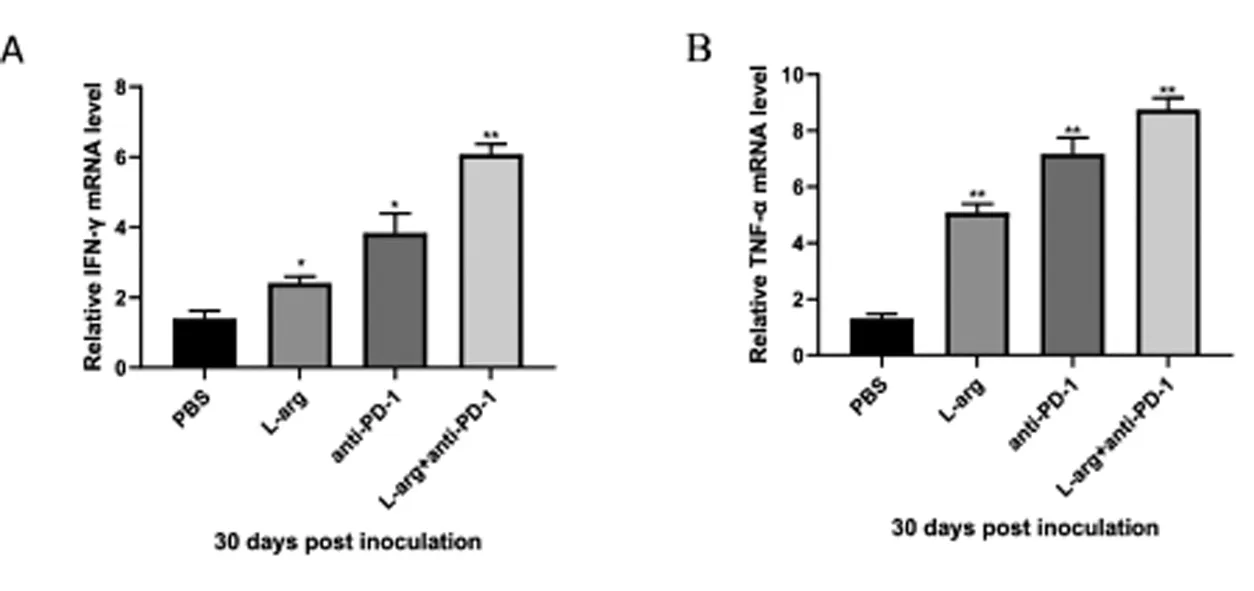
图4 4T1荷瘤小鼠肿瘤中IFN-γ和TNF-α mRNA的相对表达量
3 讨论