怀姜的化学成分及其抗炎活性研究
2022-05-25廖怀玉韩佳颖韩红园刘文波张海艳赵天增
廖怀玉,韩佳颖,韩红园,刘文波,常 霞,杨 静,张海艳,赵天增
河南省科学院 天然产物重点实验室,郑州 450002
怀姜为姜科姜属植物姜(ZingiberofficinaleRoscoe)的新鲜根茎,产自古怀庆府,为河南省焦作市博爱县特产,河南省省级非物质文化遗产,中国国家地理标志产品。主产于博爱县北部的清化、月山(上庄)、柏山、徐良等乡镇和沁阳市山王庄镇一带,栽培迄今已有1 600多年的历史。博爱县土地疏松肥沃,雨量充沛,光照充足,气候温和,独特的自然环境非常适宜怀姜的生长。怀庆府盛产的生姜,是同类生姜中的佼佼者,块节紧凑、丝细色黄、味道鲜辣、质地致密,具有抗寒、健胃、发汗、祛病之功效。用于感冒风寒,呕吐,痰饮等疾病的治疗。
目前,对怀姜的研究集中在种植、栽培、营养成分等方面,系统的化学成分组研究未见报道[1-4]。为阐明怀姜的药效物质基础,为怀姜的开发利用提供理论基础,本课题组首次对怀姜化学成分进行系统分离,并采用1D(1H NMR、13C NMR、DEPT)和2D(1H-1H COSY、HSQC、HMBC、NOESY)核磁共振技术对化合物进行结构鉴定[5-8],共鉴定了12个化合物(见图1)。植物姜属于药食两用类植物,经口毒性实验证明生姜属于无毒级物质。姜辣素是植物姜的主要化学成分,具有3-甲氧基-4-羟基苯基结构单元,有较强的抗炎活性。有研究表明化合物6-姜酚、8-姜酚、10-姜酚、6-姜烯酚具有抗炎活性并且有了较为深入的研究[9]。故而选择分离鉴定出的部分化合物进行抗炎活性筛选。为怀姜的开发利用及抗炎新药的研发提供参考。
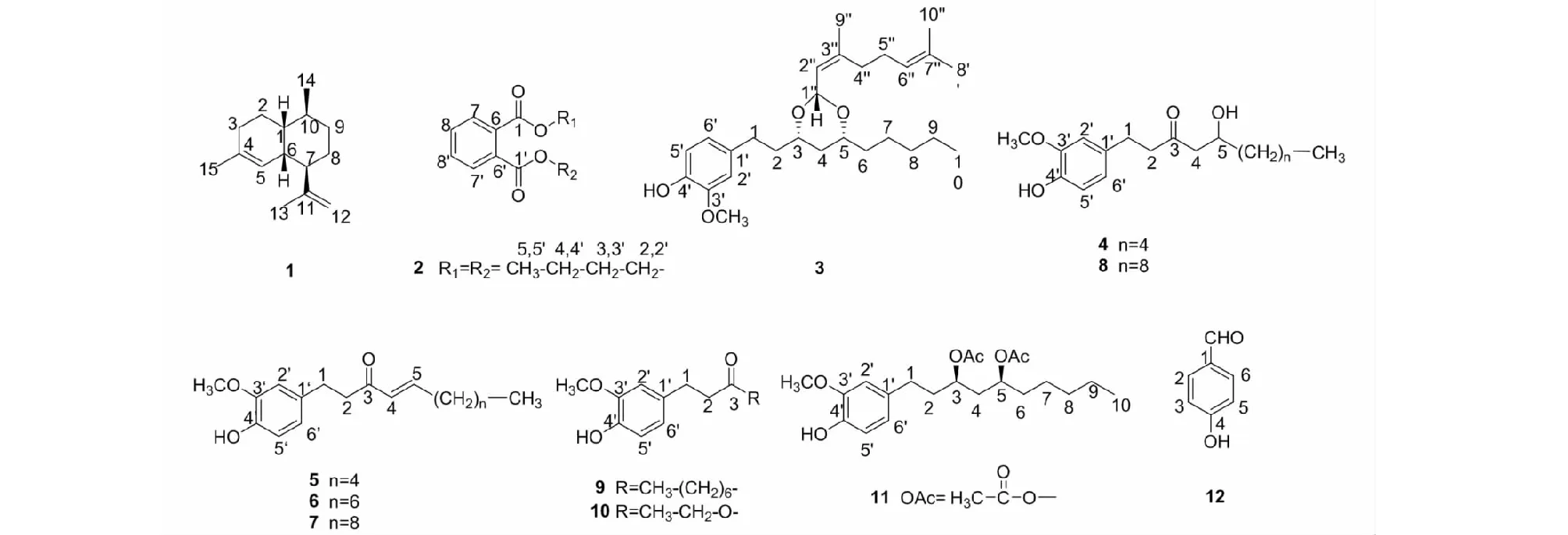
图1 化合物1~12的化学结构
1 材料与方法
1.1 仪器与试剂
Bruker ARX-400 型核磁共振仪(瑞士Bruker公司,TMS内标);正向硅胶(200~300目);GF254薄层色谱硅胶(青岛海洋化工);Waters 600E型分析半制备高效液相色谱(美国Waters公司);SunFire®C18OBD制备色谱柱(10 mm×250 mm,5 μm,美国Waters公司);FS-8200S型中压快速纯化制备系统(天津艾杰尔科技有限公司);RP-18(Germany,40~63 μm);其他试剂均为分析纯。
1.2 材料
怀姜采自河南省博爱县月山镇,经河南省中医药研究院张留记教授鉴定为姜科姜属多年生草本植物姜(ZingiberofficinaleRoscoe)的新鲜根茎。
1.3 实验方法
1.3.1 提取与分离
取怀姜10 kg,切碎,用10倍量70%乙醇回流提取3次,每次提取2 h,合并提取液减压浓缩得浸膏,将浸膏混悬于水中,使用乙酸乙酯萃取3次,得到乙酸乙酯萃取物170 g。乙酸乙酯部位经正向硅胶色谱柱(200~300 目),使用石油醚-乙酸乙酯(100∶1→1∶9)进行梯度洗脱,在100∶1洗脱部位得到化合物1(15.6 mg)。TLC检识合并相同馏分,得到组分 Fr.1~Fr.5。Fr.1通过RP-18硅胶柱柱层析,以乙腈-水(30∶70→60∶40)梯度洗脱,得到4个组分Fr.1-1~Fr.1-4,Fr.1-1经分析半制备高效液相色谱用乙腈-水(60∶40)得到化合物2(218.6 mg,tR= 50 min)。Fr.2经分析半制备高效液相色谱用乙腈-水(80∶20)得到化合物3(20.5 mg,tR= 42 min)。Fr.3经分析半制备高效液相色谱用乙腈-水(65∶35)得到化合物4(110.0 mg,tR= 14 min)、5(130.0 mg,tR= 20 min)、6(8.8 mg,tR= 30 min)、化合物7(11.8 mg,tR= 66 min)、8(12.3 mg,tR= 53 min)。Fr.4通过RP-18硅胶柱,以乙腈-水(10∶90→60∶40)梯度洗脱,得到Fr.4-1~Fr.4-6,Fr.4-5为化合物9(122.2 mg),Fr.4-3经分析半制备高效液相色谱用乙腈-水(25∶75)得到化合物10(6.5 mg,tR= 76 min)。Fr.5经分析半制备高效液相色谱用乙腈-水(55∶45)得到化合物11(211.0 mg,tR= 36 min)、12(7.7 mg,tR= 90 min)。
1.3.2 抗炎活性筛选
RAW 264.7小鼠单核巨噬细胞,置于37 ℃,5% CO2的培养箱中孵育。于96孔细胞培养板中每孔加入100 μL细胞悬液,6×10个细胞/孔,将培养板置于CO2培养箱中培养12 h。弃上清,加入50 μL含药培养液,每个单体设4个浓度(5、10、15、20 μM),每个浓度设3个平行孔,另设正常对照孔。2 h后,加入50 μL脂多糖溶液,脂多糖终浓度为0.5 μg/mL。加药后,培养板于微孔板振荡器上振荡混匀,置于37 ℃、CO2培养箱中继续培养24 h。吸取培养液上清50 μL,根据说明书进行NO含量检测,用酶标仪于540 nm处测定吸光度值,绘制标准曲线,计算样品中NO含量。所得结果用软件GraphPad Prism 8.0.1处理。
2 结果与分析
2.1 结构鉴定
化合物1无色油状物;1H NMR(400 MHz,CDCl3)δ:5.30(1H,m,H-5),4.74(1H,m,H-12b),4.71(1H,m,H-12a),2.23(1H,m,H-6),1.96(1H,m,H-7),1.96(2H,m,H-3),1.85(1H,m,H-2b),1.71(3H,s,C-13),1.71(1H,m,H-10),1.62(3H,s,C-15),1.60(1H,m,H-8b),1.60(1H,m,H-9b),1.60(1H,m,H-1),1.33(1H,m,H-2a),1.30(1H,m,H-8a),1.30(1H,m,H-9a),1.03(3H,d,J=6.8 Hz,H-14);13C NMR(100 MHz,CDCl3)δ:39.1(C-1),25.7(C-2),30.5(C-3),133.4(C-4),125.6(C-5),34.6(C-6),48.1(C-7),26.2(C-8),27.8(C-9),32.9(C-10),148.7(C-11),110.2(C-12),20.3(C-13),19.5(C-14),23.6(C-15)。以上数据与文献[10]对照一致,故鉴定化合物1为(-)-muurola-4,11-diene。
化合物2无色油状物;1H NMR(400 MHz,CDCl3)δ:7.71(2H,m,H-7,7′),7.52(2H,m,H-8,8′),4.31(4H,t,J=6.8Hz,H-2,2′),1.72(4H,m,H-3,3′),1.44(4H,m,H-4,4′),0.96(6H,t,J=6.8 Hz,H-5,5′);13C NMR(100 MHz,CDCl3)δ:167.7(C-1,1′),65.5(C-2,2′),30.5(C-3,3′),19.2(C-44′),13.7(C-5,5′),132.3(C-6,6′),128.8(C-7,7′),130.9(C-8,8′)。以上数据与文献[11]对照一致,故鉴定化合物2为邻苯二甲酸二丁酯。
化合物3无色油状物;1H NMR(400 MHz,CDCl3)δ:6.82(1H,d,J=8.0 Hz,H-5′),6.70(1H,d,J=2.0 Hz,H-2′),6.68(1H,dd,J=8.0,2.0 Hz,H-6′),5.33(1H,dq,J=6.4,1.2 Hz,H-2′′),5.18(1H,d,J=6.4 Hz,H-1′′),5.11(1H,tq,J=6.8,1.2 Hz,H-6′′),3.86(3H,s,3′-OCH3),3.62(1H,m,H-5),3.62(1H,m,H-3),2.72(1H,m,H-1b),2.62(1H,m,H-1a),2.12(2H,m,H-5′′),2.05(2H,m,H-4′′),1.90(1H,m,H-2b),1.74(3H,d,J=1.2 Hz,1.70(1H,m,H-2a),1.68(3H,br s,H-8′′),1.60(1H,m,H-6b),1.58(3H,br s,H-10′′),1.50(1H,m,H-4b),1.42(1H,m,H-6a),1.42(1H,m,H-7b),1.28(1H,m,H-7a),1.28(1H,m,H-4a),1.28(2H,m,H-8),1.28(2H,m,H-9),0.88(3H,t,J=6.8 Hz,H-10),H-9′′);13C NMR(100 MHz,CDCl3)δ:30.9(C-1),37.8(C-2),75.4(C-3),36.9(C-4),76.5(C-5),35.9(C-6),24.7(C-7),31.8(C-8),22.6(C-9),14.0(C-10),133.9(C-1′),111.0(C-2′),146.4(C-3′),143.7(C-4′),114.2(C-5′),121.0(C-6′),98.6(C-1′′),122.5(C-2′′),142.3(C-3′′),39.3(C-4′′),26.2(C-5′′),123.9(C-6′′),131.7(C-7′′),25.7(C-8′′),17.4(C-9′′),17.7(C-10′′),55.8(3′-OCH3)。以上数据与文献[12]对照一致,故鉴定化合物3为(2Z)-neral acetal-[6]-gingerdiol。
化合物4黄色油状物;1H NMR(400 MHz,CDCl3)δ:6.81(1H,d,J=8.0 Hz,H-5′),6.67(1H,d,J=2.0 Hz,H-2′),6.64(1H,dd,J=8.0,2.0 Hz,H-6′),4.03(1H,m,H-5),3.84(3H,s,3′-OCH3),2.82(2H,A2B2系统-A2,J=6.4 Hz,H-1),2.72(2H,A2B2系统-B2,J=6.4 Hz,H-2),2.55(1H,ABX系统-B,J=17.2,3.2 Hz,H-4b),2.50(1H,ABX系统-A,J=17.2,8.4 Hz,H-4a),1.47(1H,m,H-6b),1.42(1H,m,H-7b),1.38(1H,m,H-6a),1.38(1H,m,H-7a),1.30(2H,m,H-9),1.28(2H,m,H-8),0.88(3H,t,J=6.8 Hz,H-10);13C NMR(100 MHz,CDCl3)δ:29.3(C-1),45.4(C-2),211.5(C-3),49.3(C-4),67.7(C-5),36.4(C-6),25.1(C-7),31.7(C-8),22.6(C-9),14.0(C-10),132.6(C-1′),111.1(C-2′),146.5(C-3′),144.0(C-4′),114.5(C-5′),120.7(C-6′),55.9(3′-OCH3)。以上数据与文献[13]对照一致,故鉴定化合物4为6-姜酚。
化合物5黄色油状物;1H NMR(400 MHz,CDCl3)δ:6.82(1H,d,J=8.0 Hz,H-5′),6.81(1H,dt,J=15.9,7.1 Hz,H-5),6.71(1H,d,J=1.8 Hz,H-2′),6.68(1H,dd,J=8.0,1.8 Hz,H-6′),6.09(1H,dt,J=15.9,1.3 Hz,H-4),5.58(1H,br s,4′-OH),3.86(3H,s,3′-OCH3),2.86(2H,J=7.0 Hz,H-1),2.83(2H,J=7.0 Hz,H-2),2.19(2H,dq,J=7.1,1.3 Hz,H-6),1.44(2H,m,H-7),1.30(2H,m,H-9),1.28(2H,m,H-8),0.89(3H,t,J=7.0 Hz,H-10);13C NMR(100 MHz,CDCl3)δ:29.9(C-1),41.9(C-2),199.9(C-3),130.3(C-4),147.9(C-5),32.4(C-6),27.8(C-7),31.3(C-8),22.4(C-9),13.9(C-10),133.2(C-1′),111.1(C-2′),146.4(C-3′),143.9(C-4′),114.3(C-5′),120.8(C-6′),55.9(3′-OCH3)。以上数据与文献[14]对照一致,故鉴定化合物5为6-姜烯酚。
化合物6黄色油状物;1H NMR(400 MHz,CDCl3)δ:6.82(1H,d,J=8.0 Hz,H-5′),6.79(1H,dt,J=16.0,6.8 Hz,H-5),6.71(1H,d,J=1.8 Hz,H-2′),6.68(1H,dd,J=8.0,1.8 Hz,H-6′),6.09(1H,dt,J=16.0,1.2 Hz,H-4),5.49(1H,s,5′-OH),3.87(3H,s,3′-OCH3),2.86(2H,J=7.0 Hz,H-1),2.83(2H,J=7.0 Hz,H-2),2.19(2H,dq,J=6.8,1.2 Hz,H-6),1.44(2H,m,H-7),1.28(8H,m,H-8,9,10,11),0.88(3H,t,J=6.8 Hz,H-12);13C NMR(100 MHz,CDCl3)δ:29.9(C-1),42.0(C-2),199.8(C-3),130.3(C-4),147.9(C-5),32.5(C-6),28.1(C-7),29.1*(C-8),29.0*(C-9),31.7(C-10),22.6(C-11),14.1(C-12),133.3(C-1′),111.1(C-2′),146.4(C-3′),143.9(C-4′),114.3(C-5′),120.8(C-6′),55.9(3′-OCH3)。以上数据与文献[14]对照一致,故鉴定化合物6为8-姜烯酚。
化合物7黄色油状物;1H NMR(400 MHz,CDCl3)δ:6.82(1H,d,J=8.0 Hz,H-5′),6.79(1H,dt,J=16.0,6.8 Hz,H-5),6.71(1H,d,J=1.8 Hz,H-2′),6.68(1H,dd,J=8.0,1.8 Hz,H-6′),6.09(1H,dt,J=16.0,1.2 Hz,H-4),5.48(1H,s,5′-OH),3.87(3H,s,3′-OCH3),2.86(2H,J=7.0 Hz,H-1),2.83(2H,J=7.0 Hz,H-2),2.19(2H,dq,J=6.8,1.2 Hz,H-6),1.44(2H,m,H-7),1.26(12H,m,H-8,9,10,11,12,13),0.88(3H,t,J=6.8 Hz,H-14);13C NMR(100 MHz,CDCl3)δ:29.9(C-1),42.0(C-2),199.8(C-3),130.3(C-4),147.9(C-5),32.5(C-6),28.1(C-7),29.2*(C-8),29.3*(C-9),29.5*(C-10),29.4*(C-11),32.5(C-12),22.7(C-13),14.1(C-14),133.3(C-1′),111.1(C-2′),146.4(C-3′),143.9(C-4′),114.3(C-5′),120.8(C-6′),55.9(3′-OCH3)。以上数据与文献[14]对照一致,故鉴定化合物7为10-姜烯酚。
化合物8黄色油状物;1H NMR(400 MHz,CDCl3)δ:6.82(1H,d,J=8.0 Hz,H-5′),6.68(1H,d,J=2.0 Hz,H-2′),6.64(1H,dd,J=8.0,2.0 Hz,H-6′),5.51(1H,s,J=2.0 Hz,4′-OH),4.02(1H,m,H-5),3.87(3H,s,3′-OCH3),2.93(1H,d,J=4.0 Hz,5-OH),2.83(2H,J=7.1 Hz,H-1),2.73(2H,J=7.1 Hz,H-2),2.55(1H,J=17.4,3.0 Hz,H-4b),2.49(1H,J=17.4,8.8 Hz,H-4a),1.38(1H,m,H-6a),1.48(1H,m,H-6b),1.27(1H,br s,H-7a),1.38(1H,m,H-7b),1.27(12H,br s,H-8,9,10,11,12,13),0.88(3H,t,J=8.0 Hz,H-14);13C NMR(100 MHz,CDCl3)δ:29.3(C-1),45.4(C-2),211.4(C-3),49.4(C-4),67.7(C-5),36.5(C-6),25.5(C-7),29.5*(C-8),29.5*(C-9),29.5*(C-10),29.6*(C-11),31.9(C-12),22.7(C-9),14.1(C-14),132.6(C-1′),111.0(C-2′),146.4(C-3′),144.0(C-4′),114.4(C-5′),120.8(C-6′),55.9(3′-OCH3),其中*归属可互换。以上数据与文献[14]对照一致,故鉴定化合物8为10-姜酚。
化合物9黄色油状物;1H NMR(400 MHz,CDCl3)δ:6.81(1H,d,J=8.0 Hz,H-5′),6.69(1H,d,J=2.0 Hz,H-2′),6.66(1H,dd,J=8.0,2.0 Hz,H-6′),3.86(3H,s,3′-OCH3),2.82(2H,t,J=7.6 Hz,H-1),2.69(2H,t,J=7.6 Hz,H-2),2.37(2H,t,J=7.6 Hz,H-4),1.54(2H,m,H-5),1.25(8H,m,H-6,7,8,9),0.87(3H,t,J=7.2 Hz,H-10);13C NMR(100 MHz,CDCl3)δ:29.6(C-1),44.6(C-2),210.8(C-3),43.2(C-4),23.8(C-5),29.2(C-6),29.1(C-7),31.7(C-8),22.6(C-9),14.1(C-10),133.1(C-1′),111.1(C-2′),143.9(C-3′),146.5(C-4′),114.4(C-5′),120.8(C-6′),55.9(3′-OCH3)。以上数据与文献[14]对照一致,故鉴定化合物9为6-paradol。
化合物10褐色油状物;1H NMR(400 MHz,CDCl3)δ:6.83(1H,d,J=8.0 Hz,H-5′),6.71(1H,d,J=1.6 Hz,H-2′),6.64(1H,dd,J=8.0,1.6 Hz,H-6′),4.13(2H,q,J=6.8 Hz,H-4),3.87(3H,s,3′-OCH3),2.88(2H,t,J=7.6 Hz,H-1),2.56(2H,t,J=7.6 Hz,H-2),1.24(3H,t,J=6.8 Hz,H-5);13C NMR(100 MHz,CDCl3)δ:30.7(C-1),36.4(C-2),173.0(C-3),60.4(C-4),14.2(C-5),132.5(C-1′),111.0(C-2′),146.4(C-3′),55.9(3′-OCH3),144.0(C-4′),114.3(C-5′),120.9(C-6′)。以上数据与文献[15]对照一致,故鉴定化合物10为dihydroferulic acid ethyl ester。
化合物11黄色油状物;1H NMR(400 MHz,CDCl3)δ:6.81(1H,d,J=8.0 Hz,H-5′),6.66(1H,d,J=2.0 Hz,H-2′),6.63(1H,dd,J=8.0,2.0 Hz,H-6′),4.94(1H,m,H-5),4.94(1H,m,H-3),3.86(3H,s,3′-OCH3),2.55(2H,m,H-1),2.05(3H,s,5-OAc),1.99(3H,s,3-OAc),1.89(2H,m,H-2),1.89(1H,m,H-4b),1.75(1H,dt,J=8.4,5.6 Hz,H-4a),1.51(2H,m,H-6),1.25(6H,m,H-7,8,9),0.87(3H,t,J=6.8 Hz,H-10);13C NMR(100 MHz,CDCl3)δ:31.2(C-1),35.9(C-2),70.9(C-3),38.4(C-4),71.2(C-5),34.2(C-6),24.7(C-7),31.5(C-8),22.5(C-9),13.9(C-10),133.1(C-1′),111.1(C-2′),146.5(C-3′),143.9(C-4′),114.4(C-5′),120.8(C-6′),170.7*[3-OAc(C=O)],21.1**[3-OAc(CH3)],170.8*[5-OAc(C=O)],21.2**[5-OAc(CH3)],55.8(3′-OCH3),其中*归属可互换,**归属可互换。以上数据与文献[16]对照一致,故鉴定化合物11为(3R,5S)-3,5-diacetoxy-1-(4-hydroxy-3- methoxy- phenyl)decane。
化合物12黄色油状物;1H NMR(400 MHz,CDCl3)δ:9.66(1H,s,CHO),7.68(2H,d,J=8.4 Hz,H-2,6),6.82(2H,J=8.4 Hz,H-3,5);13C NMR(100 MHz,CDCl3)δ:192.9(CHO),165.3(C-4),133.5(C-2,6),130.3(C-1),116.9(C-3,5)。以上数据与文献[17]对照一致,故鉴定化合物12为p-hydroxybenzaldehyde。
2.2 活性测试结果
Dugasani[18]研究发现6-姜酚、8-姜酚、10-姜酚、6-姜烯酚可以抑制脂多糖诱导的炎症细胞产生NO,发挥其抗炎功效,6-姜酚、8-姜酚可以抑制其NO的产生(P<0.05),10-姜酚可以显著抑制NO的产生(P<0.01),6-姜烯酚有极其显著抑制NO的产生(P<0.001)。本实验采用脂多糖(LPS)诱导的RAW 264.7细胞炎症模型[19-21],以吲哚美辛为阳性对照,对怀姜中分离得到的化合物1、3、6、7、9、11进行了抗炎活性筛选,结果化合物3(IC50=13.16 μg/mL)、6(IC50=1.63 μg/mL)、9(IC50=2.38 μg/mL)、11(IC50=6.56 μg/mL)对LPS诱导的炎症细胞中NO的产生有明显的抑制作用,表现出比阳性对照吲哚美辛(IC50=15.84 μg/mL)更强的抗炎活性(见表1)。

表1 化合物1、3、6、7、9和11的体外抗炎活性
3 讨论与结论
植物姜中主要含有挥发油、姜辣素、二苯基庚烷类化合物[22]。本研究首次对怀姜的化学成分进行了系统分离,从怀姜的乙酸乙酯部位分离得到12个化合物,包含1个倍半萜类化合物,2个羧酸酯类化合物,8个姜辣素类化合物及1个其他类化合物,其中8个姜辣素成分为2个姜酚、3个姜烯酚、1个副姜油酮、2个姜辣二醇。除化合物5之外,其余11个化合物均为首次从怀姜中分离得到,4个化合物为首次从姜属植物中分离得到。
在LPS诱导的炎症细胞中,一氧化氮合酶(iNOS)表达增加,催化NO生成,进而促使细胞分泌炎症标志因子肿瘤坏死因子(TNF-α),TNF-α诱导白细胞介素-1(IL-1)和白细胞介素-6(IL-6)表达释放,使炎性损伤的级联效应放大,从而进一步加剧炎症反应[19]。生姜提取物可以通过降低iNOS和环氧化酶-2(COX-2)的mRNA表达抑制LPS诱导的炎症细胞NO和前列腺素E2(PGE2)释放增加,进一步下调炎症因子的表达,减少炎症因子的释放,发挥抗炎功效[9]。姜辣素类化合物对炎症介质(NO和PGE2)的产生有明显的抑制作用,且呈明显的剂量依赖性;浓度为6 μM时,6-姜烯酚对产生NO和PGE2的抗炎抑制作用优于10-姜酚,10-姜酚对产生NO和PGE2的抗炎抑制作用优于6-姜酚、8-姜酚;姜酚的碳链长度影响其抗炎活性,不饱和酮结构使得姜烯酚抗炎活性优于姜酚[18]。Van Breemen等[23]使用纯化的人类重组蛋白环氧化酶-1(COX-1)、环氧化酶-2(COX-2)代替细胞实验方法,发现8-姜烯酚、10-姜烯酚和10-姜酚通过抑制COX-2而非抑制COX-1的产生发挥抗炎作用;浓度为1.3 μM时,10-姜烯酚比8-姜烯酚对COX-2的抑制作用更强。本研究选取化合物(-)-muurola-4,11-diene、(2Z)-neral acetal-[6]-gingerdiol、8-姜烯酚、10-姜烯酚、6-paradol、(3R,5S)-3,5-diacetoxy-1-(4-hydroxy-3-methoxy-phenyl)decane,以脂多糖(LPS)诱导的RAW 264.7细胞炎症为模型,以NO含量为评价指标,吲哚美辛为阳性对照,评价化合物的抗炎活性;结果显示,化合物(2Z)-neral acetal-[6]-gingerdiol、8-姜烯酚、6-paradol、(3R,5S)-3,5-diacetoxy-1-(4-hydroxy-3-methoxy-phenyl)decane与吲哚美辛相比均具有更强的抗炎活性,其中8-姜烯酚的抗炎活性优于化合物(2Z)-neral acetal-[6]-gingerdiol、6-paradol、(3R,5S)-3,5-diacetoxy-1-(4-hydroxy-3-methoxy-phenyl)decane。本文抗炎活性研究以抑制iNOS的表达,降低LPS诱导的炎症细胞NO的释放,进而起到抗炎的功效,证实8-姜烯酚具有良好的抗炎活性,可能是开发治疗炎症疾病的良好候选药物。本研究不仅丰富了怀姜的化学结构信息,为其抗炎活性的研究提供依据,也为怀姜的开发利用提供基础。
致谢:郑州大学分析测试中心的朱卫国老师帮助进行核磁共振仪样品测试,中国医学科学院药物研究所的秦海林研究员团队帮助进行抗炎活性筛选,在此特致谢意!
