欧李多糖的制备、结构表征及免疫调节活性研究
2022-05-25冯荦荦董兆斌廖玉美王国良张润光张有林
冯荦荦,王 锐,董兆斌,廖玉美,王国良,张润光,张有林*
1陕西师范大学食品工程与营养科学学院,西安 710119;2陕西省林业技术推广总站,西安 710082;3陕西省商洛盛大实业股份有限公司,商洛 726000;4陕西省城固县农业机械管理站,汉中 723200
欧李(Cerasushumilis(Bge.) Sok.)为蔷薇科樱桃属落叶小灌木,主要分布在黑龙江、吉林、辽宁等省区,是我国大西北干旱区域造林的先锋树种,也是我国的特有果树[1]。欧李果实鲜红饱满,果肉具特殊香气,含钙量极高,被誉为“钙果”,是天然钙素来源和保健水果,也是“第三代功能水果”之一[2]。欧李果实富含多种糖类、有机酸、氨基酸、维生素及矿质元素,是一种具有较高营养价值的水果[3]。欧李种仁为药食同源的中药材郁李仁[4]。多糖是一类大分子聚合物,具有免疫调节[5]、抗肿瘤[6]、抗癌、抗菌、抗氧化等多种药理活性。近年来用欧李果实深加工研发的产品有欧李果汁[7]、果脯[8]、果酒等,但关于对欧李多糖的研究鲜有报道。本文以陕西榆林沙地栽培的欧李为原料,对其多糖制备、结构特征及其免疫调节活性进行研究,旨在为我国欧李资源开发利用提供理论基础和技术支持。
1 材料与方法
1.1 材料与试剂
欧李果实(陕西省榆林市沙漠研究所,果实完熟,批号:202002);RAW 264.7巨噬细胞(中国热带农业科学院椰子研究所细胞库,批号:20200822);甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖均为标准品(上海源叶生物科技有限公司,批号:C11M10H82342、Y27M11C114179、O12A10K95105、R09J11H115178、S12J10I90131、080M00143V、Z22J9H64187、B02M6 W1、Z01J9H62701、F05D9Y75981);DMEM高糖培养基(美国赛默飞世尔科技公司,批号AF29494674);NO试剂盒(上海碧云天生物技术有限公司,批号:011020200903);TNF-α、IL-6、IFN-β试剂盒(上海酶联生物科技有限公司,批号:202101);其他试剂均为分析纯。
1.2 仪器与设备
RE-52AA型旋转蒸发器(上海亚荣生化仪器厂);LGJ-25C真空冷冻干燥机(北京四环科学仪器厂);Multiskan Go型全波长酶标仪(美国热电公司);UV300型紫外分光光度计(上海仪迈仪器科技有限公司);1260Ⅱ型高效液相色谱仪(美国安捷伦科技公司);ELEOS System凝胶色谱仪(美国怀雅特技术公司);傅里叶红外变换光谱仪(德国布鲁克公司);CO2恒温培养箱(美国赛默飞世尔科技有限公司)。
1.3 实验方法
1.3.1 欧李多糖的提取
采用传统的水提醇沉法。将欧李鲜果去核晒干粉碎,过0.25 mm孔径筛,得欧李干粉。称取欧李干粉20.0 g,加入适量95%乙醇浸泡,去除果粉中多余的还原糖与杂质,过滤后滤渣加适量蒸馏水,用不同温度的热水浸提一段时间,提取液真空抽滤,循环提取3次,合并3次提取液,减压浓缩至原体积1/4,然后缓慢加入4倍体积的95%乙醇,充分混匀,放置于4 ℃冰箱沉淀24 h,离心取沉淀物,加入100 mL蒸馏水,旋蒸去除乙醇,得到欧李粗多糖溶液。
1.3.2 单因素试验
以蒸馏水为提取溶剂,液料比20∶1(mL/g),提取时间2.0 h,设置提取温度分别为60、70、80、90、100 ℃,考察提取温度对欧李多糖得率的影响;以液料比20∶1(mL/g),提取温度80 ℃,设置提取时间分别为1.0、1.5、2.0、2.5、3.0 h,考察提取时间对欧李多糖得率的影响;以提取时间2.0 h,提取温度80 ℃,设置液料比分别为10∶1、15∶1、20∶1、25∶1、30∶1(mL/g),考察液料比对欧李多糖得率的影响。
1.3.3 响应面法优化试验
选取提取温度X1、提取时间X2、液料比X3三个因素,以欧李多糖得率为响应值,采用响应面分析法,得到二次回归方程,并找出最佳工艺参数。试验设计如表1所示。

表1 响应面试验设计因素与水平
1.3.4 欧李多糖得率的测定
采用苯酚-硫酸法[9]。准确称取适量的葡萄糖,分别配制成浓度为0、20、40、60、80、100 μg/mL的葡萄糖标准溶液。各吸取1.0 mL溶液,加入1.0 mL 5%苯酚和5.0 mL浓硫酸,摇晃均匀,30 ℃水浴反应20 min。冷却后在490 nm波长下用分光光度计测定吸光度值。以浓度为横坐标,吸光度值为纵坐标绘制标准曲线,得到标准曲线方程:y=6.137 3x+0.122 4,R2=0.999 7。
取1.0 mL欧李多糖溶液,加入1.0 mL 5%苯酚和5.0 mL浓硫酸,30 ℃水浴反应20 min,冷却后在490 nm波长下测定吸光度值,代入标准曲线,得出多糖浓度。再用公式计算欧李多糖得率(以干粉计)。
式中,c:从标准曲线上查得样品测定液中多糖的浓度,单位为mg/mL;V:样品定容体积,单位为mL;m:样品质量,单位为g;n:稀释倍数。计算结果保留至小数点后两位。
1.3.5 欧李多糖的分离纯化
1.3.5.1 蛋白质、色素脱除
在欧李粗多糖溶液中加入约1/4体积的Sevage试剂(正丁醇∶氯仿=1∶4),去除沉淀,反复操作约10次,直至蛋白质去除完全。用D-101大孔树脂脱色6 h,并用5 000 Da截留量的透析袋透析48 h,去除小分子杂质,冷冻干燥,得到较高纯度的欧李多糖(Cerasushumilispolysaccharide,CHP)。
1.3.5.2 DEAE-52纤维素柱层析
用蒸馏水以1 mL/min流速将DEAE-52纤维素层析柱(2.6 mm×30 cm)平衡12 h,称取适量欧李多糖,充分溶解在蒸馏水中,离心,上清液经0.45 μm微孔滤膜过滤,然后上样,用0、0.1、0.2、0.3、0.5 mol/L氯化钠溶液梯度洗脱,流速0.5 mL/min,每管收集5 mL,采用苯酚-硫酸法测定洗脱液中多糖含量,以收集管号为横坐标,每管洗脱液吸光度为纵坐标,绘制洗脱曲线。合并单个洗脱峰的收集液,浓缩、透析、冻干,得到两个主要组分,分别命名为CHPP-1和CHPP-2。
1.3.5.3 G-100葡聚糖凝胶柱层析
将DEAE-52纤维素柱层析中收集到的0.1、0.2 mol/L NaCl洗脱组分分别用G-100葡聚糖凝胶柱层析进一步纯化。分别取20 mg DEAE-52纤维素柱层析后的欧李多糖样品,溶于5.0 mL蒸馏水,溶解完全后离心,取上清液纯化,蒸馏水为洗脱剂,洗脱速度0.3 mL/min,每5 min收集1管,测定洗脱液中多糖含量,以收集管号为横坐标,每管洗脱液吸光度为纵坐标,绘制洗脱曲线,收集主峰的洗脱液,浓缩、透析、冻干,备用。
1.3.5.4 紫外光谱分析
准确称取CHPP-1、CHPP-2各10 mg,蒸馏水定容10 mL,得到浓度1 mg/mL的欧李多糖水溶液,以蒸馏水作空白,以200~900 nm为扫描范围,全波长扫描。
1.3.6 欧李多糖单糖组成分析和分子量测定
用PMP衍生化单糖,具体操作参考文献,略有修改[10]。分别取适量CHPP-1、CHPP-2于水解管中,加入4 mol/L三氟乙酸1 mL,于120 ℃烘箱中水解2 h。取出后氮气吹干;向吹干后的样品中加1mL 0.5 mol/L PMP-甲醇溶液以及0.5 mL 0.3 mol/L NaOH溶液,70 ℃水浴60 min,冷却,加0.5 mL 0.3 mol/L HCl溶液和0.5 mL氯仿,振荡摇匀,静置20 min,弃去下层,萃取三次,取水层过膜上机。
高效液相色谱测定单糖色谱条件:流速1.0 mL/min,进样量10 μL,检测波长245 nm,柱温25 ℃,洗脱液:流动相A(0.1 mol/L磷酸二氢钾,pH 6.8)∶流动相B(乙腈)=82∶18。色谱柱:SHISEIDO C18柱(4.6 mm×250 mm,5 μm)。
分子量测定采用凝胶渗透色谱仪,具体操作参考文献,略有修改[11]。分别精准称取CHPP-1、CHPP-2适量,溶于0.02% NaN3溶液,进样分析。将Shodex OHpak色谱柱接入ELEOS System凝胶色谱仪,采用Waters 515泵激光检测器分离检测,数据由ARTRAV软件自动处理。色谱条件:流动相水+0.02% NaN3,流速1 mL/min,柱温40 ℃,进样量500 μL。
1.3.7 欧李多糖的红外光谱分析
分别称取一定质量的CHPP-1、CHPP-2,加入适量的KBr研磨混匀压片,以KBr为扫描背景,利用红外光谱仪在4 000~400 cm-1范围扫描。
1.3.8 CHPP-2对RAW 264.7细胞增殖影响试验
细胞培养:将复苏后的RAW 264.7接入含10%胎牛血清的DEME高糖完全培养液中,于二氧化碳培养箱(37 ℃,5% CO2)中培养。
采用MTT试验法检测CHPP-2对RAW 264.7细胞增殖的影响。收集对数生长期的RAW 264.7细胞,使细胞繁殖到5×105个/mL,将200 μL细胞悬液接种于96孔细胞培养板中孵育24 h,弃去上层清液。每孔加入100 μL不同浓度的CHPP-2(20、40、80、160、320、640 μg/mL);阳性对照组加入100 μL含有LPS(1 μg/mL)的培养液;空白对照组(control,CT)加入等体积的培养液,每组四个重复。边缘孔用PBS填充,避免细胞上清液蒸发。将96孔细胞培养板置于培养箱中孵育24 h,每孔避光加入10 μL MTT(5 mg/mL),继续培养4 h。去除原有培养液,每孔加入100 μL二甲基亚砜溶液,震荡混合均匀,以充分溶解紫色的甲瓒结晶。10 min后,在570 nm处使用全波长酶标仪测量各孔的吸光值。
1.3.9 CHPP-2对RAW 264.7细胞分泌NO和细胞因子影响试验
RAW 264.7细胞接种于24孔板中,使每孔细胞密度为2×105个/mL,在二氧化碳培养箱中(37 ℃,5% CO2)孵育。24 h后倒掉培养液,在24孔板中加入不同浓度的CHPP-2(20、40、80、160、320、640 μg/mL)继续培养24 h。以LPS(1 μg/mL)作阳性对照。孵育结束后,用NO试剂盒测定NO含量,用Elisa试剂盒测定上清液中TNF-α、IL-6、INF-β含量。
1.4 数据处理
采用Origin 2019b软件作图,利用DPS软件方差分析,多重比较采用Duncan新复极差测验,P<0.01为差异极显著,P<0.05为差异显著。
2 结果与分析
2.1 提取温度、提取时间、液料比对欧李多糖得率的影响
由图1A看出,提取温度在60~80 ℃之间,随温度升高欧李多糖得率显著提高(P<0.05)。80 ℃时得率最高,为30.99%,随后随着提取温度升高,多糖得率显著下降。结果表明,在一定的温度范围内,随着提取温度升高,欧李多糖在萃取体系中的传递阻力减小,溶解度增大。但过高温度会破坏多糖的结构,导致欧李多糖降解[12],最佳提取温度为80 ℃。由图1B看出,在1~2 h范围内,随着提取时间的延长,欧李多糖得率略有增加(P>0.05),2 h达到最高,为26.92%。2 h后有所下降,2 h为最佳提取时间。由图1C看出,液料比从10∶1(mL/g)增加到15∶1(mL/g),欧李多糖得率显著提高(P<0.05),当液料比为15∶1(mL/g)时,达到28.05%,随着液料比继续增大,多糖得率基本不变,最佳液料比为15∶1(mL/g)。

图1 提取温度、提取时间、液料比对欧李多糖得率的影响
2.2 响应面法优化试验结果
对所得的试验结果使用Design-Expert 8.0.6进行分析,得到回归方程如下:
Y=32.51-0.095X1-0.24X2+1.13X3+0.27X1X2-1.19X1X3-0.51X2X3-1.75X12-2.24X22-2.99X32。式中X1是提取温度,X2是提取时间,X3是液料比。对回归模型进行方差分析,结果见表2、表3。由表2、表3看出,回归模型具有高度显著性(P<0.000 1),失拟项具有不显著性(P=0.150 1>0.05),回归模型可靠。回归方程各项方差分析表明,因素X3对欧李多糖得率有极显著影响(P<0.01),X12对欧李多糖得率有显著影响(P<0.05),X22、X32对欧李多糖得率有极显著影响(P<0.000 1),因子X1X2、X2X3对欧李多糖得率影响不显著(P>0.05),因子X1X3对欧李多糖得率影响极显著(P<0.01)。各因素对欧李多糖得率的影响依次是X3(液料比)>X2(提取时间)>X1(提取温度)。

表2 响应面优化试验结果

表3 响应面试验方差分析

续表3(Continued Tab.3)
对二次响应方程方差分析结果做响应面图(见图2)。由二次多项式方程得到欧李多糖的最佳提取条件为:提取温度78.93 ℃,提取时间1.96 h,液料比16.08∶1(mL/g),在此提取条件下,预测欧李干粉多糖得率为32.65%。根据实际情况,调整提取温度为79 ℃,提取时间为2 h,液料比为16∶1(mL/g),进行验证实验,欧李干粉多糖得率为(32.18±0.08)%(n=3),与预测值无显著性差异(P>0.05)。

图2 各因素及交互作用对欧李多糖得率的响应面图
2.3 欧李多糖分离纯化结果
用浓度分别为0、0.1、0.2、0.3、0.5 mol/L NaCl溶液梯度洗脱,得到三个单一洗脱峰(见图3A)。其中0.1、0.2 mol/L NaCl 溶液为主要洗脱峰,对其进行G-100 葡聚糖凝胶柱层析,均得到一个洗脱峰,分别命名为CHPP-1、CHPP-2(见图3B、3C)。将其分别收集洗脱液、透析、冷冻干燥备用。经苯酚-硫酸法测得CHPP-1、CHPP-2中多糖含量分别为99.16%和99.33%。此外,对CHP、CHPP-1、CHPP-2用紫外光谱全波长扫描,结果见图4,CHPP-1和CHPP-2在250~300 nm之间无吸收峰,说明CHPP-1、CHPP-2均不含核酸和蛋白质。
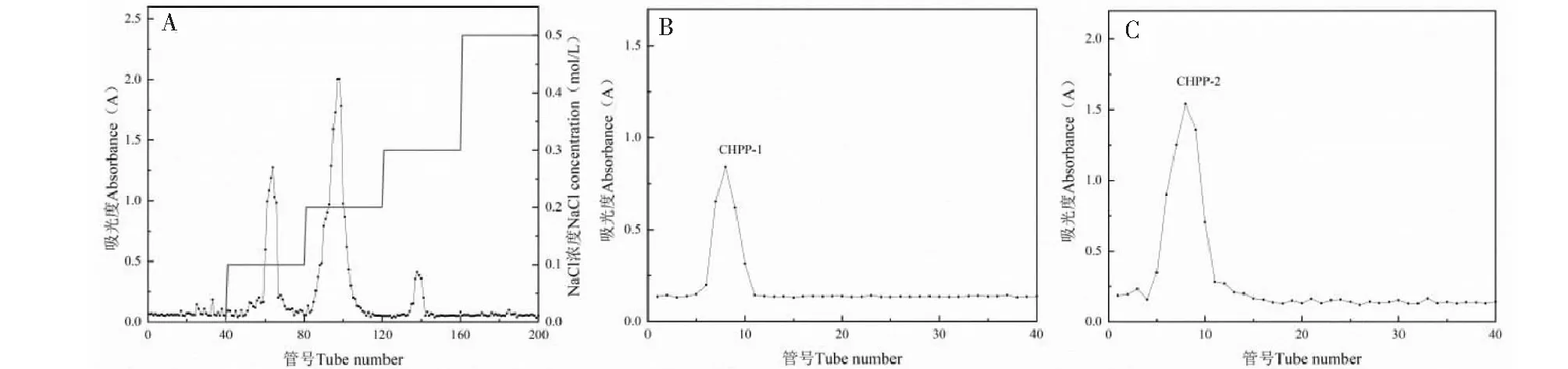
图3 欧李多糖的纯化洗脱曲线
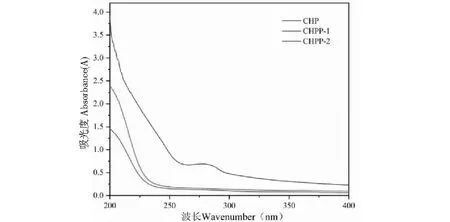
图4 CHP、CHPP-1、CHPP-2组分的紫外光谱图
2.4 欧李多糖的单糖组成和分子量测定
用单糖标准品做对照,用高效液相色谱法测定欧李多糖的单糖组成,结果见图5。由图5看出,CHPP-1由十种单糖组成,其相应摩尔占比依次为:甘露糖(1.35%)、核糖(0.11%)、鼠李糖(4.58%)、葡萄糖醛酸(0.10%)、半乳糖醛酸(20.29%)、葡萄糖(1.75%)、半乳糖(17.36%)、木糖(2.71%)、阿拉伯糖(51.40%)、岩藻糖(0.35%);CHPP-2由九种单糖组成,其相应摩尔占比依次为:甘露糖(0.62%)、鼠李糖(5.68%)、葡萄糖醛酸(0.07%)、半乳糖醛酸(28.24%)、葡萄糖(9.72%)、半乳糖(11.68%)、木糖(1.07%)、阿拉伯糖(41.81%)、岩藻糖(1.11%)(见表4)。结果可知,欧李多糖组分CHPP-1和CHPP-2均主要由阿拉伯糖、半乳糖醛酸、半乳糖三种单糖组成。采用凝胶渗透色谱仪测定欧李多糖的分子量,其中CHPP-1组分的分子量为47.26 kDa,CHPP-2组分的分子量为22.94 kDa。

图5 10种单糖标准品和欧李多糖的HPLC谱图

表4 CHPP-1、CHPP-2的单糖组成及摩尔占比
2.5 欧李多糖的红外光谱扫描结果
CHP、CHPP-1、CHPP-2的红外光谱扫描结果见图6。由图6可知3 442.46 cm-1附近宽而强的吸收峰属于O-H伸缩振动[13]。在2 794.05 cm-1附近的吸收峰则是由糖烷基的C-H伸缩振动引起[14]。C=O的强峰出现在1 593.12 cm-1,说明存在羧基[15]。1 366.97 cm-1处的吸收峰代表了C-H的角弯曲[16]。900~1 200 cm-1范围内的吸收峰为C-O-C拉伸振动和C-O-H弯曲振动峰[17]。三个组分在786.95 cm-1处均出现吸收峰,表明三者均含有α-糖苷键[18]。
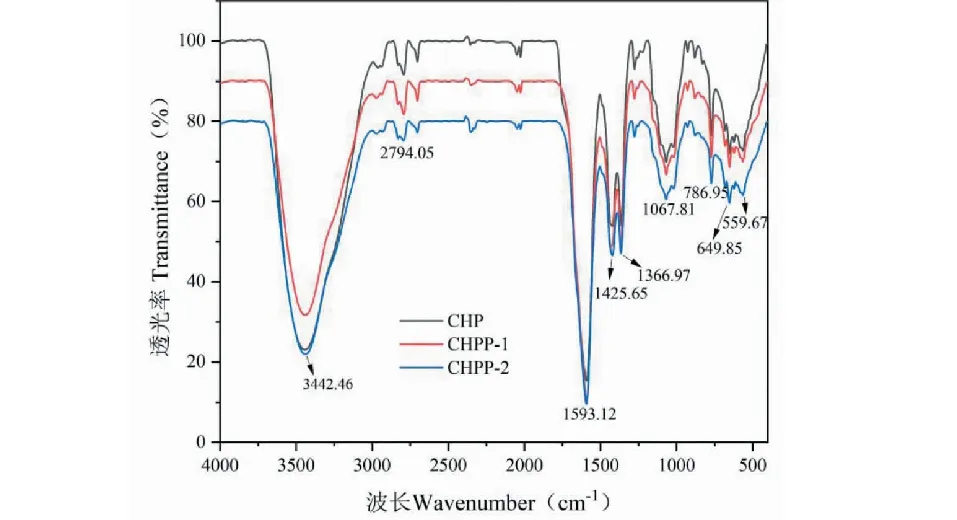
图6 CHP、CHPP-1、CHPP-2组分的红外光谱图
2.6 CHPP-2对RAW 264.7细胞增殖的影响
由图7看出,正常状况下,细胞呈圆球形,体积小。不同浓度CHPP-2(20~640 μg/mL)作用于细胞24 h后,其体积增大。同时,细胞的密度也呈增大的趋势。试验结果表明,CHPP-2对RAW 264.7细胞具有一定的活化作用,由此可推测CHPP-2具有潜在的免疫调节活性。CHPP-2对RAW 264.7细胞增殖的影响见图8,由图8看出,CHPP-2在20~640 μg/mL浓度范围内,均能显著提高巨噬细胞的增殖活性,且有剂量依赖关系,说明CHPP-2浓度对巨噬细胞无毒性。

图7 CHPP-2对细胞形态的影响
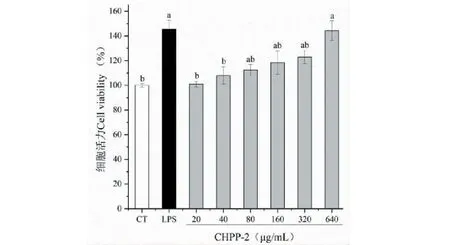
图8 不同浓度CHPP-2对RAW 264.7细胞增殖的影响
2.7 CHPP-2对RAW 264.7细胞分泌NO及TNF-α、IL-6、IFN-β的影响
NO在机体很多组织中调节多种生理过程,检测在多糖刺激下巨噬细胞上清液中亚硝酸盐浓度即可判断NO的产生量[19]。将不同浓度梯度的CHPP-2溶液加入细胞24 h后,取上清液测定NO含量,结果见图9A。由图9A看出,细胞在不同浓度(20~640 μg/mL)CHPP-2的作用下培养24h后,与CT组相比,NO释放量增加,且有统计学差异(P<0.05)。随着溶液浓度的增加,细胞NO释放量呈上升趋势,且具有一定的剂量依赖性。试验结果表明,CHPP-2能够激活RAW 264.7细胞,促进RAW 264.7细胞分泌NO。
TNF-α、IL-6、IFN-β细胞因子含量在衡量免疫调节作用中起着重要作用。用不同浓度梯度CHPP-2加入细胞24 h后,取上清液,参照Elisa试剂盒说明书测定TNF-α、IL-6、IFN-β含量,结果见图9B、图9C和图9D。结果表明,与CT组比较,高、中、低剂量CHPP-2呈剂量依赖关系促进细胞分泌TNF-α、IL-6、IFN-β,且有统计学差异(P<0.05)。CHPP-2能激活RAW 264.7细胞,促进RAW 264.7细胞分泌及释放TNF-α、IL-6、IFN-β。

图9 不同浓度CHPP-2对RAW 264.7细胞分泌NO及TNF-α、IL-6、IFN-β的影响
3 讨论与结论
巨噬细胞是评估生物活性成分免疫调节功能的重要载体。巨噬细胞通过分泌多种细胞因子如一氧化氮(NO)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、干扰素-β(IFN-β)、白介素-1(IL-1)等来发挥其免疫功能。植物多糖通过调节巨噬细胞中细胞因子的分泌量来调节其免疫功能。NO作为重要的信号分子介导细胞内多种生物学功能,有助于杀死肿瘤细胞和病原微生物[20]。TNF-α可由激活的巨噬细胞产生,能直接参与维护免疫内稳态,包括炎症、分化、脂质代谢和凋亡等[21]。有关研究表明,IL-6可由多种细胞分泌产生,被认为是在诱导急性期蛋白反应期间与发热有关的最重要的免疫调节介质[22]。IFN-β参与抗病毒免疫,减少T细胞增生,诱导树突状细胞生长、成熟及活化,抑制B细胞和T细胞凋亡[23]。这些细胞因子主要是免疫细胞分泌的一些小分子蛋白质,在机体的免疫和炎症反应中发挥重要作用。Yao等[19]研究发现绿豆多糖显著增加了巨噬细胞中NO、TNF-α和IL-6的释放。Du等[21]研究发现无花果多糖可以显著促进细胞毒性分子(NO)和细胞因子(TNF-α和IL-6)的分泌以及RAW 264.7巨噬细胞的吞噬作用。Ren等[24]研究了沙蒿籽多糖对RAW 264.7细胞的影响,发现沙蒿籽多糖能显著促进RAW 264.7细胞中NO、TNF-α、IL-6和IFN-β的分泌。这与本实验得出的欧李多糖能显著促进RAW 264.7细胞中NO、TNF-α、IL-6及IFN-β细胞因子释放的结果相一致,表明欧李多糖具有免疫调节活性。
采用水提醇沉法提取欧李多糖,得到最佳提取工艺条件为提取温度79 ℃,提取时间2 h,液料比16∶1(mL/g),欧李干粉多糖得率为(32.18±0.08)%。CHPP-1、CHPP-2中多糖含量分别为99.16%和99.33%。CHPP-1的主要单糖组成及摩尔比为阿拉伯糖∶半乳糖醛酸∶半乳糖=51.4∶20.29∶17.36,分子量为47.26 kDa。CHPP-2的主要单糖组成及摩尔比为阿拉伯糖∶半乳糖醛酸∶半乳糖=41.81∶28.24∶11.68,分子量为22.94 kDa。欧李多糖为吡喃环型多糖。CHPP-2在20~640 μg/mL浓度范围内能激活巨噬细胞,显著促进NO、TNF-α、IL-6及IFN-β细胞因子的释放,且具有剂量依赖性,说明欧李多糖有一定的免疫调节活性。
