缺氧预处理的肾癌细胞来源外泌体通过ERK5 通路影响细胞增殖与凋亡
2022-05-25付茂辉孙荣凯
付茂辉,于 斌,孙荣凯
(1. 天津市第四中心医院泌尿外科,天津 300000;2. 中国人民解放军联勤保障部第960 医院泌尿外科,山东济南 250031)
肾细胞癌是泌尿外科常见的肿瘤性疾病,具有发病率高,预后差等特点[1]。据流行病学调查发现,肾细胞癌的发病率约占肾脏恶性肿瘤的80%~90%。其中男性多于女性,发达国家高于发展中国家[2-3]。目前针对肾细胞癌的治疗主要集中于手术切除和药物化疗,但是复发率较高,生存率较低[4-5]。对于肾细胞癌的治疗,如何选取合适的治疗方案,是临床上的难点问题。既往研究表明,肿瘤的生物学行为与肿瘤微环境密切相关,而肿瘤的微环境主要以缺氧为主[6-7]。有研究发现缺氧条件可以促进胶质瘤外泌体的释放,进而促进胶质瘤细胞的侵袭[8]。因此,我们对肾细胞癌细胞进行缺氧预处理,观察其对肾细胞癌细胞生物学行为的影响。外泌体(exosome,EXO)是一类双层脂质结构的囊泡结构,可以由细胞分泌,携带大量的遗传物质,包括miRNA、lincRNA 和各类基因等,通过膜融合和胞吞的方式,将遗传信息传递至受体细胞中,从而影响受体细胞的生物学行为[9-10]。有研究表明肿瘤细胞和基底细胞之间可以通过外泌体进行遗传信息的交换[11]。本研究利用CoCl2构建肿瘤细胞的缺氧微环境,提取外泌体,利用逆转录聚合酶链反应(reverse transcriptase-polymerase chain reaction,RT-PCR)和Western blot 检 测ERK5 和 凋 亡相关基因Bcl-2、Bad、Bax 和Caspase-3 的表达,利用CCK-8 试剂盒、Transwell 试剂盒检测细胞的增殖和侵袭能力,从而探讨缺氧微环境处理肾癌细胞来源的外泌体影响细胞增殖和凋亡的相关机制。
1 材料与方法
1. 1 实验细胞与材料本研究使用的肾癌细胞系ACHN 细胞是由中国科学院上海生命科学研究院生物化学与细胞生物学研究所徐云博士惠赠。DMEM培养液购自美国Gibco 公司;Trizol 试剂和荧光定量PCR 试 剂 盒 均 购 自 日 本TaKaRa 公 司;CCK-8 试 剂盒、Transwell 检测试剂盒和AV-PI 检测试剂盒均购自北京碧云天试剂公司。
1. 2 肾细胞癌细胞缺氧模型的构建利用CoCl2 试剂构建肿瘤细胞的缺氧微环境。以肾癌细胞系ACHN 细胞为研究对象,按照处理方法分成2 组,即缺氧组和正常组。根据预实验结果,缺氧组细胞经浓度为100 μmol/L 的CoCl2 试剂进行处理,构建肿瘤细胞的缺氧模型,放置在37 ℃、体积分数为5% 的CO2的细胞培养箱中进行培养24 h。正常组细胞为常规培养,无特殊处理。
1. 3 外泌体的提取采用超速离心法进行收集上述2 组细胞的外泌体。待上述2 组细胞处理24 h 后,弃上清液,用PBS 溶液清洗3 次,更换无FBS 的DMEM培养基,孵育48 h,收集细胞上清液,4 ℃300 r/min,离心10 min,取上清去掉细胞,4 ℃2 000 r/min,离心20 min,取上清去掉细胞碎片,重悬后经0.22 μm 滤器过滤,转移至超速离心管中,4 ℃10 000 r/min,离心70 min,取沉淀。PBS 冲洗后,4 ℃100 000 r/min,离心70 min,重复3 次,—80 ℃冰箱中保存。
1. 4 透射电子显微镜观察外泌体的形态取30 μL外泌体悬液,放置于载样铜网上,室温下静置3 min,加入30 g/L 磷钨酸溶液30 μL ,室温下负染5 min,室温下孵育直至铜网干燥,然后透射电镜观察并拍摄。
1. 5 Western blot 法检测外泌体标志物CD63 分子和CD81 分子的表达将外泌体置于EP 管中,收集各组细胞,冰上预冷10 s,加入RIPA 裂解液后,提取总蛋白,利用BCA 试剂盒确定蛋白浓度。 按照SDS-PAGE 说明书要求配置10%分离胶和5%浓缩胶,根据需要,插入分子梳。取30 μg 蛋白质上样,先使用80 V 电压进行电泳,待条带跑至浓缩胶和分离胶的交接点后,改为120 V 电压。待条带跑至分离胶底部,停止电泳。利用PVDF 膜和滤纸进行转膜,设置转膜电流为200 mA,转膜槽放到冰袋中低温处理。转膜成功后浸入封闭液中,摇床封闭2 h,加入CD63、CD81 分子蛋白,ERK5 和Bcl-2,Bad,Caspase-3 一抗的一抗稀释液(Abcam 公司,克隆号:ab79559;ab271286;ab40809;ab32124;ab32445;ab184787;稀释比例为1:10 000),4 ℃孵育过夜,TBST 溶液清洗3 次,5 min/次,加入稀释好的HRP 二抗溶液(Abcam 公司,1∶2 000),孵育二抗,TBST 缓冲液漂洗3 次,5 min/次,加入Supersignal west femto 试剂盒显影液,分光发光成像分析仪显影并拍照。
1. 6 肾细胞癌细胞摄取及内化外泌体 将收集的外泌体与100 μL 的PBS 溶液重悬后保存。将4 μL 的PKH67 加入0.5 mL 的混悬液中,在室温下孵育10 min。然后加入1 mL 的10%BSA 溶液,利用PBS 溶液清洗3 次,5 min/次。然后利用超速离心法收集PKH67 标记的外泌体以备用。将肾癌细胞系ACHN细胞接种于预先铺有盖玻片的24 孔板中,接种细胞量为3×105个/孔,待爬片细胞融合率>60%时,利用PBS 溶液清洗3 次,5 min/次。然后加入PKH67 标记的外泌体混悬液。放置在37 ℃、体积分数为5%的CO2的细胞培养箱中进行培养,时间为24 h。然后取出利用40 g/L 的多聚甲醛溶液固定30 min,10 μg/mL 的DAPI 染液进行染色,避光孵育15 min。利用PBS 溶液清洗3 次,5 min/次。利用指甲油封片,加入防淬灭剂。利用荧光显微镜进行观察。
1. 7 细胞分裂周期监测采用Rose Chamber 法对细胞周期进行检测。将不同外泌体处理的ACHN 细胞接种于预先铺有盖玻片的24 孔板中,接种细胞量为3×105个/孔,待爬片细胞融合率>40%时,利用PBS 溶液清洗3 次,5 min/次。接着将盖玻片加入到活细胞观察腔(Rose Chamber),然后加入DMEM 培养基。利用尼康Eclipse-Ti 荧光显微镜进行实时拍摄,对细胞分裂的周期进行监测。实验重复3 次,降低实验误差。
1. 8 CCK-8 试剂盒检测细胞的增殖外泌体与肾细胞癌共培养后,接种于96 孔板中,100 μL /孔,在37 ℃培养箱中培养5 h,然后每孔加入100 μL CCK-8试剂,37 ℃培养箱中孵育10 min,酶标仪测定在450 nm 处的吸光度(A 值)。
1. 9 逆转录聚合酶链反应(RT-PCR)检测ERK5 和凋 亡 相 关 基 因Bcl-2、Bad、Bax 和Caspase-3 的 表达外泌体与肾癌细胞共培养后,利用胰蛋白酶收集上述各组细胞,经PBS 溶液清洗3 次,常温离心机1 500 r/min 离心5 min,取沉淀,加入1 mL Trizol 溶剂,提取细胞总RNA,保证RNA 纯度范围为1.8~2.1,然后利用逆转录试剂盒的要求,采用20 μL 反应体系逆转录为cDNA,-80 ℃保存,采用荧光定量PCR 试剂盒的要求,采用FTC-2000 RT-PCR 系统和50 μg 反应体系对样本DNA 进行分析,溶解曲线确定Tm 值为83.7 ℃,统计并记录各组样本的循环阈值(cycle threshold, Ct)值,采用2-△△Ct法对ERK5 和凋亡相关基因Bcl-2、Bad、Caspase-3 的表达进行统计。引物设计由上海生工公司设计并检测合格(表1)。实验重复3 次,降低实验误差。

表1 ERK5 和凋亡相关基因Bcl-2、Bad、Caspase-3 的引物序列
1. 10 Western blot 检测外泌体与肾癌细胞共培养后,收集各组细胞,加入1 mL RIPA 细胞裂解液,各组细胞在冰上裂解30 min,收集入1.5 mL 的离心管中,在预冷4 ℃的离心机中离心,预设:5 000 r/min,5 min 后提取上清,经95 ℃煮沸后,收集蛋白备用。按照说明书制备浓缩胶10 mL,分离胶20 mL。上样后电泳分离,转膜后在4 ℃冰箱避光孵育过夜(>12 h)。经一抗稀释液1∶10 000 稀释后加入样本离子膜。第二天用PBST 稀释液洗膜,重复3 次,加用山羊抗小鼠IgG 二抗经二抗稀释液1∶1 000 稀释后孵育二抗1.5 h,用PBST 稀释液洗膜,重复3 次,而后用DAB 显影液处理样本。Image J 软件可以用来分析蛋白条带。
1. 11 AV-PI 试剂盒检测细胞的凋亡各组细胞处理后,利用EDTA 蛋白酶收集各组细胞,预冷PBS 溶液清洗3 次,5 min/次,300 r/min 离心后取细胞沉淀,加入100 μL buffer 进行重置,然后根据AV-PI 试剂盒说明书的要求加入5 μL Annexin V-FITC 和10 μL PI 染液。避光孵育30 min 后,利用流式细胞仪进行检测。实验重复3 次,降低实验误差。
1. 12 统计学分析应用SPSS 21.0 软件进行统计学分析,计量资料结果用±s表示。如果符合正态分布,正常组和缺氧组的RT-PCR 检测结果,CCK-8 细胞增殖结果和AV-PI 细胞凋亡结果等比较采用配对t检验,P<0.05 为具有统计学差异;不同时间点的t检验调整检验水准为P<0.01 具有统计学差异。
2 结 果
2. 1 缺氧环境和正常氧环境培养下肾癌细胞来源的外泌体的鉴定结果透射电镜显示,外泌体为直径50~150 nm 的双层膜囊泡状结构。Western blot 结果显示,外泌体的分子标志物CD81 和CD63 表达阳性(正常组及缺氧组样本量均为1 个)(图1)。

图1 缺氧环境和正常氧环境培养下肾癌细胞来源的外泌体的鉴定
2. 2 肾癌ACHN 细胞摄取及内化PKH67 标记的外泌体以肾癌ACHN 细胞加入PBS 溶液作为对照,正常组细胞和缺氧环境下提取的外泌体与肾细胞癌ACHN 细胞共培养的过程中,可见ACHN 细胞可以摄取并内化PKH67 标记的外泌体。另外,缺氧组细胞内化的外泌体数量要明显高于正常组。(正常组、对照组、缺氧组样本量均为1 个)(图2)。
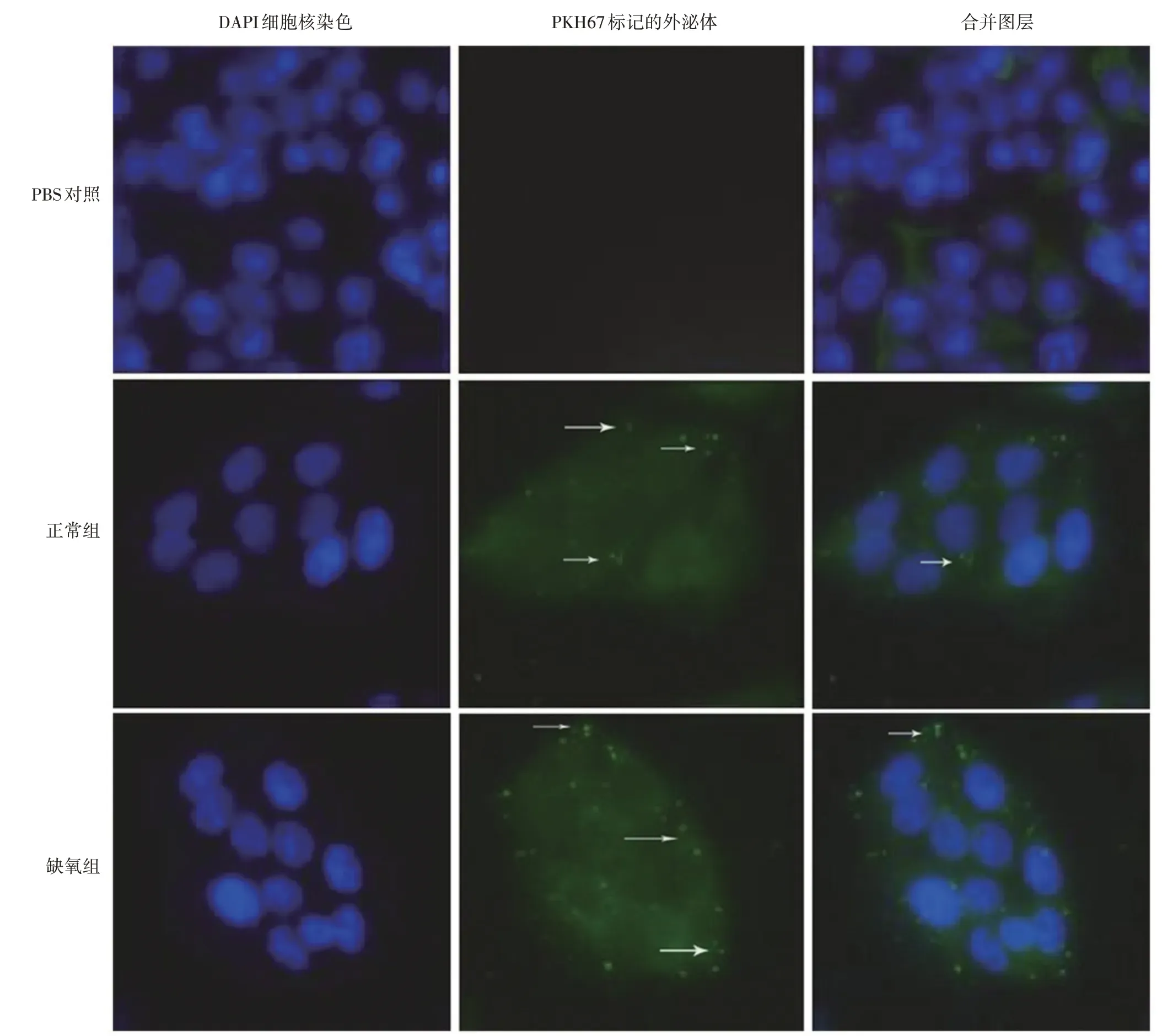
图2 肾癌ACHN 细胞摄取及内化PKH67 标记的外泌体
2. 3 细胞分裂周期监测结果活细胞观察腔(Rose Chamber)技术可以清楚记录活细胞的有丝分裂过程:在0 min 时,细胞处于细胞分裂早期;35 min 时,细胞处于细胞分裂中期;65 min 时,细胞处于细胞分裂末期(图3)。统计细胞有丝分裂的时间后发现,缺氧组外泌体与ACHN 细胞共培养后,有丝分裂的时间被明显缩短(t=7.804,P<0.05,图4),说明缺氧组外泌体可以通过缩短有丝分裂的时间促进肿瘤细胞的增殖(正常组及缺氧组样本量均为1 个)。
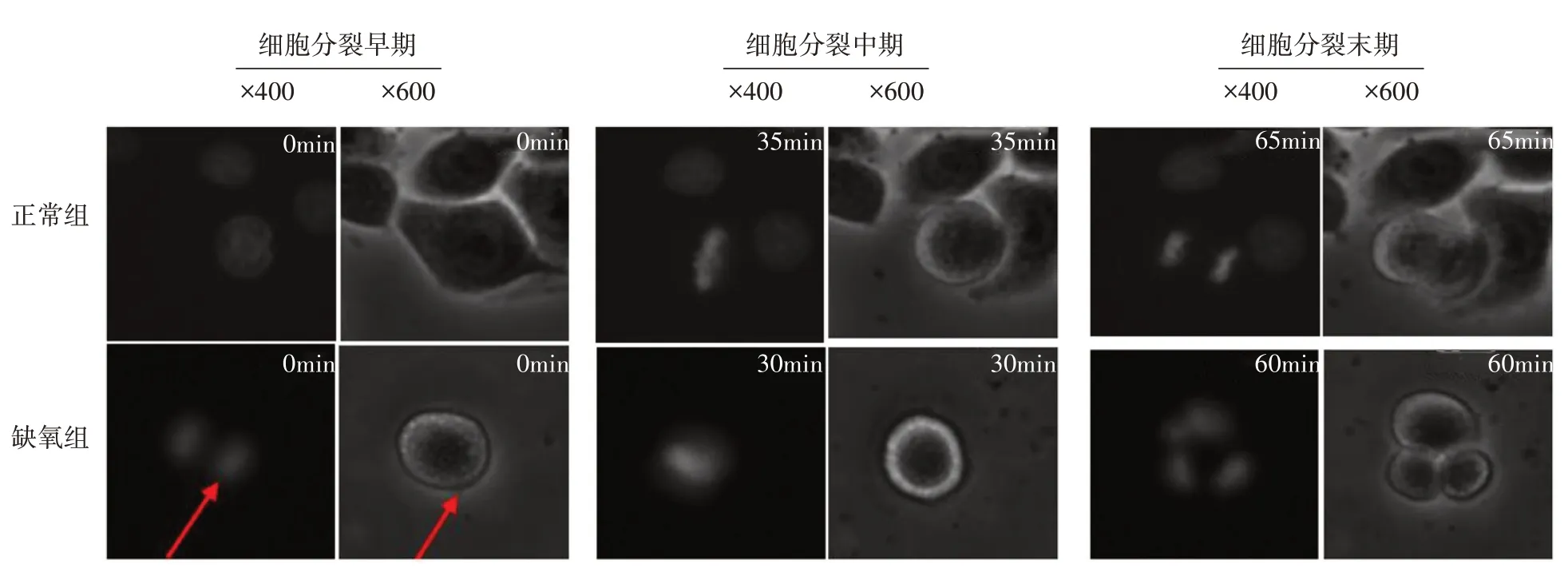
图3 正常组与缺氧组不同时期的细胞有丝分裂过程

图4 正常组与缺氧组有丝分裂的时间*:(P<0.05)
2. 4 肾癌ACHN 细胞与缺氧环境来源外泌体共培养处理下的增殖结果利用CCK-8 试剂盒检测外泌体和肿瘤细胞共培养后对细胞增殖水平的作用(正常组及缺氧组样本量均为3 个),结果显示,处理4 h 后,缺氧组肿瘤细胞的增殖能力要明显高于正常组(表2)。

表2 肾癌ACHN 细胞与缺氧环境来源外泌体共培养处理下的增殖情况
2. 5 RT-PCR 检测ERK5 和凋亡相关基因Bcl-2,Bad,Bax 和Caspase-3 的mRNA 相对表达水平缺氧 组 的ERK5、Caspase-3 和Bad 的mRNA 相 对 表 达水平低于正常组(t=3.829,4.003;P<0.001),而抗凋亡因子Bcl-2 缺氧组要明显高于正常组(t=3.834,P=0.000)(正常组及缺氧组样本量均为3 个)(图5)。

图5 正常组与缺氧组ERK5 和凋亡相关基因Bcl-2、Bad、Bax 和Caspase-3 的mRNA 相对表达水平
2. 6 Western-blot 检测ERK5 和凋亡相关基因Bcl-2,Bad,Bax 和Caspase-3 的蛋白表达水平 结果显示,缺氧组的ERK5,Caspase-3 和Bad 的蛋白表达水平要明显低于正常组(t=3.892,3.008,2.997;P均<0.001),而抗凋亡因子Bcl-2 的蛋白表达量的比较中,缺氧组要明显高于正常组(t=4.839,P<0.001)(正常组及缺氧组样本量均为1 个,图6)。

图6 Western Blot 检测正常组与缺氧组ERK5 和凋亡相关基因Bcl-2、Bad、Bax 和Caspase-3 的蛋白表达水平
2. 7 AV-PI 试剂盒检测细胞凋亡率缺氧组细胞凋亡率明显低于正常组(正常组及缺氧组样本量均为1个),差异具有统计学意义(P<0.05,图7)。

图7 AV-PI 试剂盒检测细胞凋亡率
3 讨 论
肿瘤微环境与肿瘤细胞的生物功能密切相关,类似于“种子与土壤”的关系,肿瘤微环境的变化可以影响肿瘤细胞的增殖、凋亡和侵袭等。随着对肿瘤的进一步研究,肿瘤所处的微环境也逐渐引起学者的关注。肿瘤微环境对肿瘤细胞的影响可以分成细胞成分和非细胞成分[12-13]。GE 等[14]的研究表明,肿瘤微环境的免疫细胞浸润可以影响肾细胞癌细胞的增殖和凋亡。除了免疫细胞外,肿瘤微环境的一些相关分子也会影响肿瘤细胞的生物学行为,比如转化生长因子-β 等[15]。但是,对于非细胞的缺氧环境对肿瘤细胞行为影响的相关研究较少。本研究通过CoCl2试剂构建肿瘤细胞的缺氧微环境,观察缺氧环境中肿瘤细胞分泌的外泌体对肿瘤细胞的影响,我们的研究发现,缺氧环境下,肿瘤细胞分泌的外泌体较多,而且可以通过胞吞的作用被肿瘤细胞内吞,从而进一步影响肿瘤细胞的生物学行为,比如增殖和凋亡等。
外泌体是目前研究的热点问题,细胞与细胞之间、细胞与环境之间的交流可以通过外泌体携带相关的信号分子来实现。有研究表明,外泌体可以在细胞和微环境之间构建一条“桥梁”,可以将微环境中的相关信息通过外泌体传递到细胞内,也可以将细胞内的遗传信号通过外泌体传递到细胞周围微环境中,从而实现细胞与周围微环境的信号交流[16]。本研究结果发现,当肾细胞癌周围微环境处于缺氧环境中,可以促进外泌体的分泌,而且外泌体可以进一步促进肿瘤细胞的增殖,抑制细胞的凋亡。本研究利用活细胞观察腔(Rose Chamber)技术可以清楚记录活细胞的有丝分裂过程,统计细胞有丝分裂的时间后发现,缺氧组外泌体与ACHN 细胞共培养后,有丝分裂的时间被明显缩短,本研究结果说明,缺氧组外泌体可以通过缩短有丝分裂的时间,促进肿瘤细胞的增殖。
B 淋巴细胞瘤-2 基因简称Bcl-2(B-cell lymphoma-2)和B 淋巴细胞瘤-2 基因相关启动子(Bad)是与凋亡密切相关的基因,其中,Bad 是促凋亡因子,而Bcl-2 是抑制凋亡因子,Caspase-3 蛋白有“死亡蛋白”的说法,Caspase-3 的激活可以促进细胞的凋亡[17-18]。本研究通过RT-PCR 和Western blot 结果发现,缺氧环境中的外泌体可以从mRNA 和蛋白两个层面上抑制凋亡相关因子Bad 和Caspase-3 的表达,促进抗凋亡因子Bcl-2 的表达,结果说明,缺氧组外泌体可以抑制细胞的凋亡。本研究还利用AV-PI 试剂盒检测细胞的凋亡率,结果发现,缺氧组外泌体可以抑制细胞的总凋亡率。另外,我们发现,MAPK/ERK5 的表达量在缺氧组外泌体刺激下,其mRNA 相对表达量和蛋白表达量均明显下降。所以,我们推测,外泌体对细胞增殖和凋亡的调控是通过ERK5 信号通路而实现。既往研究表明,ERK5 信号通路可以介导细胞的增殖和凋亡通路,与本研究结果相同。
综上所述,缺氧环境下,肾细胞癌细胞来源外泌体可以通过ERK5 信号通路促进细胞的增殖,抑制细胞的凋亡。
