马尾松次生林转换为湿地松和杉木林对土壤细菌群落结构和多样性的影响
2022-05-24夏开邓鹏飞马锐豪王斐温正宇徐小牛
夏开,邓鹏飞,马锐豪,王斐,温正宇,徐小牛
安徽农业大学林学与园林学院,安徽 合肥 230036
建国以来,随着我国对木材需求的不断增加,大面积的原始森林逐渐被砍伐,经封山育林形成天然次生林(朱教君,2002)。由于部分天然次生林生产力低,被砍伐转换成不同树种的人工林。皖南山区于2009年前后,将马尾松(Pinus massoniana)低效天然次生林(PM)改造为湿地松(P. elliottii)人工林(PE)和杉木(Cunninghamia lanceolata)人工林(CL)。林型转换是驱动土壤环境条件发生改变的主要因素之一(Bruun et al.,2015),土壤微生物群落结构和多样性可能会随着土壤环境条件变化而发生改变(Chen et al.,2016),进而反映森林生态系统的土壤受损情况或恢复潜力(邓娇娇等,2019),对土壤微生物群落结构和多样性进行研究,可为森林土壤生态恢复和可持续经营提供理论基础。
土壤微生物是陆地生态系统地球生物化学循环的重要驱动因素(Liu et al.,2017),其群落特性指标常被作为土壤生态系统生产力的关键生物指标(Bell et al.,2015;韩芳等,2021)。细菌是土壤中最丰富和最多样的微生物类群(Dennis et al.,2013),广泛参与土壤养分循环和能量转换过程(Averill et al.,2016),同时可以通过分泌大量次生代谢产物,反馈影响土壤环境和植物生长(De et al.,2015),在维持土壤生态系统生产力和稳定性方面起着重要作用(Felske et al.,2000)。林型转换是影响土壤细菌组成和多样性的重要因素之一(Nakayama et al.,2019)。林型转换改变了林间微气候、凋落物的组成和分解、植物根系的活动,改变了土壤理化性质和土壤养分状况,从而影响土壤细菌群落结构和多样性。Meng et al.(2019)研究发现:亚热带地区原始森林向混交林转换后,土壤细菌群落和多样性变化不明显,而向杉木和竹林转换提高了土壤细菌多样性,是土壤pH的变化导致了该地区林型转化引起土壤细菌群落的变化。Sun et al.(2020)研究发现热带雨林天然林转换为橡胶树人工林后细菌多样性显著降低,土壤容重和湿度是影响该地区土壤细菌群落的关键因子。不同地区的林型转换对土壤细菌群落影响结果不同,影响土壤细菌群落的关键环境因子也不同。皖南山区PM转化成PE和CL后,对土壤细菌群落结构和多样性产生何种影响以及哪些关键环境因子影响该地区的土壤细菌群落,目前尚不清楚。因此,研究该地区林型转换对土壤细菌群落结构和多样性的影响,有助于揭示其对森林土壤生态系统的影响机制,为该地区林型转换后森林土壤生态系统的恢复和维持提供科学依据,对土壤生态系统的可持续发展具有重要意义。
基于16S rRNA的新一代高通量测序技术采用最新版QIIME 2分析流程,可以极大提升数据精确度与物种分辨率(Benjamin et al.,2016),更加真实地揭示环境中微生物群落结构组成(Mark et al.,2005)。本研究以安徽旌德县国营蔡家桥林场立地条件相同的PM以及由PM转换的PE和CL为对象,分析了林型转换对土壤的理化性质、细菌群落结构和多样性的影响以及关键环境因子对细菌群落结构的影响,以期为该地区森林土壤生态系统恢复和可持续经营提供科学依据。
1 研究地区与研究方法
1.1 研究地区概况
试验地位于皖南山区国营蔡家桥林场,地处118°30′E,30°20′N,气候属亚热带湿润季风气候,光照充足,四季分明,山地气候特征明显。年平均气温为16 ℃,年平均降水量为1521 mm,无霜期230 d左右。基岩以板岩和花岗岩为主,土壤多为红黄壤、山地黄壤。林区植被丰富,森林覆盖率达85%,乔木主要有马尾松、湿地松、杉木、鹅掌楸(Liriodendron chinense)、檫木(Sassafras tzumu)、苦槠(Castanopsis sclerophylla)、甜槠(C.eyrei)、木荷(Schima superba)等。林下植物主要有檵木(Lorpetalum chindensevar.rubrum)、杜鹃(Rhododendron simsii)、白茅(Imperata cylindrica)、蕨类(Pteridophyta)等。
1.2 样地设计和土壤样品采集
2020年8月,在蔡家桥林场选择立地条件类型相同的马尾松次生林(PM)以及马尾松次生林伐后营造的湿地松林(PE)和杉木林(CL)3种林分各设置3个样地,样地面积均为20 m×20 m,共9块样地。调查林分基本情况详见表1。

表1 调查林分样地基本概况Table 1 Basic characteristics of the sampling stands
每个样地内按机械随机法设置3个小样方,样方面积5 m×5 m,土壤样品采集之前,去除地表枯枝落叶,用土钻在小样方内按“S”形多点取样,取样深度为0—10 cm,将所取土壤充分混合成一个土样,每个土样分成2份,一份取500 g左右装入无菌自封袋中,9个样地共计27份土壤样品,用于测定土壤理化性质;同时将另一份土壤,过2 mm筛以除去石头、根系以及土壤动植物后,取10 g左右装入无菌管中,并储存于-80 ℃的干冰保温盒中,共获取 27份土壤微生物样品,用于土壤微生物指标的测定。土壤微生物指标的测定委托杭州联川生物科技有限公司进行16s rRNA高通量测序。
1.3 土壤理化指标的测定
土壤含水率(SWC,%)采用105 ℃烘干法测定;土壤pH按水土比例(2.5∶1)混合后用pH计测定;土壤电导率(EC,μS·cm-1)按水土比例(5∶1)混合后用电导率计测定;土壤有机碳(SOC)和全氮(TN)使用元素分析仪(EA 3000,Vector,Italy)测定;土壤全磷(TP)采用HNO3∶HClO4=3∶1法消煮后,利用连续流动注射分析仪(FIA Star 5000,FOSS,Denmark)测定。土壤速效氮(NH4+-N,NO3--N,mg·kg-1)使用 1 mol·L-1KCl溶液浸提,用流动注射分析仪进行测定。
1.4 土壤细菌16S rRNA测序方法
1.4.1 土壤细菌DNA提取与扩增测序
使用 E.Z.N.A.®Soil DNA Kit试剂盒对土壤细菌 DNA进行提取,并通过琼脂糖凝胶电泳检测DNA提取质量,同时采用紫外分光光度计对DNA进行定量。使用引物 341F(5′-CCTACGGGNGGC WGCAG-3′)和 805R(5′-GACTACHVGGGTATC TAATCC-3′)对16S rDNA可变区(V3—V4)进行PCR扩增。PCR产物采用Quant-iT PicoGreen dsDNA Assay Kit在Qbit荧光定量系统上对文库进行定量,将合格的测序文库梯度稀释后,根据所需测序量按相应比例混合,经 NaOH变性为单链后使用NovaSeq测序仪进行2×250 bp的双端测序。
1.4.2 生物信息数据处理
上机测序完成后,得到原始的下机数据,利用overlap将双端数据进行拼接,并进行质控、嵌合体过滤,获得高质量的cleandata。采用最新版QIIME 2分析流程,调用 DADA2(Divisive Amplicon Denoising Algorithm)(Benjamin et al.,2016)对序列进行去噪,即不再使用以97%相似度聚类成OTU(Operational Taxonomic Units)的分析方法,而是通过“去重复”(Dereplication,相当于以100%相似度聚类)等步骤,进而获得单碱基精度的代表序列,大大提升了数据精确度与物种分辨率,然后使用ASVs(Amplicon Sequence Variants)的概念构建类OTU表,获得最终的Feature特征表以及特征序列。本次测序共获得23497个特征序列,特征序列所对应总Feature数为1021518个,3种林型共识别出39门,783属细菌类群。采用Blast进行序列比对,每个代表性序列用 SILVA(Release 132,https://www.arb-silva.de/documentation/release-132/)以及 NT-16S数据库对特征序列进行注释,最后基于得到的 Feature特征表进行多样性分析、物种分类注释和菌群差异分析等。
1.5 数据处理
本研究分析平台为QIIME 2平台,数据计算及其分析作图在QIIME 2自带脚本R完成。运用Excel 2013对数据进行整理,计算所有参数的平均值和标准差(SD)。使用R(v 3.6.1)统计分析软件对土壤理化性质和细菌α多样性指标分别进行单因素方差分析(ANOVA),并对两者进行 Pearson相关性分析,对土壤理化性质和细菌群落结构进行Mantel检验分析与Pearson相关性分析。
2 结果与分析
2.1 林型转换对土壤理化性质的影响
PM转换成PE和CL后,土壤理化性质发生显著变化(表2)。与PM相比,PE土壤pH和NH4+-N含量显著增加(P<0.05),而土壤EC和NO3--N含量显著降低(P<0.05);CL土壤 SWC显著增加(P<0.05);土壤 EC和 SOC含量均显著降低(P<0.05)。
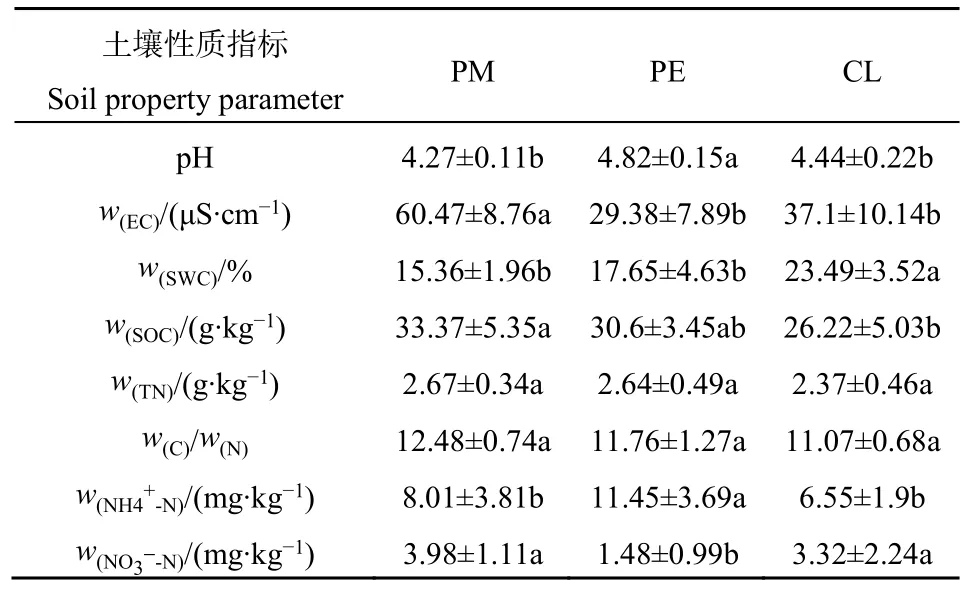
表2 试验林分土壤理化性质Table 2 Soil basic characteristics of the experimental stands
2.2 林型转换对土壤细菌群落多样性的影响
2.2.1 林型转换对土壤细菌α多样性的影响
根据对土壤细菌α多样性指数进行单因素方差分析(表3)可以看出:Chao1指数、Observed_species指数、Shannon指数、Simpson指数的变化趋势均是PE>CL>PM。PM转换成PE后,土壤细菌各α多样性指数均显著增加(P<0.05);而转换成CL后,土壤细菌各α多样性指数无显著变化(P>0.05)。

表3 土壤细菌α多样性指数Table 3 Soil bacterial α-diversity indices
对土壤细菌α多样性指数与土壤理化性质进行Pearson相关分析发现:Chao1指数和Observed_species指数均与土壤 pH呈显著正相关(P<0.05);Shannon指数、Simpson指数与土壤pH呈极显著正相关(P<0.01),Simpson指数与EC呈显著负相关(P<0.05)。
2.2.2 林型转换对土壤细菌β多样性的影响
对土壤细菌群落进行基于 weighted_unifrac的主坐标分析(Principal coordinates analysis,PCoA)和相似性分析(Analysis of similarities,Anosim),结果表明(图 1):PCoA中两个维度分别解释了36.42%和 21.13%,共解释了 57.55%(r=0.4084,P=0.001),代表PM、PE和CL的点可以分别聚在一起,且PE、CL与PM可以明显区分开,3种林型组间差异明显大于组内差异。
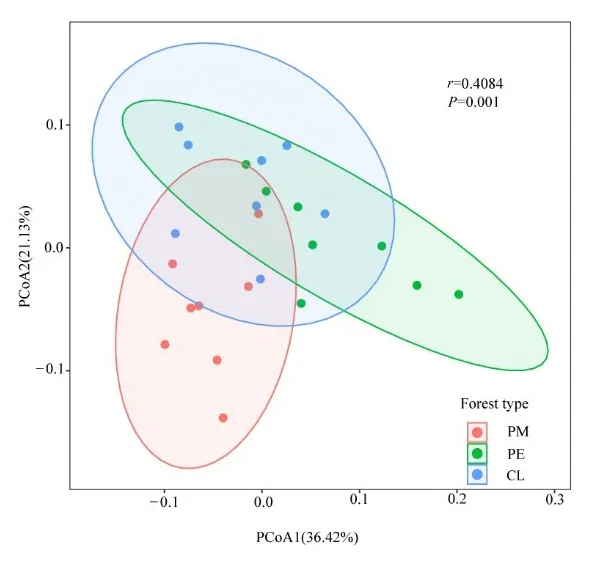
图1 土壤细菌群落基于weighted UniFrac距离的主坐标分析Figure 1 Principal coordinate analysis of soil bacterial community based on weighted UniFrac distance
2.3 林型转换对土壤细菌群落结构的影响
2.3.1 林型转换对土壤细菌群落结构在门水平的影响
在门水平上,PM、PE、CL林分土壤共获得39个细菌门。将平均相对丰度<1%归为其他(Others),得到11个类群(图2)。3种林型土壤细菌主要优势菌群(平均相对丰度>10%)为酸杆菌门(Acidobacteria)(39.31%、36.70%、41.18%),其次是变形菌门(Proteobacteria)(31.77%、30.45%、27.11%)和放线菌门(Actinobacteria)(10.69%、10.73%、7.75%),总体相对平均丰度达到78.56%以上。其他7个优势菌群分别为:绿弯菌门(Chloroflexi)、疣微菌门(Verrucomicrobia)、浮霉菌门(Planctomycetes)、芽单胞菌门(Gemmatimonadetes)、WPS-2,己科河菌门(Rokubacteria)未识别门(Unclassified)和其他(Others)。

图2 门水平上的细菌群落相对平均丰度堆叠柱状图Figure 2 Stack histogram of relative average abundance of bacterial community at phylum level
采用Wilcoxon方法对PE、CL分别和PM进行两两比较检验(表 4)发现:在三大优势菌群中,酸杆菌门相对丰度在PM转换为PE和CL后均未发生显著变化(P>0.05),变形菌门和放线菌门相对丰度在PM转换为CL后显著降低(P<0.05)。其他主要菌群的平均相对丰度在 PM转换为 PE和 CL后也发生了变化,PE与 PM 相比,己科河菌门和WPS-2均有极显著差异(P<0.01);CL与PM相比,绿弯菌门和疣微菌门有极显著差异(P<0.01),己科河菌门和未识别门有显著差异(P<0.05)。

表4 PE、CL分别和PM土壤细菌门水平的Wilcoxon两两比较检验结果Table 4 Statistical results of Wilcoxon pair-to-pair comparison test at soil bacteriophyta levels among PE, CL and PM
2.3.2 林型转换对土壤细菌群落结构在属水平的影响
在属水平上,3种林型共获得783个类群。将PM、PE、CL中平均相对丰度<1%细菌类群归为其他(Others),共有 20个类群(图 3),占比超过37.21%,主要优势菌属(平均相对丰度>5%)有 3个,分别为酸杆菌门 Subgroup_2未定属(Subgroup_2_unclassified)(18.45%、12.66%、14.11%)、酸杆菌目未定属(Acidobacteriales_unclassified)(7.72%、6.69%、7.35%)、变形菌门Elsterales目未定属(Elsterales_unclassified)(8.56%、3.80%、5.51%)。

图3 属水平上的细菌群落相对平均丰度堆叠柱状图Figure 3 Stack histogram of relative average abundance of bacterial community at the genus level
采用Wilcoxon方法对PE、CL分别和PM进行两两比较检验发现:林型转换显著改变土壤细菌在属水平的结构,优势菌群(平均相对丰度>1%)的平均相对丰度在PM转换为PE后有8个属产生了显著差异(表 5),分别为:酸杆菌门的 3个属[Subgroup_6纲未定属(Subgroup_6_unclassified),Candidatus_Solibacter属(Candidatus_Solibacter),Subgroup_2目未定属(Subgroup_2_unclassified)],变形菌门的 2个属[Elsterales目未定属(Elsterales_unclassified),黄色杆菌科未定属(Xanthobacteraceae_unclassified)],放线菌门的Gaiellales科未定属(Gaiellales_unclassified),浮霉菌门的出芽科未定属(Gemmataceae_unclassified)以及疣微菌门的 Candidatus_Udaeobacter属(Candidatus_Udaeobacter)。PM 转换为 CL后有 8个属产生了显著差异(表5),分别为:酸杆菌门的Subgroup_6纲未定属(Subgroup_6_unclassified),放线菌门的热酸菌属(Acidothermus),变形菌门里的 2个属(Elsterales目未定属(Elsterales_unclassified),α-变形杆菌纲未定属(Alphaproteobacteria_unclassified),绿弯菌菌门的2个属(JG30-KF-AS9科未定属(JG30-KF-AS9_unclassified),AD3纲未定属(AD3_unclassified)和疣微菌门的 2个属[Candidatus_Udaeobacter属(Candidatus_Udaeobacter),ADurb.Bin063-1 属(ADurb.Bin063-1) ]。

表5 PE、CL和PM土壤细菌属水平的Wilcoxon两两比较检验结果Table 5 Statistical results of Wilcoxon pair-to-pair comparison test at soil bacterial genera levels among PE, CL and PM
2.4 关键环境因子与细菌群落结构的相关性
对细菌群落结构和土壤理化性质进行 Mantel分析检验(表6)土壤pH对本研究地区土壤细菌群落结构影响最大(r=0.4992,P=0.001),同时 EC(r=0.3347,P=0.002)对细菌群落结构也有极显著影响。
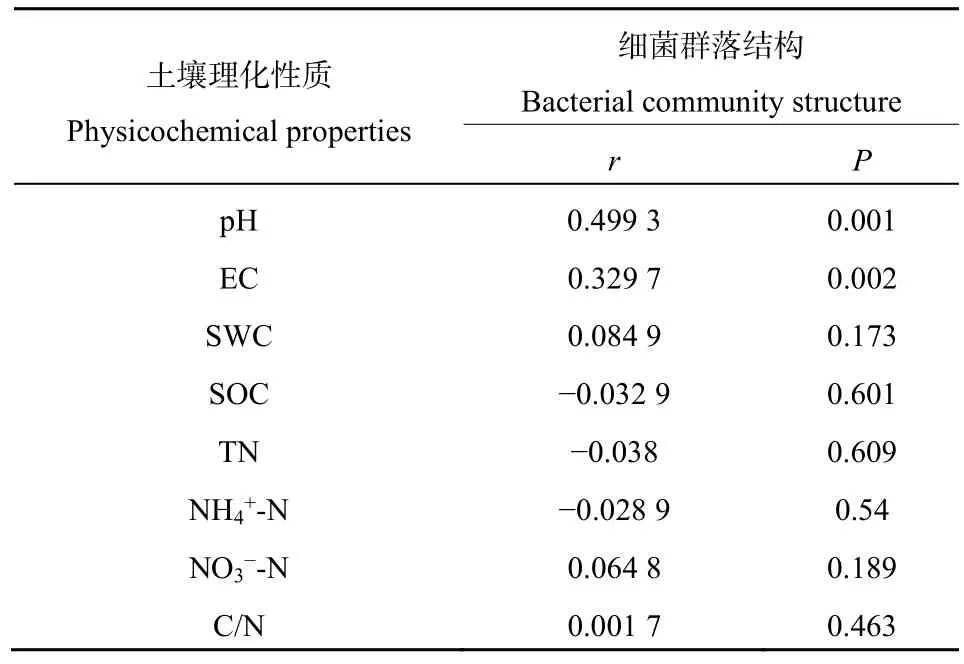
表6 Mantel检验细菌群落结构与土壤环境因子的相关性Table 6 Correlation between bacterial community structure and soil environmental factors tested by Mantel
进一步对门水平的优势菌群与土壤理化性质进行 Pearson相关性分析(图 4),酸杆菌门(P<0.05)、WPS-2(P<0.01)相对丰度与土壤 pH 呈显著负相关,浮霉菌门(P<0.05)、己科河菌门(P<0.01)与土壤pH呈显著正相关;己科河菌门、疣微菌门与土壤EC呈显著负相关(P<0.05),WPS-2与土壤EC呈显著正相关(P<0.01)。除了关键因子对菌群相对丰度影响外,还有其他环境因子也对部分菌群相对丰度产生影响。如:变形菌门(P<0.05)、放线菌门(P<0.05)的相对丰度与SWC呈显著负相关,绿弯菌门与 SWC呈显著正相关(P<0.01);酸杆菌门与TN呈显著负相关,己科河菌门、浮霉菌门与TN呈显著正相关(P<0.05)。酸杆菌门、WPS-2与NO3--N呈显著正相关(P<0.05),浮霉菌门与NO3--N呈显著负相关(P<0.05)。放线菌门与NH4+-N呈显著正相关(P<0.01)。
对属水平有显著差异的优势菌群与土壤理化性质进行 Pearson相关性分析(图 4),酸杆菌门Subgroup_6纲未定属、变形菌门的黄色杆菌科未定属、放线菌门Gaiellales科未定属、浮霉菌门出芽科未定属相对丰度均与土壤 pH呈极显著正相关(P<0.01),酸杆菌门 Subgroup_2纲未定属和Candidatus_Solibacter属(P<0.05)、变形菌门Elsterales目未定属(P<0.01)与土壤pH呈显著负相关。变形菌门Elsterales目未定属与EC呈显著正相关(P<0.05),酸杆菌门 Subgroup_6纲未定属(P<0.01)、变形菌门黄色杆菌科未定属(P<0.01)、放线菌门Gaiellales科未定属(P<0.01)、疣微菌门ADurb.Bin063-1属(P<0.05)、浮霉菌门出芽科未定属(P<0.01)与EC呈显著负相关。此外NO3--N也显著影响了优势菌群相对丰度的差异。变形菌门Elsterales目未定属与NO3--N呈显著正相关,酸杆菌门Subgroup_6纲未定属(P<0.05)、变形菌门黄色杆菌科未定属(P<0.01)、放线菌门Gaiellales科未定属(P<0.01)、疣微菌门Candidatus_Udaeobacter属(P<0.05)、浮霉菌门出芽科未定属(P<0.05)与NO3--N呈显著负相关。
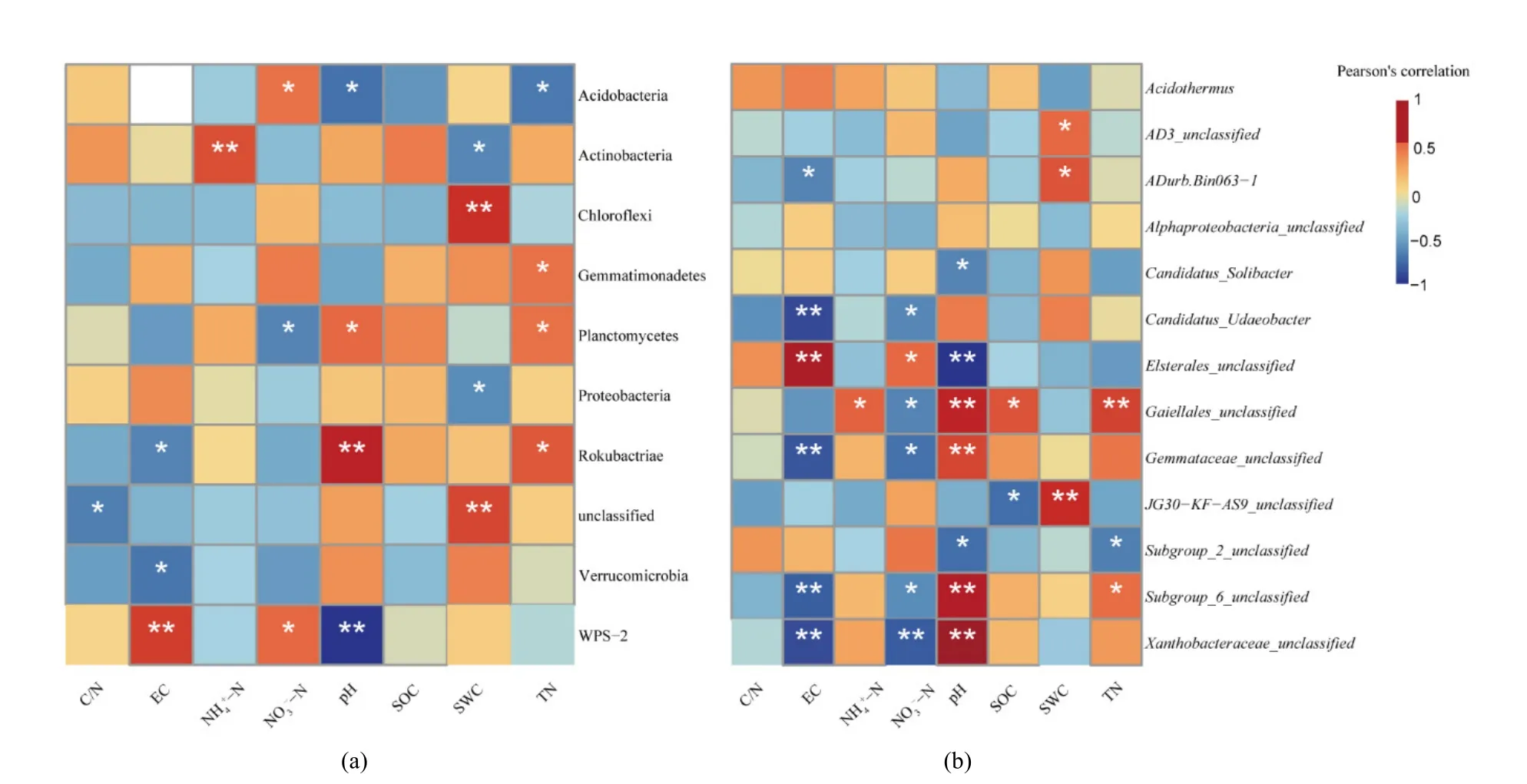
图4 优势门菌群相对丰度(a)、有差异的优势属菌群相对丰度(b)和土壤理化性质相关性热图Figure 4 Heat map of correlation between relative abundance of dominant phylum (a), relative abundance of dominant genera with differences (b) and soil physical and chemical properties
3 讨论
3.1 林型转换对细菌群落多样性的影响
本研究中PM转换成PE后,土壤细菌α多样性显著增加,而PM转换成CL后,未发生显著改变,同时β多样性分析显示,3种林型间的细菌群落差异显著大于各林型内部差异,表明林型转换显著改变了土壤细菌群落的多样性。PM转换成PE和CL后,对土壤细菌群落多样性影响不同,这与Meng et al.(2019)研究结果相一致。他们发现亚热带地区原始森林向混交林转换,土壤细菌多样性变化不大,向杉木和竹林转换提高了土壤细菌多样性。主要原因可能是不同类型的林型转换形成了不同的林分植被结构,影响了林分凋落物组成、分解过程和根系活动,改变了土壤 pH等理化性质(Sun et al.,2020;梁国华等,2015;曾婷婷等,2016),从而影响土壤细菌多样性。研究地区的土壤细菌Chao1指数、Observed_species指数、Shannon指数和 Simpson指数与土壤 pH均呈显著正相关,与Hartman et al.(2008)研究的结果相一致,他们发现在pH小于6.5的酸性土壤中,微生物多样性随着土壤pH的降低而降低。凋落物是森林生态系统的重要组成部分,其分解可以产生多种化合物直接改变土壤pH(万春红等,2015),植物可通过根系活动向土壤中分泌不同的有机酸、糖类和酚类等次生代谢产物改变土壤pH理化性质,对微生物的生长和增殖产生影响(Zhao et al.,2012;Liu et al.,2020;吴林坤等,2014)。低土壤pH值的土壤中,较高的H+浓度会破坏细菌细胞膜的通透性和稳定性(Feng et al.,2014),抑制细菌对土壤养分的利用效率,进而影响土壤细菌多样性(Shen et al.,2013;张坤等,2017)。PM转换成PE后,土壤pH显著增加,提升了土壤细菌对土壤养分的利用效率,从而导致土壤细菌多样性显著增加。
3.2 林型转换对细菌群落结构的影响
林型转化显著改变了土壤细菌群落结构。PM转换成PE后,己科河菌门、WPS-2和8个优势属相对丰度发生显著变化;转换成CL后,变形菌门、放线菌门、绿弯菌门、疣微菌门、己科河菌门和 8个优势属的相对丰度发生显著变化。林型转换改变了林间微气候影响了土壤含水率;森林通过凋落物的归还与分解实现土壤养分循环,其组成和分解速率在很大程度上影响土壤养分积累(邓娇娇等,2019);不同林型的凋落物与根系分泌物组成不同,这些综合因素导致了土壤理化性质和土壤养分含量的差异(Sun et al.,2020)。经Pearson相关性分析可知,研究区域优势菌群的相对丰度与土壤pH、EC、SWC、SOC、TN、C/N、NO3--N、NH4+-N之间存在着一定的相关性。不同的研究也证实了土壤pH、EC、SWC和土壤养分指标是影响土壤微生物群落的重要因素(Zhang et al.,2014;Liu et al.,2020;Sheremet et al.,2020),这说明林型转换是通过改变了土壤理化性质和土壤营养状况,影响了土壤细菌的群落结构。
研究地区属酸性土壤,不同研究表明酸杆菌门、变形菌门和放线菌门偏好土壤pH较低的土壤(Lauber et al.,2009;Sun et al.,2014)。3 种林型土壤优势菌群均为酸杆菌门、变形菌门和放线菌门,与邓娇娇等(2019)对辽东山区人工针叶林的土壤细菌群落研究结果一致。由于不同细菌的生活方式不同,可以被用作衡量土壤营养状况的指标(Hartman et al.,2008)。酸杆菌门大多属于贫营养型类群(Li et al.,2016),变形菌门和放线菌门属于富营养型类群,主要参与有机质分解(Fazi et al.,2005)。PM转换为PE后,三大优势菌门的相对丰度未发生显著变化,而转换为CL后,变形菌门和放线菌门相对丰度显著降低。有研究表明变形菌门的相对丰度与土壤碳含量呈正相关关系(Fierer et al.,2007),其丰度随着有机质的增加而增加(Navarrete et al.,2008),放线菌门的相对丰度与NH4+-N含量呈显著正相关(黄庆阳等,2021)。转换后的CL中几乎无林下植被,凋落物少,杉木凋落物的枝和叶常常连在一起,很难与土壤充分接触,分解缓慢,导致土壤养分含量下降严重(何斌等,2002),CL的土壤SOC和NO3--N含量显著下降,NH4+-N含量在3种林分中最低,从而导致富营养性菌的相对丰度显著降低,表明转换成CL后林分土壤营养状况下降,不利于森林土壤系统的可持续发展。另外,WPS-2的相对丰度在贫瘠土壤中较高(Sheremet et al.,2020),绿弯菌门主要以CO2为碳源产生能量,能在 SOC含量较低的土壤中具有竞争能力(王鹏等,2017),转换后的CL中WPS-2和绿弯菌门相对丰度均显著增加,也证明了CL林分土壤营养状况的下降。
3.3 关键环境因子对细菌群落的影响
PM转换成PE后,土壤pH显著增加,EC显著降低,转换成CL后,EC显著降低。通过对土壤细菌群落结构和环境因子的Mantel分析检验得出,土壤pH是影响皖南山区3种林型土壤细菌群落的最重要驱动因子,土壤EC是影响该地区土壤细菌群落的另一个重要环境因子。赵凤艳等(2019)研究发现土壤pH和EC是影响土壤微生物结构和多样性的重要因子。全球尺度上,土壤pH被认为是影响土壤细菌群落结构和多样性的关键因子(Bárcenas-Moreno et al.,2016;张红霞等,2019;刘海洋等,2021)。土壤细菌能够在一定pH范围内生存,且存在最适pH,过高或过低的pH会破坏细菌细胞膜的通透性和稳定性(Feng et al.,2014),从而抑制细菌的生长和增殖(Zhou et al.,2020)。土壤环境中的pH变化会改变土壤营养物质分子的电离状态,降低其被土壤细菌利用的有效性(潭洪治,1988)。土壤pH还会通过影响细菌群落之间以及与其他微生物之间的竞争与共生关系,从而影响细菌群落结构和多样性(Shen et al.,2013)。本研究中优势菌群有酸杆菌门等4个门与土壤pH显著相关;在属水平上,有酸杆菌门Subgroup_2纲未定属等7个有差异的优势菌群与土壤pH显著相关;土壤细菌α多样性指数与土壤pH均呈显著正相关。土壤EC这一指标包含了反映土壤品质和物理性质的多项信息,如:土壤含水、盐分、质地结构和有机质含量等(Rhoades et al.,1990)。本研究中,在门水平上,有疣微菌门等3个优势菌群与EC显著相关;在属水平上,有变形菌门Elsterales目未定属等6个有差异的优势菌群与EC显著相关;Simpson多样性指数与EC呈显著负相关。不同研究表明:SWC、SOC、TN、C/N、NO3--N、NH4+-N是影响不同地区土壤细菌群落的关键环境因子(Zhang et al.,2016;李明等,2020;于少鹏等,2020;姜雪薇等,2021),Pearson相关分析结果显示这些土壤理化指标都与本研究地不同的细菌群落有着显著相关性,但并不是影响该地区土壤细菌群落的关键环境因子。主要原因可能是这些土壤环境因子共同作用,综合影响了该地区土壤细菌群落,而土壤EC是这些理化性质的综合反映,成为影响该地区土壤细菌群落的重要环境因子。
4 结论
林型转换是影响土壤细菌群落结构和多样性的重要因素,土壤pH和EC是影响该地区土壤细菌群落结构和多样性的关键环境因子。马尾松次生林转换成湿地松人工林后,土壤细菌多样性显著增加,细菌群落结构变化不明显;而转换成杉木林后土壤细菌多样性无显著变化,富营养型菌的相对丰度显著降低。综上所述,马尾松次生林转换为湿地松人工林比转换为杉木人公林有利于土壤细菌群落发育和土壤营养状况的维持,有利于森林土壤生态系统的可持续发展。另外,由于乔木根系较深,对深层土壤微生物活性也有一定的影响,如果做土壤剖面进行取样,将会得到更为全面的结果。
