肿瘤出芽预测ⅠA2-ⅠB1期宫颈鳞状细胞癌淋巴结转移的意义
2022-05-24卢善明罗文娟刘堃薛祥兴谢玉珍
卢善明 罗文娟 刘堃 薛祥兴 谢玉珍
梅州市人民医院病理科(广东梅州 514031)
盆腔淋巴结清扫是早期宫颈癌(ⅠA1 期除外)的标准治疗。可是,ⅠA2、ⅠB1 期宫颈癌淋巴结转移率只有0% ~4.8%和13.7% ~13.9%[1-2]。因此,相当多早期宫颈癌患者承受了不必要的盆腔淋巴结清扫。早期宫颈癌具有较高的前哨淋巴结检出率、敏感度和阴性预测值[3-4]。对拟行保留生育手术的患者,手术中可以联合应用前哨淋巴结活检术(SLNB)。虽然NCCN 和FIGO 都推荐早期宫颈癌使用前哨淋巴结活检术,但前哨淋巴结活检术存在一定的操作难度,临床并未广泛开展。
肿瘤出芽(tumor budding,TB)是指肿瘤浸润前分散在间质的单个瘤细胞或小于等于4 个细胞的瘤细胞簇[5]。肿瘤出芽是pT1 期结直肠癌淋巴结转移的独立预测因素,已作为结直肠恶性息肉是否需要追加手术的指标。ⅠA2-ⅠB1 期宫颈鳞癌淋巴结转移率低,而且大部分患者适合保留生育功能,探讨肿瘤出芽能否作为ⅠA2-ⅠB1 期宫颈鳞癌淋巴结转移的预测因素具有临床应用意义。目前有少量文献报道了肿瘤出芽与宫颈癌淋巴结转移和预后的相关性,而关于其在早期宫颈鳞癌方面的研究有限。本研究收集行盆腔淋巴结清扫术的FIGO(2009)IA2-IB1 期宫颈鳞状细胞癌患者的资料,分析肿瘤出芽预测淋巴结转移的价值,以期为早期宫颈鳞癌的个体化治疗提供依据。
1 资料与方法
1.1 一般资料 收集108 例FIGO(2009)ⅠA2-ⅠB1 期行宫颈癌根治术的宫颈鳞状细胞癌临床病理资料,所有患者术前未行新辅助放疗或化疗,无其他恶性肿瘤病史。排除标准为炎症细胞浸润明显致无法准确计数瘤芽的病例。
1.2 肿瘤出芽评估方法 调取病理存档蜡块及切片,复阅病理切片,筛选出肿瘤出芽最丰富的切片用于分析。肿瘤出芽评估方法参照国际肿瘤出芽共识大会(ITBCC)2016 的建议[5],并稍作计数面积调整。在10 倍目镜下观察肿瘤浸润前沿区筛选出瘤芽热点,在20 倍目镜下(视野为0.95 mm2)计数单个视野最高瘤芽数量。分别由两位有经验的病理医师进行计数,分级不一致的病例共同镜下讨论决定。肿瘤出芽分级:0 ~4 个为低级别肿瘤出芽,≥5 个为高级别肿瘤出芽。
1.3 免疫组化 肿瘤出芽最丰富的蜡块行4 μm切片2 张,1 张用于HE 染色,1 张用于免疫组化Pan-CK 染色。免疫组化采用EnVision 二步法。抗体Pan-CK 购自福州迈新生物技术开发有限公司。
1.4 统计学方法 统计软件为SPSS 22.0,肿瘤出芽与临床病理参数的相关性采用χ2检验,淋巴结转移危险因素的分析采用logsitic 多因素回归。P<0.05 为差异有统计学意义。
2 结果
2.1 临床病理特征 108例ⅠA2-ⅠB1期宫颈鳞癌中,患者中位年龄48 岁(28 ~74),高中分化92 例(85%),低分化16例(15%)。肿瘤浸润宫颈浅肌层33例(31%),中肌层12例(11%),深肌层63例(58%)。出现淋巴结转移53例(49%),脉管癌栓65例(60%)。
2.2 肿瘤出芽与临床病理特点的相关性 采用HE 染色方法评估肿瘤出芽,肿瘤出芽中位数为4(0 ~20)个,低级别肿瘤出芽56 例(52%),高级别肿瘤出芽52 例(48%),见图1。肿瘤出芽与患者年龄(P= 0.568)、肿瘤浸润深度(P= 0.515)、脉管癌栓(P= 0.287)均差异无统计学意义(表1)。肿瘤出芽与肿瘤分化显著性相关(P= 0.004),低分化组比高中分化组更易出现高级别瘤芽(13∕16vs.39∕92)。高级别瘤芽组趋向比低级别组更易发生淋巴结转移(30∕52vs.23∕56),但两组差异无统计学意义(P=0.084,表1)。
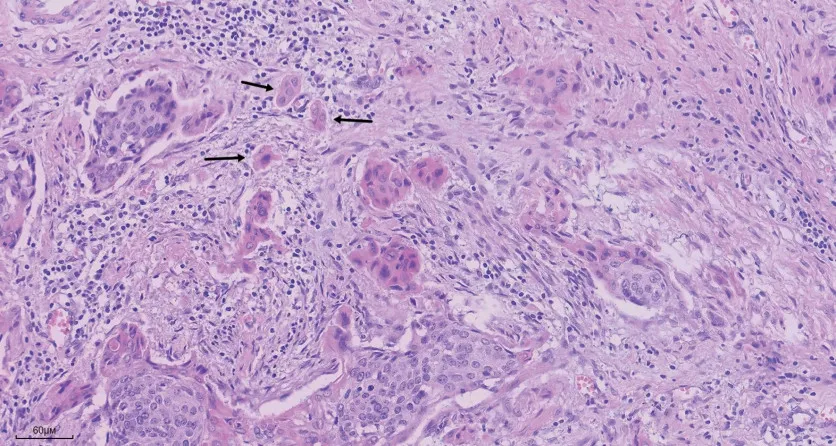
图1 HE 染色观察早期宫颈鳞状细胞癌肿瘤出芽(×200)Fig.1 HE staining to observe TB in the early-stage cervical CSCC(×200)

表1 肿瘤出芽与宫颈鳞癌临床病理特点的相关性Tab.1 Correlation between TB and clinicopathological features of CSCC
2.3 临床病理特点与淋巴结转移的相关性 高、低龄组患者淋巴结转移率为38%(20∕53)和60%(33∕55),低龄组患者更易出现淋巴结转移(P= 0.021)。高中分化组淋巴结转移率为43%(40∕92),低分化组为81%(13∕16),两组差异具有统计学意义(P= 0.005)。肿瘤浸润深度与淋巴结转移显著性相关(P <0.001),浸润深肌层组淋巴结转移率为65%(41∕63),浸润浅中肌层为27%(12∕45)。脉管癌栓组和无癌栓组淋巴结转移率为62%(40∕65)和30%(13∕43),脉管癌栓组淋巴结转移率明显升高(P= 0.001)(表2)。多因素分析显示患者年龄(HR 3.470,95%CI:1.402 ~8.586)、肿瘤 分化(HR:5.090,95%CI:1.181 ~21.936)、肿瘤浸润深度(HR:5.489,95%CI:2.190 ~13.759)是淋巴结转移的独立预测因素(表2)。

表2 淋巴结转移与宫颈鳞癌临床病理特点的相关性Tab.2 Correlation between lymph node metastasis and clinicopathological features of CSCC
2.4 HE 与免疫组化染色对肿瘤出芽评估的一致性比较 为评估免疫组化Pan-CK 染色和HE 染色评估肿瘤出芽分级的一致性,33例标本平行进行了免疫组化Pan-CK 染色(图2)。HE 染色和免疫组化Pan-CK染色肿瘤出芽分级显著相关(P <0.001),有6 例分级不一致,一致率为81.8%(Kappa=0.629),见表3。

图2 免疫组化Pan-CK 染色观察早期宫颈鳞状细胞癌肿瘤出芽(×100)Fig.2 Pan-CK immunostaining to observe TB in the earlystage CSCC(×100)

表3 免疫组化Pan-CK 染色和HE 染色评估肿瘤出芽的一致性Tab.3 Agreement of bud counts assessed using HE and Pan-CK immunostaining
3 讨论
近年来,宫颈癌发病年龄趋向年轻化。随着宫颈癌筛查的普及,越来越多的宫颈癌能早期诊断。许多早期宫颈癌患者是育龄期患者,有保留生育功能的需求。大部分ⅠA2-ⅠB1 期宫颈鳞癌符合保留生育功能指征,其淋巴结转移率较低,评估淋巴结转移风险对避免不必要的系统性盆腔淋巴结清扫术非常必要,尤其对有保留生育需求患者手术方式的选择具有重要临床意义。寻找预测早期宫颈癌淋巴结转移的方法或标志物一直是临床关注的问题[6-8]。
肿瘤出芽与瘤细胞间粘附性丧失和瘤细胞的迁移有关,是肿瘤细胞呈上皮-间质转化(EMT)的组织形态学表现。越来越多研究显示肿瘤出芽与肠癌、口腔鳞癌、乳腺癌、食管癌、肺癌、胃癌、胰腺癌、宫颈癌等多种肿瘤淋巴结转移和预后相关[9-12]。肿瘤出芽的细胞常保留上皮的形态特点,细胞呈圆形、卵圆形或多角形,胞质较丰富、红染。研究显示在多种肿瘤不同观察者间计数肿瘤出芽具有较高的可重复性。与大肠腺癌相比,宫颈鳞状细胞癌肿瘤出芽的准确评估具有一定的难度,影响因素主要有:(1)发生间质转化的瘤芽细胞则较难与间质内的纤维母细胞鉴别;(2)宫颈癌组织因伴有HPV 感染等原因,间质内常伴较多炎症细胞浸润,干扰了瘤芽的识别;(3)肿瘤细胞巢坏死导致肿瘤细胞的脱落可误判为瘤芽。本研究探讨了HE 染色和免疫组化Pan-CK 染色评估肿瘤出芽分级的一致性。HE 染色和免疫组化Pan-CK染色评估瘤芽分级的一致性为81.8%,这与本课题组在另一组宫颈鳞癌样品中的研究结果较相似[13]。宫颈鳞癌常伴明显炎症细胞浸润,免疫组化Pan-CK 染色有助于肿瘤细胞的识别,尤其是单个瘤芽细胞。虽然免疫组化Pan-CK 染色后瘤芽计数更为容易,提高了观察间的可重复性,但是脱离癌巢的凋亡、坏死的肿瘤细胞及碎片也呈Pan-CK染色阳性,可误判为瘤芽。
关于肿瘤出芽在宫颈癌淋巴结转移和预后方面的研究,可见少量文献报道[14-19]。由于数据有限,未能就宫颈癌的高瘤芽阈值达成共识。本研究参照国际肿瘤出芽共识大会(ITBCC)2016 的建议[5],把1 个20 倍物镜视野内(0.95 mm2)瘤芽≥5个作为高瘤芽标准。显示高瘤芽组趋向比低级别组更易发生盆腔淋巴结转移,但两组差异未达统计学意义(P= 0.084)。HUANG 等[15]采用与本研究一致的高瘤芽阈值,行免疫组化Pan-CK 染色后再行肿瘤出芽计数。对634 例IA2-IIA 期宫颈癌研究显示,高瘤芽宫颈癌复发风险增加并与盆腔淋巴结转移密切相关,高瘤组无疾病生存率下降。CHONG 等[16]把瘤芽≥3∕HPF(20 ×)作为高瘤芽阈值,宫颈癌肿瘤浸润前沿的瘤芽与淋巴结转移不相关,但是宫颈癌复发的独立预测因素。研究结果的不一致,可能与瘤芽评估方法和病例的临床分期不一致有关。
宫颈癌不同区域的肿瘤出芽活性具有异质性,增加观察范围可能更能客观评估肿瘤出芽活性。JESINGHAUS 等[17]把瘤芽≥15∕10HPF(40 ×)作为高肿瘤出芽阈值,分析了247 例宫颈癌肿瘤出芽的临床病理意义,发现在测试队列高瘤芽与淋巴结转移不相关,而在验证队列两者显著性相关。ZARE 等[18]和SHI 等[19]分别在94 例宫颈鳞癌和398 例宫颈管腺癌中再次验证了JESINGHAUS等[17]的研究结果,显示高瘤芽肿瘤更易出现淋巴结转移。SATABONGKOCH 等[20]也采用一样的高瘤芽阈值研究了129 例IB-IIA 期早期宫颈腺癌的肿瘤出芽情况,发现高瘤芽与淋巴结转移密切相关。虽然计数10HPF 瘤芽数量可能会增加病理医生的工作量,但这些研究显示把瘤芽≥15∕10HPF(40×)作为高肿瘤出芽阈值得出的研究结果较为一致。该瘤芽评估方法在预测ⅠA2-ⅠB1 期宫颈鳞癌淋巴结转移的价值需要进一步探讨。
淋巴结转移是影响早期宫颈癌不良预后的最重要因素之一。本研究单因素分析显示传统不良病理因素如患者年龄、肿瘤分化、脉管癌栓、浸润深度与淋巴结转移显著性相关。多因素分析显示只有患者年龄、肿瘤分化和肿瘤浸润深度是淋巴结转移的独立预测因素。CHONG 等[16]报道脉管癌栓、肿瘤浸润深度与宫颈癌淋巴结转移相关。FERRANDINA 等[21]探讨了463 例ⅠA2-ⅠB1∕ⅡA1宫颈癌淋巴结转移风险因素,单因数和多因数分析均显示肿瘤大小、分化和脉管癌栓均与淋巴结转移显著性相关。因此,在宫颈锥切标本评估传统不良病理因素如肿瘤分化、浸润深度和脉管癌栓等有助于评估淋巴结转移风险。
本研究不足之处是不少病例炎症细胞浸润明显,瘤芽准确计数有一定困难,其次本研究是回顾性研究。需要扩大研究队列和优化瘤芽评估方法来进一步验证肿瘤出芽在预测ⅠA2-ⅠB1 期宫颈鳞癌淋巴结转移的作用,结合传统病理参数如组织学分级、脉管癌栓、浸润深度等探讨淋巴结转移预测模型。关于肿瘤出芽的评估方法、高瘤芽阈值的确定、能否作为淋巴结转移和预后的独立预测因素、是否应体现在病理报告等问题仍有待更多的研究。
