四逆散对应激性抑郁大鼠血清IL-1β及海马组织5-HT 水平的影响*
2022-05-24姚春栉覃燕琼颜凡棋张青萍
姚春栉,覃燕琼,颜凡棋,赖 燕,张青萍
1广西中医药大学,广西 南宁 530001;2 广西中医药大学第一附属医院
抑郁症是目前临床常见的精神障碍性疾病,主要表现为情绪低下、对生活没有兴趣、悲观自责等,严重者甚至会出现结束生命的行为。近年来,抑郁症的患病率日渐上升[1]。抑郁症已经严重危害着人类的生命健康,但其发病机制不明确,目前仍是医学界关注的热点。而针对神经递质紊乱、炎症、海马神经元损伤等学说,对抑郁症进行干预的西药类药物多具有起效缓慢、治愈率低、性功能障碍、心脏肝肾毒性等不良反应[2],因此,对抗抑郁药物的研究止步不前[3],从天然中药中开发成为一个热门方向[4]。大量研究表明,抑郁症发生与下丘脑-垂体-肾上腺(The hypothalamic-pituitaryadrenal axis,HPA)轴失调密切相关,HPA 轴能够调控释放促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)。而神经递质5-羟色胺(5-hydroxy tryptamine,5-HT)则在HPA轴扮演着重要角色,它可以兴奋性调节CRH的释放[5-6],故5-HT在情绪和精神调节方面具有重要作用。抑郁症的另一病理机制为炎症造成的神经受损[7],白细胞介素1β(interleukin-1β,IL-1β)等炎症因子的释放可以发挥神经保护作用[8],抑制神经炎症反应,有明显的促神经发生作用,抗炎可能作为治疗抑郁症的一种新途径。
四逆散出自《伤寒论》,由柴胡、枳实、白芍、甘草等药物组成,具有透邪解郁,疏肝理脾的功效,是疏肝理脾的古方。目前四逆散、四逆散加味方及其类方仍在临床广泛使用,有着明显的抗抑郁效果。抑郁症属于中医“郁证”范围,中医认为本病因情而郁,乃至气血失调,病于肝,及于心脾,治法理应以疏肝解郁为关键。基于中医疏肝健脾理论治疗抑郁症的证候研究成为从肝论治情志疾病研究的核心内容[9],因此本研究从中医理论出发,观察四逆散对应激性抑郁大鼠行为学变化、血清IL-1β及海马组织中5-HT 含量的影响,进一步探讨四逆散治疗抑郁症的作用机制。
1 材料与方法
1.1 实验动物雄性清洁型SD 大鼠50 只,体质量200~250 g,购于广西医科大学实验中心,实验动物合格证号:SCXK(桂)2019-0002。饲养条件:实验场所位于广西中医药大学科学实验中心,所有动物均于SPF 条件下饲养,温度恒定于25~27℃,相对湿度维持在45%~55%,保证空气流动正常,饲料为标准固体混合无菌饲料,饮水为高压灭菌蒸馏水,所有动物均可自由摄食饮水。
1.2 药品与试剂四逆散,药物组成:柴胡10 g,甘草6 g,枳实15 g,芍药10 g。药材均购于广西中医药大学第一附属医院,按一定比例用开水兑换成每毫升含4.25 g四逆散的溶液。盐酸氟西汀分散片(礼来苏州制药有限公司,国药准号H20130512,规格:20 mg/片),生理盐水配成浓度为0.2 g/L 的溶液。ELISA 检测大鼠5-羟色胺酶联免疫分析试剂盒(购于广西南宁市晶厚生物试剂经营部,批号:CSB-E08364r)测定大鼠海马中单胺类神经递质5-HT的含量,大鼠IL-1β试剂盒(广西南宁市晶厚生物试剂经营部,批号:20180725)测定大鼠血清IL-1β含量。
1.3 实验仪器Ultmit 3000 型高效液相色谱仪(美国Thermo 公司),TSQ ALtis 型三重四极杆串联质谱仪(美国Thermo公司),1-1SPK型高速冷冻离心机(美国Sartorius 公司);Tissuelyser-48型组织匀浆器(上海净信科技有限公司)、BHC-1300ⅡB2生物安全柜[(苏洁医疗器械(苏州)有限公司)]、ProBlot 12 杂交箱(美国Labnet)、HQ-34CCS型纯水仪(河北华清环境科技)、超低温冷冻储存箱(中科美菱低温科技有限责任公司)、制冰机、UV-690 型紫外分光光度计(上海美谱达有限公司);DNP-9022 型电热恒温培养箱(上海精其)、PowerPac型电泳仪[伯乐生命医学产品(上海)有限公司];自制敞箱(底面由面积40 cm×40 cm 的25块正方形组成,高40 cm,内壁和底面为黑色)。
1.4 实验方法
1.4.1 造模方法 参考于林等[10-13]的造模方法并加以改进,包括断食24 h;禁水24 h;困于空瓶中1 h;整夜照明;夹尾5 min;50℃热水刺激10 min;强迫在冰水游泳30 min;束缚3 h;点击足底10 次等。每日随机安排1 种应激方式,每种刺激被采用次数不超过4 次,并且同一种刺激方式不得连续使用。实验持续28天,第28天的应激处理为禁水24 h。造模成功表现:大鼠出现不同程度的眼睑下垂、饮食及活动减少,体质量下降、弓背紧张、大便稀烂等情况。
1.4.2 分组及给药 雄性清洁型SD 大鼠50 只,正常喂养7 天使大鼠适应环境后按随机数字表法分成空白组,模型组,四逆散组高、低剂量组,氟西汀组,每组10只,每笼5只饲养。空白组正常喂养,其余组适应环境后均采用孤养结合慢性应激的方法进行抑郁模型造模,接受28 天不同应激。造模同时各组开始给药,四逆散高、低剂量组分别给予四逆散12.8、3.5 g/kg灌胃,氟西汀组予1.8 mg/kg盐酸氟西汀分散片溶液灌胃。空白组及模型组予以同体积的生理盐水灌胃,即每天20 mL/kg。各组连续给药28天。
1.5 观察指标
1.5.1 体质量 记录各组大鼠的体质量,比较各组体质量变化的差异。
1.5.2 旷场实验 观察各只大鼠的敞箱行为。底面由面积为40 cm×40 cm的25块正方形组成,高40 cm,内壁和底面为黑色。将大鼠放在敞箱中央格,记录3 min 内大鼠穿越方格数,穿越每个格子为1分(至少三爪进入1格即为穿越),直立次数得分(双前肢抬起次数),每次抬起距离地面1 cm 以上记1分,最后进行统计。
1.5.3 糖水消耗实验 大鼠对糖水的喜好程度能反应大鼠内源性快感缺失情况。实验前大鼠予糖水适应,于实验第0、14、28 天进行糖水消耗实验,在进行糖水实验前24 h,对各组大鼠禁水禁食,将大鼠的饮用水更换成1 瓶1%浓度的蔗糖水和1 瓶自来水,每瓶150 mL,做好称量计算,1 h 后撤回2 瓶水并记录所有瓶的剩余数值,做差值计算出糖水消耗量,计算总液体消耗、糖水消耗、糖水偏爱(糖水消耗/总液体消耗×100%),进行统计学处理。
1.5.4 IL-1β水平 实验结束后,大鼠腹腔内注射10%水合氯醛(0.35 mL/100 g)麻醉后取腹主动脉血,取上层血清并保存于-80℃冰箱保存,室温下充分解冻后,根据ELISA 检测试剂盒步骤检测大鼠血清IL-1β的浓度。
1.5.5 5-HT 水平 采血后将大鼠断头处死,快速剥离脑海马,4℃生理盐水清洗并用滤纸吸干水分,迅速放置液氮冷冻保存。大鼠海马组织以10%匀浆,10 mg与100 mL生理盐水匀浆,严格按照ELISA 试剂说明书操作,测定海马组织中单胺类神经递质5-HT的含量。
1.6 统计学方法所有数据采用SPSS 24.0 软件,计量资料以±s表示,组间样本均数比较采用单因素方差分析;方差齐时采用Post Hot 方法检验,方差不齐时用Tamhane's T2 方法检验,P<0.05表示差异有统计学意义。
2 结果
2.1 体质量给药14、28 天后,与空白组比较,其余各组大鼠体质量增长缓慢(P<0.5);与模型组比较,氟西汀组、四逆散高剂量组体质量显著增加(P<0.5)。给药28天后,与氟西汀组比较,四逆散高剂量组体质量增加明显(P<0.5)。见表1。
表1 各组大鼠不同时间点体质量比较(±s) g
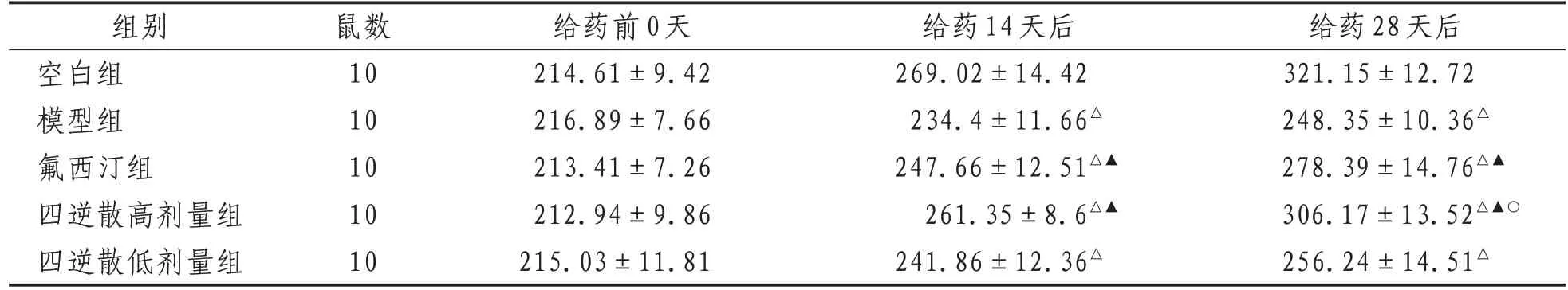
表1 各组大鼠不同时间点体质量比较(±s) g
注:△表示与空白组比较,P<0.01;▲表示与模型组比较,P<0.05;○表示与氟西汀组比较,P<0.05
组别空白组模型组氟西汀组四逆散高剂量组四逆散低剂量组鼠数10 10 10 10 10给药前0天214.61±9.42 216.89±7.66 213.41±7.26 212.94±9.86 215.03±11.81给药14天后269.02±14.42 234.4±11.66△247.66±12.51△▲261.35±8.6△▲241.86±12.36△给药28天后321.15±12.72 248.35±10.36△278.39±14.76△▲306.17±13.52△▲○256.24±14.51△
2.2 旷场行为计分给药14、28 天后,与空白组比较,其余各组大鼠运动计分明显减少(P<0.05);与模型组比较,氟西汀组、四逆散高剂量组水平运动及垂直运动计分显著增加(P<0.5)。给药28天后,与氟西汀组比较,四逆散高剂量组水平运动及垂直运动计分较多(P<0.5)。见表2。
表2 各组大鼠不同给药时间点行为学计分比较(±s) 分

表2 各组大鼠不同给药时间点行为学计分比较(±s) 分
注:△表示与空白组比较,P<0.01;▲表示与模型组比较,P<0.05;○表示与氟西汀组比较,P<0.05
组别空白组模型组氟西汀组四逆散高剂量组四逆散低剂量组鼠数10 10 10 10 10水平运动0天32.4±13.2 35.2±12.6 33.9±9.1 32.6±11.6 35.3±8.2 14天34.5±7.6 12.6±4.3△23.3±5.3△▲28.7±8.1△▲15.3±5.4△28天30.7±8.8 6.8±3.4△28.1±9.2△▲35.2±10△▲○18.7±9.5△▲垂直运动0天7.7±4.3 6.4±2.8 6.9±3.6 6.8±2.7 7.3±3.8 14天5.2±2.8 3.5±2.0△4.1±1.7△5.3±2.8▲○3.7±2.3△▲28天6.3±2.7 1.7±1.3△4.5±2.4△▲7.6±3.1△▲○4.4±3.3△
2.3 糖水偏好给药14、28 天后,与空白组比较,其余各组大鼠糖水偏好率明显减少(P<0.05);与模型组比较,氟西汀组,四逆散高、低剂量组糖水偏好率显著增加(P<0.05)。给药28 天后,与氟西汀组比较,四逆散高剂量组糖水偏好率明显增多(P<0.05)。见表3。
表3 各组大鼠不同时间点糖水偏好比较(±s) %
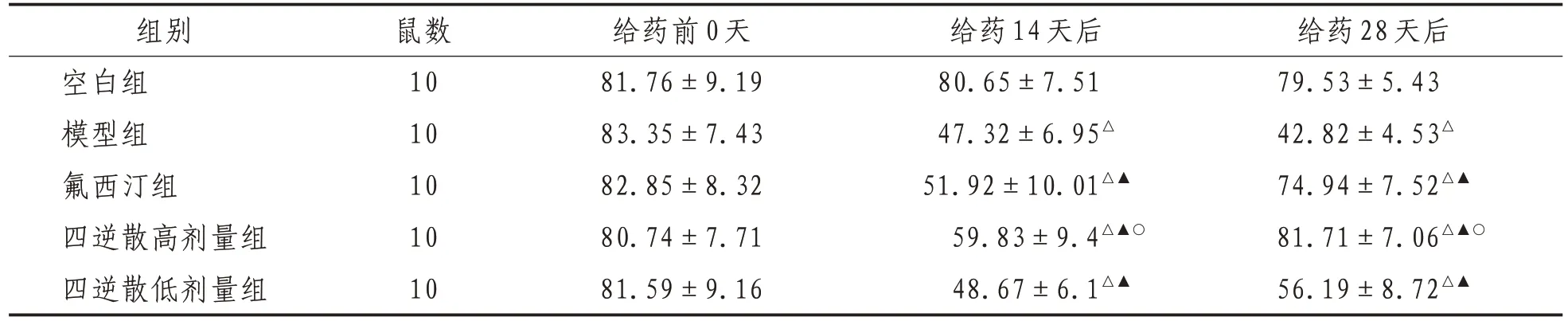
表3 各组大鼠不同时间点糖水偏好比较(±s) %
注:△表示与空白组比较,P<0.01;▲表示与模型组比较,P<0.05;○表示与氟西汀组比较,P<0.05
组别空白组模型组氟西汀组四逆散高剂量组四逆散低剂量组鼠数10 10 10 10 10给药前0天81.76±9.19 83.35±7.43 82.85±8.32 80.74±7.71 81.59±9.16给药14天后80.65±7.51 47.32±6.95△51.92±10.01△▲59.83±9.4△▲○48.67±6.1△▲给药28天后79.53±5.43 42.82±4.53△74.94±7.52△▲81.71±7.06△▲○56.19±8.72△▲
2.4 血清IL-1β、海马组织5-HT水平与空白组比较,模型组、四逆散低剂量组血清IL-1β水平明显升高(P<0.05),海马组织5-HT 水平明显下降(P<0.05);与模型组比较,氟西汀组、四逆散高剂量组血清IL-1β水平明显下降(P<0.05),海马组织5-HT水平明显升高(P<0.05);与四逆散高、低剂量比较,氟西汀组血清IL-1β水平下降(P<0.05),海马组织5-HT 水平升高(P<0.05)。与模型组比较,四逆散低剂量组血清IL-1β、5-HT 水平,差异均无统计学意义(P>0.05)。见表4。
表4 各组大鼠血清IL-1β、海马组织5-HT水平比较(±s)

表4 各组大鼠血清IL-1β、海马组织5-HT水平比较(±s)
注:△表示与空白组比较,P<0.05;▲表示与模型组比较,P<0.05;○表示与四逆散高、低剂量组比较,P<0.05
组别空白组模型组氟西汀组四逆散高剂量组四逆散低剂量组鼠数10 10 10 10 10 IL-1β(pg/mL)59.12±7.55 88.37±9.48△61.29±8.18▲○73.62±6.92▲84.57±5.69△5-HT(ng/g)196.91±22.19 98.43±18.28△189.52±15.65▲○180.49±17.17▲152.71±16.22△
3 讨论
目前医学仍未能够完全阐明抑郁症的发病机制,较一致公认抑郁症发生的主要原因是HPA 轴失调,HPA 轴是神经内分泌系统的重要部分,参与多种控制应激的反应,并能够调节消化、免疫系统、心情和情绪等许多身体活动。HPA 调控和释放CRH,并影响促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)的生成和分泌。而5-HT 是CRH 的兴奋性神经递质[14-15],5-HT 含量减少影响CRH的释放,使得人体激素失衡,故5-HT及其受体在HPA轴反馈调节中能够起到重要作用[16-17]。研究表明,海马区是5-HT 能神经元胞体投射到的初级脑区靶目标之一[18]。研究表明,海马组织5-HT 的含量可直接反映出HPA 轴的情况,5-HT 在人的情绪中扮演着重要的角色,它参与人体情绪、睡眠等多种基础生物的功能调节[19],中枢神经系统5-HT 水平含量的多少可影响情绪,同时会对大脑中其他递质如DA 等的活动造成影响,引发抑郁症[20]。
炎症反应是近些年发现的抑郁症相关病理之一。炎症因子作为调控人体神经-免疫-内分泌网络的重要因子,在人体内能够起到调控免疫应答生物活性的作用。炎症反应的过程中会释放炎症因子,大量炎症因子会损害神经元、突触,对神经元的功能及突触的可塑性造成影响,产生抑郁行为[21-22]。IL-1β作为一种炎症因子,关于其导致抑郁发生的机理,有以下相关研究:IL-1β可能通过SSH1/Cofilin/F-actin 信号通路介导CUMS 大鼠mPFC 部位突触可塑性的发生[23];IL-1β能够上调5-HT 转运体mRNA 和蛋白水平,使突触间隙5-HT浓度降低[24];IL-1β等炎症因子通过介导p38MAPK的信号通路能够快速启动5-HT转运体,合成5-HT减少[25]。临床研究[26]表明,抑郁症患者血液IL-1β水平普遍升高。
中医理论认为,郁证的主要病机为情志所伤,肝气郁结,使肝失输泄、脾失健运、心失所养,脏腑阴阳气血失调。临床上中医药治疗抑郁症多从肝论治,四逆散是调和肝脾的代表方,方中柴胡为君药,不仅疏解肝郁,而且能升清阳,使得郁热外透;芍药为臣药,养血敛阴,与柴胡相配,一升一敛,解郁热而不伤阴;枳实为佐药,行气散结,使气机更为舒畅;炙甘草缓急和中,调和诸药,为使药。诸药合用,具有透邪解郁、疏肝理脾之功效。临床和实验研究[27]均证明四逆散抗抑郁取得良好效果,并且发现抑郁症患者大脑神经元再生减少与炎症因子含量密切相关,四逆散可减少炎症因子的释放,增强细胞免疫力,调节HPA 轴,达到抗抑郁目的。亦有研究[28-29]证明,加味四逆散能使大鼠海马及前额叶皮质5-HT 及其受体含量显著升高,从而改善抑郁状态。但因中药成分自身的复杂性与抑郁症发病机制仍不明确,四逆散抗抑郁的机制未能确切。
本研究通过慢性不可预性温和应激(chronic unpredictable mild stress,CUMS)结合孤养方式建立抑郁大鼠模型,观察四逆散对抑郁模型大鼠行为学改变、血清IL-1β、海马组织5-HT含量变化的影响。结果显示,与模型组相比,氟西汀组、四逆散高剂量组在体质量、行为学、糖水偏爱情况方面明显改善,但与氟西汀组相比,四逆散高剂量组表现更为优势;与模型组相比,氟西汀组、四逆散高剂量组血清IL-1β明显下降,海马组织5-HT 含量明显增多,表明四逆散可以有效下调CUMS 抑郁模型大鼠血清IL-1β含量,提高海马组织5-HT 表达水平,这可能是四逆散抗抑郁作用的机制。但因本实验具有局限性,未能深入研究四逆散抗抑郁作用的具体信号通路机制,有待进一步研究四逆散调节炎症因子、神经递质的作用靶点。
