基于TGFβ1/Smad7 通路观察麻黄碱对肺心病大鼠血管内皮结构及功能的影响
2022-05-24杨利萍张友兰唐凤鸣
杨利萍,张友兰,唐凤鸣,欧 扬,李 莹
四川省人民医院温江医院/成都市温江区人民医院,四川 成都 611000
肺心病即慢性肺源性心脏病,主要是由于肺组织结构和功能病变,使肺血管的阻力和肺动脉压力升高,从而造成右心室肥厚,并最终导致右心功能衰竭[1],是一种高患病率、高死亡率的继发性心脏病。研究[2]表明,肺血管病变诱发的肺动脉高压(pulmonary arterial hypertension,PAH)是肺心病发病过程中的中心环节和先决条件。近年来研究发现,内皮细胞损伤(endothelial cell damage,ECD)导致的内皮功能失调是PAH 血管病变的基础病理改变,因此寻找合适的药物对ECD进行干预治疗,是PAH 治疗领域研究的热点之一[3]。麻黄是我国宝贵的药用植物,性味辛苦,具有宣肺平喘、发汗散寒、活血通络等作用。研究[4]表明,麻黄碱能通过抑制炎症减轻肺损伤和肺纤维化,有效抑制非小细胞肺癌细胞的增殖。然而,麻黄碱对肺动脉高压的保护作用及机制研究尚未报道。研究[5]表明转化生长因子β1(transforming growth factor β1,TGFβ1)/信号转导分子7(signal transduction molecule 7,Smad7)信号转导通路在血管平滑肌细胞迁移、动脉壁脂质沉积、动脉的炎性细胞浸润、血管壁的氧化应激等血管生物学行为发挥着重要的调控作用。ZENG Z 等[6]研究发现,TGFβ1/Smad7 在血管内皮损伤动物模型中表达异常。本研究通过腹腔注射野百合碱构建肺动脉高压模型,从TGFβ1/Smad7 信号通路出发,探讨麻黄碱对PAH 血管内皮的作用机制,从而为临床提供新的数据支撑。
1 材料与方法
1.1 实验动物12~13 周龄的雄性SD 大鼠60只,体质量在200~220 g,由四川省人民医院温江医院动物实验中心提供,实验动物许可证号:2019-0005A。饲养条件:依照实验动物管理办法,室温下标准饲料、自由饮水、分笼(4 笼)适应性饲养1周后用于实验。
1.2 试剂与仪器野百合碱(美国Sigma 公司,批号:012K7042);盐酸麻黄碱(赤峰制药厂,北京中顺制药分装,农工药准字1996 第000116 号);(transforming growth factorβ1,TGF-β1)特异性抑制剂SB431542(美国Selleck 公司,批号:265412m);TGF-β1、p-Smad2、p-Smad7 探针(Santa公司,批号:0502384);二喹啉甲酸浓度测定试剂盒(bicin-choninic acid,BCA,批号:SP256421);3,3-二氨基联苯胺(diaminobenzidine,DAB)化学发光试剂盒(Sigma 公司,批号:SB382415);苏木精-伊红(hematoxylin eosin,HE)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(上海碧云天生物技术公司,批号:SM654388);TGF-β1、p-Smad2、p-Smad7 抗体、兔抗3-磷酸甘油醛脱氢酶(glyceralde-hyde-3-phosphate dehydrogenase,GAPDH)及山羊抗兔IgG(美国abcam 公司,批号:ab264432);TUNEL、Western blot 试剂盒(德国Rebstock 公司,批号:2562224)。苏净Airtech 超净工作台(北京六一仪器厂);LEICAEG1150 型组织包埋机(德国Leica 公司);H-7650 型Nikon Ti-U/Ti-s 倒置荧光显微镜(日本三菱公司);5810R型高速离心机(日本岛津公司);生物电镜(美国Corning 公司);E-Gel Imager 凝胶成像仪(美国Beckma公司)。
1.3 实验方法
1.3.1 造模及分组 选择12~13周龄的SD大鼠60 只,随机分为正常组、模型组、治疗组、抑制剂组,每组15 只。除正常组外,其余各组大鼠用无水乙醇与生理盐水(2∶3)配成1%的野百合碱溶液,腹腔一次性注射构建肺心病大鼠模型,正常组注射等体积生理盐水。
1.3.2 给药方法 造模后治疗组和抑制剂组大鼠分别定时以10 mg/kg 麻黄碱和SB431542 灌胃给药;正常组和模型组给予等剂量生理盐水,所有大鼠每日给药1次,连续给药4周。
1.4 观察指标
1.4.1 大鼠血压及右心肥厚指数 连续给药4周后,各组大鼠腹腔注射30 mg/kg 戊巴比妥钠麻醉,参照文献方法[7]采集记录大鼠右心室收缩压(right ventricular systolic pressure,RVSP)和肺动脉压(pulmonary artery pressure,PAP),计算右心肥厚指数(right ventricular hypertrophy index,RVHI)。测量完毕后,腹动脉采血,低温离心后,获得血清,检测血清中一氧化氧(nitricoxide,NO)和血浆中内皮素1(endothelin-1,ET-1)的水平。将大鼠断头处死,留取各组大鼠的左侧肺叶,液氮封存,转移至深冷冰箱备用待测。
1.4.2 大鼠肺动脉病理学表现 从冰箱中取出各组大鼠肺动脉,制成石蜡切片,进行苏木素伊红、马松染色,光镜下观察各组大鼠肺动脉血管的病理改变。
1.4.3 大鼠肺动脉内皮细胞超微结构 从冰箱中取出各组大鼠肺动脉,分别制成0.3 cm×0.5 cm大小的超薄组织切片:采用2.5%戊二醛固定8 h,生理盐水清洗3 次,梯度浓度乙醇脱水,维持-20℃冷冻干燥过夜,透射电镜下观察各组大鼠肺动脉血管的内皮细胞超微病理结构改变。
1.4.4 大鼠肺动脉内皮细胞凋亡 从冰箱中取出各组大鼠肺动脉,常规方法固定,冰冻切片,二甲苯浸洗两次,梯度酒精浸洗5 min,风干后3%双氧水-甲醇浸泡10 min,PBS漂洗3次,每次3 min,然后4℃预冷乙醇进行如下操作:0.1%TritonX-100、0.1%缓冲液处理2 min,PBS 漂洗3 次,每次3 min,加入TUNNEL 反应混合液,加封口膜在暗湿盒中反应1 h,温度37℃,PBS 漂洗,梯度酒精脱水,二甲苯透明,中性树脂封片,荧光显微镜进行观察,每组切片6 个不同的视野,并通过Image-Pro 6.2 软件处理图像[6],进行统计分析得到各组大鼠的肺动脉血管的内皮细胞的凋亡率。
1.4.5 氧化应激相关底物和酶 从大鼠眼眶取血,各组血清样本在蛋白酶抑制剂作用下超声溶解,以离心半径15 cm,4000 r/min 离心5 min,收集上清液进行分析。采用蛋白测定试剂盒测定上清液蛋白浓度。参照试剂盒说明书的操作步骤,分别检测各组血清样本中总抗氧化能力(total antioxidant capacity,T-AOC)、SOD 水平及MDA、活性氧(reactive oxygen species,ROS)含量。
1.4.6 荧光原位杂交检测各组大鼠肺动脉TGFβ1、Smad2、Smad7的mRNA的表达 从冰箱中取出各组大鼠肺动脉,10%甲醛固定,制成0.5µm石蜡切片,脱蜡,风干,加入蛋白酶K 反应液(100 mmol/l Tris-HCL,50 mmol/L EDTA 和1µg/mL 蛋白酶K,各1 mL 的混合液),在37°C 水浴中孵育20 min,用缓冲液冲洗3 次,通过酒精梯度脱水。加入1 mL 变性溶液(70%甲酰胺,2X SSC和0.1 mmol/L的EDTA,各1 mL的混合液),在75℃下孵育8 min,同时杂交含目的蛋白mRNA探针的溶液,在75℃下孵育8 min。每个载玻片区域覆盖有50 µL 杂交混合物,将溶液置于湿箱中,并在42℃的烤箱中杂交过夜[7-8]。杂交后,幻灯片被洗脱,通过酒精梯度脱水并风干,在显微镜下观察。
1.4.7 Western blot 检测各组大鼠肺动脉TGFβ1、p-Smad2、p-Smad7 的表达水平 从冰箱中取出各组大鼠肺动脉,PBS 缓冲液冲洗2 次,研磨匀浆,冰上裂解30 min 后,离心获得上清,蛋白浓度采用BCA试剂盒测定,每个样品取50µg,然后进行SDS-PAGE 电泳、PVDF 转膜、TBST 液封闭,维持4℃过夜孕育,然后分别加入一抗(TGFβ1,p-Smad2,p-Smad7)(1∶1500),孕育1 h,洗涤加入抗辣根过氧化物酶标记的羊抗兔IgG(1∶10000),加入ECL显色30 min,以GAPDH 作为内参表示蛋白相对表达水平。
1.5 统计学方法采用软件SPSS 16.0对数据进行统计分析,计量资料采用±s进行表示,多组间比较采用单因素方差分析,两两间比较采用独立t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 大鼠血压及RVHI水平与正常组比较,模型组大鼠RVSP、PAP和RVHI水平均显著升高(P<0.05)。与模型组比较,药物干预后,治疗组和抑制剂组RVSP、PAP 和RVHI 水平均显著下降(P<0.05);两组各项指标比较,差异无统计意义(P>0.05)。见表1。
表1 各组大鼠血压及RVHI水平比较(±s)

表1 各组大鼠血压及RVHI水平比较(±s)
注:1 mm Hg≈0.133 kPa;*表示与正常组比较,P<0.05;#表示与模型组比较,P<0.05
组别正常组模型组治疗组抑制剂组鼠数15 15 15 15 RVSP(mm Hg)34.31±3.24 97.61±8.06*54.74±5.18*#56.16±6.09*#PAP(mm Hg)21.65±2.52 60.15±3.32*31.69±2.96*#33.31±2.12*#RVHI(%)0.29±0.02 0.69±0.08*0.42±0.04*#0.44±0.05*#
2.2 大鼠血清NO、ET-1 含量与正常组比较,模型组大鼠血清NO 含量显著下降(P<0.05),ET-1的含量显著上升(P<0.05)。经药物干预后,与模型组比较,治疗组、抑制剂组大鼠血清NO 含量显著上升,ET-1 含量显著下降(P<0.05);两组各项指标比较,差异无统计意义(P>0.05)。见表2。
表2 各组大鼠血清中NO和ET-1含量比较(±s)

表2 各组大鼠血清中NO和ET-1含量比较(±s)
注:*表示与正常组比较,P<0.05;#表示与模型组比较,P<0.05
组别正常组模型组治疗组抑制剂组鼠数15 15 15 15 NO(µmol/L)45.38±5.12 21.60±3.07*34.21±3.26*#37.24±3.18*#ET-1(pg/L)93.27±11.29 136.19±15.74*109.87±12.87*#115.28±12.67*#
2.3 大鼠肺动脉氧化应激指标与正常组比较,模型组大鼠肺动脉ROS、MDA水平显著增加,而SOD和T-AOC 水平显著降低;与模型组比较,治疗组、抑制剂组大鼠肺动脉ROS 和MDA 水平显著降低,SOD和T-AOC水平显著增加,差异均具有统计学意义(P<0.05);治疗组、抑制剂组大鼠肺动脉ROS、MDA、SOD 和T-AOC 水平比较,差异无统计学意义(P>0.05)。见图1。

图1 各组大鼠氧化应激相关指标变化情况
2.4 大鼠肺动脉组织病理变化正常组HE 染色结果显示,大鼠肺动脉血管壁光滑且富有弹性,血管壁厚度与血管管腔面积正常,内膜层连续排列规整,通过Masson 染色,发现在视野中显示出少量胶原纤维;模型组大鼠肺动脉血管僵硬度明显增加,内膜增厚明显,管腔明显变窄,管腔内大量炎症细胞填充,内膜结构不规则,内皮凸起、缺损严重,Masson 染色显示血管壁和周围组织中显示出许多无序增殖的胶原纤维;治疗组和抑制剂组大鼠的肺动脉在内皮结构、厚度、内膜完整性,以及胶原纤维增生方面较模型组有明显改善。见图2。

图2 各组大鼠肺动脉病理变化情况(A1-D1为HE染色,×400;A2-D2为Masson染色,×400)
2.5 大鼠肺动脉超微结构改变正常组大鼠肺动脉内皮细胞结构完整,排列规整、连续,细胞间连接紧密,基底膜完整,无隆起与脱落现象,内膜厚薄均匀,内膜力膜平直,无弯曲,平滑肌细胞分布致密,弹力板未出现断裂现象,胞浆内线粒体结构完整,性状正常;模型组大鼠肺动脉内皮细胞增生,形状失去稳定结构,基底膜断裂明显,平滑肌细胞肥大,弹力板结构不完整且断裂,胞浆内线粒体肿胀明显,结构缺损严重;治疗组和抑制剂组大鼠肺动脉内皮细胞扁平、较为完整,线粒体空泡样变性明显好转,内膜力膜连续,厚度趋于均匀,中膜平滑肌细胞略见增生,弹力板结构清晰,排列较为整齐。见图3。

图3 各组大鼠透射电镜下肺动脉超微结构变化(×6000)
2.6 大鼠肺动脉中内皮细胞凋亡率与正常组比较,模型组大鼠肺动脉内皮细胞的凋亡率显著升高(P<0.05)。与模型组比较,经过药物干预后,治疗组和抑制剂组大鼠肺动脉内皮细胞凋亡率显著降低(P<0.05);治疗组和抑制剂组比较,差异无统计意义(P>0.05)。见图4。
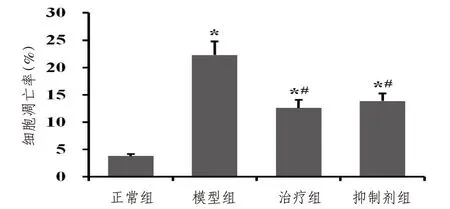
图4 各组大鼠肺动脉中内皮细胞凋亡率
2.7 大 鼠 肺 动 脉 中TGFβ1、p-Smad2 及p-Smad7mRNA及蛋白表达与正常组比较,模型组大鼠肺动脉中TGFβ1、p-Smad2及p-Smad7的mRNA荧光强度明显增强(P<0.05),蛋白表达量显著升高(P<0.05)。与模型组比较,治疗组和抑制剂组大鼠肺动脉中TGFβ1和p-Smad2 的mRNA 荧光强度明显减弱,蛋白表达量显著降低(P<0.05);p-Smad7 的mRNA 荧光强度明显增强,蛋白表达量显著升高(P<0.05);治疗组和抑制剂组大鼠肺动脉的TGFβ1、p-Smad2及p-Smad7的mRNA及蛋白表达差异无统计学意义(P>0.05)。见图5—6。
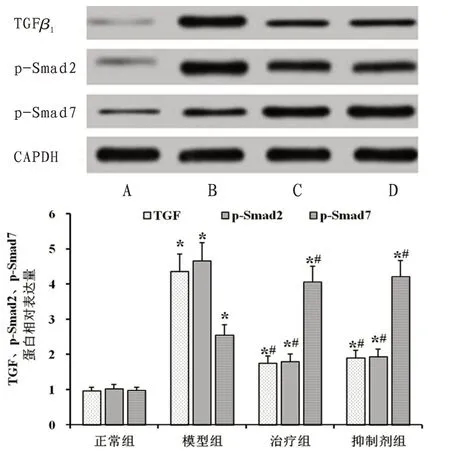
图5 各组大鼠肺动脉TGFβ1、p-Smad2及p-Smad7蛋白表达
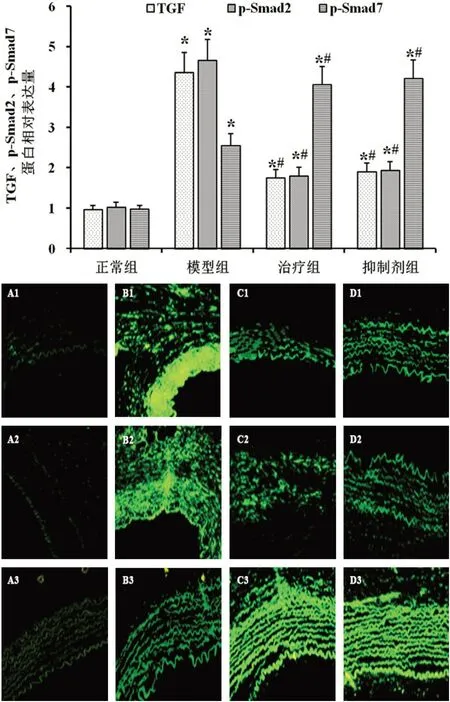
图6 各组大鼠肺动脉TGFβ1、p-Smad2 及p-Smad7 mRNA 表达(A1-D1,×200;A2-D2,×400;A3-D3,×800)
3 讨论
肺心病是一种严重的呼吸系统和循环系统疾病,具有较高的患病率及病死率。相关研究[8]表明,PAH 是肺心病发生发展的关键环节,而血管结构,特别是内皮结构和功能改变是PAH 的基础病理生理因素。因此,近年来越来越多的研究开始针对内皮细胞进行干预,用以治疗PAH。麻黄碱是中药麻黄的主要成分,研究[9]报道麻黄碱可通过抑制血管炎症来减轻肺损伤和肺纤维化,对肺心病有一定的治疗作用。本研究采用腹腔注射野百合碱构建肺动脉高压模型,然后观察麻黄碱治疗PAH的效果。结果显示模型组大鼠的RVSP、PAP和RVHI 水平均显著升高,而药物干预后,治疗组的RVSP、PAP和RVHI水平均显著下降,结果提示麻黄碱对PAH大鼠具有一定的保护作用。
相关研究[10]表明,NO和ET-1两者的平衡对于血管舒缩功能的维持具有重要意义。STEVEN S[11]研究报道,肺动脉高压患者血浆中ET-1 升高,NO水平降低,肺动脉血管处于高度收缩状态,形成肺动脉高压,导致血管功能障碍。本研究中,PAH 模型组大鼠血清中ET-1的水平显著升高,NO水平显著下降,药物干预后可显著降低大鼠血清ET-1 水平,升高NO 水平,说明麻黄碱改善内皮功能的作用机制与降低血清ET-1 水平、升高NO 水平有关。ROS 是一类广泛存在于生物体中富含有氧元素的物质,当机体受到刺激后,过剩的ROS 可导致多种组织出现氧化应激损伤[12]。SOD 是氧化应激反应中主要的抗氧化剂,机体抗氧化系统主要受SOD和MDA 的动态平衡维持。许良葵[13]研究表明,麻黄碱可通过抑制ROS 的产生来抑制细胞凋亡,从而帮助血管内皮细胞抵抗H2O2诱导的氧化应激。本研究发现,应用麻黄碱干预后,大鼠ROS 和MDA水平显著降低,而SOD 和T-AOC 水平显著升高,说明麻黄碱对PAH 引起的氧化应激反应具有一定的缓解作用,该结果与既往实验结果[13]一致,再次证实了药物的治疗效果。
PAH 发病机制尚未明确,文献报道[14]称内皮细胞凋亡在PAH 发生发展过程中起着重要作用,内皮细胞过度凋亡会促进循环系统障碍,因此阻断内皮细胞凋亡可以改善PAH。本研究染色结果显示,模型组大鼠肺动脉血管僵硬度明显增加,内膜增厚明显,管腔明显变窄,管腔内有大量炎症细胞填充,内皮凸起、缺损严重,且血管壁和周围组织中显示出许多无序增殖的胶原纤维。进一步观察超微结构发现,模型组大鼠肺动脉内皮细胞增生,失去稳定结构,基底膜断裂明显,平滑肌细胞肥大,弹力板结构不完整且断裂,胞浆内线粒体肿胀明显,结构缺损严重,这提示PAH 大鼠的肺动脉组织结构发生明显改变。治疗组肺动脉在内皮结构、厚度、内膜完整性,以及胶原纤维增生方面较模型组有明显改善,提示麻黄碱可以明显改善PAH 大鼠肺动脉组织。李中燕[15]研究显示,麻黄碱可以明显抑制支气管哮喘内皮细胞凋亡,本研究中TUNNEL 染色结果显示,模型组大鼠肺动脉内皮细胞凋亡明显,凋亡指数明显高于正常组,而药物干预处理后,凋亡指数明显下降,提示麻黄碱能够抑制肺动脉内皮细胞凋亡,起到保护血管内皮结构的作用。
文献报道[16]显示,TGFβ1/Smad7 是与血管生物学行为密切相关的信号通路,在血管内皮细胞形态维持、平滑肌细胞黏附与迁移以及血管中膜细胞收缩等多种细胞生物学行为发挥关键的调控作用。YAO W 等[17]研究表明抑制TGFβ1的表达、上调p-Smad7 的表达能明显改善由炎性因子诱导的内皮功能障碍。本研究中,用TGFβ1/Smad7信号通路特异性抑制剂SB431542灌胃处理PAH大鼠来观察TGFβ1/Smad7 信号通路的作用机制。结果发现抑制剂组的结果与治疗组大鼠无明显差异,能够改善PAH 大鼠中肺动脉血管的内皮损伤。原位荧光和Western blot 结果表明,模型组大鼠肺动脉中TGFβ1、p-Smad2 及p-Smad7 的mRNA 荧光强度明显增强,各蛋白的相对表达量显著升高;治疗组和抑制剂组大鼠肺动脉中TGFβ1、p-Smad2 的mRNA 荧光强度明显减弱,p-Smad7 的mRNA 荧光强度明显增强,TGFβ1、p-Smad2 蛋白的表达显著下降,p-Smad7蛋白的表达显著升高。推断麻黄碱可能通过抑制TGFβ1和p-Smad2 的表达,上调p-Smad7 的表达来发挥其对PAH脉血管内皮的保护作用。
综上所述,麻黄碱对PAH 肺动脉血管内皮的保护作用,与TGFβ1/Smad7 信号通路有关,其机制可能是抑制TGFβ1和p-Smad2的表达,上调p-Smad7的表达,来降低氧化应激反应,抑制内皮细胞凋亡,发挥对PAH肺动脉血管内皮的保护作用。
