癌性空洞在安罗替尼治疗晚期非小细胞肺癌中的预后价值
2022-05-24刘丹青丁国正
刘丹青 丁国正
Globocan 2020提出截至2020年,全球约有1930万例新发癌症和近1000万例癌症患者死亡,肺癌的发病率以及病死率最高[1]。安罗替尼是一种新型的酪氨酸激酶抑制剂,能够广泛抑制肿瘤内血管新生,从而抑制肿瘤的生长和转移[2-3]。大量研究提出,病灶中出现空洞是肺癌患者接受抗血管生成治疗过程中的常见现象。目前,癌性空洞并没有被纳入实体瘤疗效评估标准(RECIST)1.1,但是在实际临床工作中,病灶中出现空洞往往意味着治疗有效[4]。目前关于肺癌患者在接受抗血管生成药物治疗的过程中,病灶中空洞的形成与患者的预后关系尚存争议。本研究旨在探讨,在晚期非小细胞肺癌(Non-small-cell lung cancer,NSCLC)患者接受安罗替尼治疗的过程中,肺部病灶中癌性空洞的形成对其预后价值。
资料与方法
一、对象
本研究通过回顾性方法收集了2018年至2020年于安徽医科大学附属安庆医院三线或三线以上接受安罗替尼治疗的晚期NSCLC患者的一般临床资料、疗效、无进展生存期、不良反应。该研究已通过本院伦理委员会审批(医学伦审(2021)第31号),且所有患者或其家属均已签署了同意书。研究的纳入标准如下:(1)经组织病理学证实为NSCLC;(2)所有患者需至少接受二线治疗后出现进展(包括放疗、化疗、免疫治疗等),至少有一个可测量病灶,可通过胸部CT测量病灶大小;(3)年龄18~80岁;(4)ECOG PS评分:0~1分;(5)主要器官功能正常。排除标准如下:(1)3个月内肺部原发病灶曾出现活动性出血;(2)中央型鳞癌;(3)难以控制的高血压及糖尿病;(4)未控制的高钙血症;(5)甲状腺功能异常;(6)同时合并其他恶性肿瘤;(7)在开始服用安罗替尼前,患者胸部CT提示肺部病灶中已出现癌性空洞。
二、方法
1 治疗方案 纳入研究的患者每日口服12 mg安罗替尼,持续用药2周,3周为一个治疗周期,并依据药物产生的不良作用调整剂量。若患者未发生不良反应,则按照原始剂量继续口服,若患者发生不可耐受的不良反应(包括2级、3级、4级),则进行减量或者停药,减量依次为10mg、8mg,直至出现进展。
2 治疗疗效评价 每位患者在服用安罗替尼治疗之前均需完善胸部CT检查,安罗替尼每治疗2周期复查患者胸部CT等相关影像学检查,根据胸部CT,判断是否出现癌性空洞。按照RECIST 1.1进行疗效评估,完全缓解(CR):所有的肿瘤病灶均消失至少4周;部分缓解(PR):所有肿瘤病灶的直径和较前下降至少30%,时间≥4周;进展(PD):所有肿瘤病灶的直径和较前增长至少20%,或者至少出现一处新病灶;稳定(SD):未达到部分缓解且未达到进展标准。客观反应率(ORR)是指(CR+PR)/总患者数×100%,疾病控制率(DCR)是指(CR+PR+SD)/总患者数×100%。无进展生存期(PFS)是从治疗第一天到进展或死亡的时间。根据美国国立癌症研究所不良反应评价标准(NCI-CTCAE 4.0)记录患者发生的不良反应(Ⅰ~Ⅳ级)。
三、统计学方法
采用SPSS26.0软件进行统计分析,分类资料采用χ2检验,连续性资料采用独立样本t检验;采用多因素Logistic回归模型筛选癌性空洞的危险因素();利用Cox回归模型分析癌性空洞对患者PFS的影响,并绘制校正协变量的生存曲线,应用Kaplan-Meier法计算中位生存时间,P<0.05认为有统计学意义。
结 果
一、一般临床资料
17.6%(12例/68例)患者在接受安罗替尼治疗过程中肺部病灶出现空洞;CR 0例,PR 16例,SD 32例,PD 20例;ORR 23.5%(16例/68例),DCR 70.6%(48例/68例),MPFS 5.7月(95%CI:4.488~6.912)(见表1及图1)。

表1 患者一般临床资料(n=68)
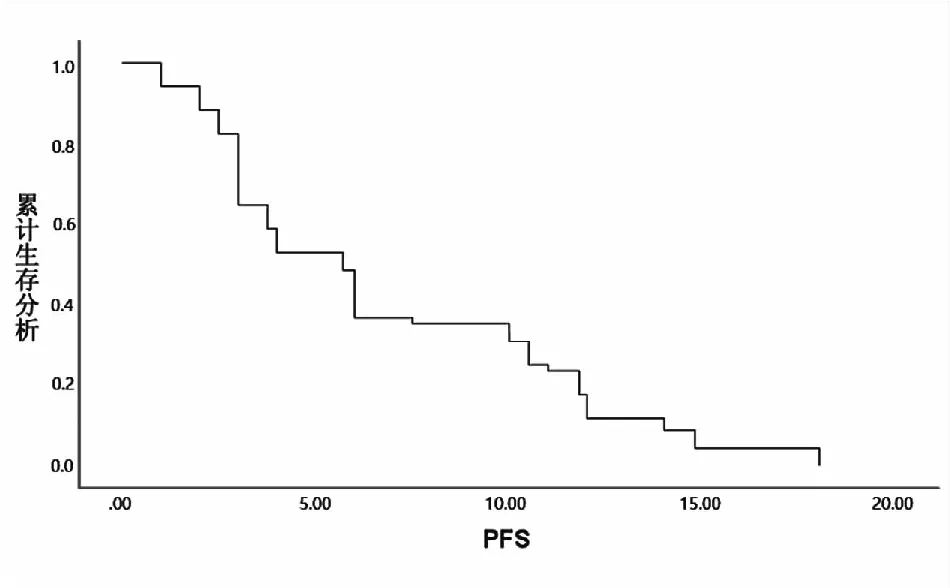
图1 68例患者PFS生存曲线
二、一般临床资料与癌性空洞的关系
晚期NSCLC患者在治疗期间,患者的性别、年龄、病理类型、临床分期、脑转移对患者肺部病灶中癌性空洞的形成无影响,而抽烟史是癌性空洞形成的独立危险因素(见表2,3)。

表2 癌性空洞与一般临床资料单因素分析(n)

表3 癌性空洞与一般临床资料Logistic多因素回归分析
三、癌性空洞与治疗疗效的相关性
在疾病控制组(CR+PR+SD)48例中,有癌性空洞12例,无癌性空洞36例;在疾病进展组(PD)20例中,有癌性空洞0例,无癌性空洞20例;两者之间差异具有统计学意义(P=0.014)(见表4)。
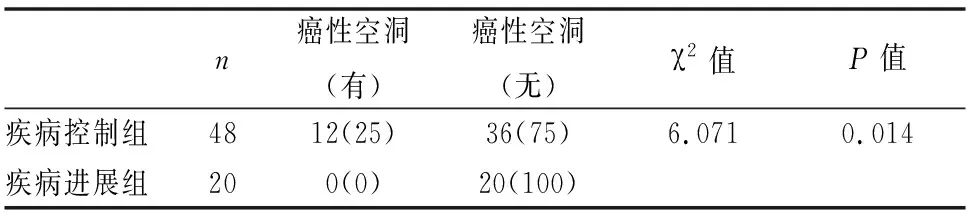
表4 疾病控制组及疾病进展组癌性空洞情况[n(%)]
四、癌性空洞与无进展生存期的关系
有癌性空洞组患者的MPFS12.0月(95%CI:9.284~14.716),无癌性空洞组患者的MPFS为3.8月(95%CI:2.833~4.667),两者差异具有显著统计学意义(P<0.001)(见表5、6,图2)。

表5 一般临床资料与PFS的COX单因素回归分析

表6 一般临床资料与PFS的COX多因素回归分析

图2 有无癌性空洞患者PFS的Kaplan-Meier曲线
五、不良反应
记录68例患者在治疗期间的不良反应,最为常见的不良反应分别为高血压(38.23%)、乏力(36.76%)、手足综合征(36.76%)。1例患者因难以控制的高血压和蛋白尿,调整剂量为8 mg/天,1例患者因不可耐受的呕吐和乏力将药量减至10mg,2例患者分别因咯血和血尿停药(见表7)。

表7 不良反应发生情况[n(%)]
讨 论
肿瘤新生血管的形成涉及到肿瘤微环境的维持,肿瘤的生长以及转移,是一个重要的过程[5]。血管生成是肺癌的标志之一[6]。血管内皮生长因子 、血小板衍生生长因子等蛋白因子在血管生成中起重要的作用[7]。
安罗替尼能够全面抗瘤内血管生成,从而抑制肿瘤的生长[2]。安罗替尼Ⅱ期及Ⅲ期临床研究结果均显示,与安慰剂相比,安罗替尼三线用于治疗晚期NSCLC患者的PFS和OS得到明显延长[8-9]。
安罗替尼Ⅲ期临床研究证实,安罗替尼组病人的MOS为9.63个月,MPFS 5.37个月,ORR 9.18%,DCR 80.95%[9]。本研究的ORR 23.5%,DCR 70.6%,MPFS 5.7月。ORR和MPFS均稍高于Ⅲ期临床实验,可能与本研究中患者大部分处于三线治疗,且本研究样本量过少,数据具有局限性。
在晚期NSCLC患者接受抗血管生成治疗的过程中,肺部病灶中空洞的形成是一种较为常见的现象。有研究报道,在抗血管生成药物治疗晚期NSCLC的过程中,大约有16%的病灶会出现空洞,癌性空洞的出现与患者抽烟史相关[10]。有研究提出,在晚期NSCLC接受贝伐珠单抗治疗的过程中,19%的患者肺部病灶中会出现空洞,肺部病灶中是否出现空洞与患者性别、年龄、抽烟史、肿瘤分期无相关性[11]。也有研究发现,在西地尼布联合以铂类为基础化疗治疗晚期NSCLC的过程中,24%患者肺部病灶中会出现空洞[12]。最近一项关于安罗替尼治疗小细胞肺癌过程中,15%的患者肺部病灶出现了空洞,该研究同时也指出,肺部病灶中空洞的形成与患者性别、年龄、病理类型以及肿瘤分期无相关性[4]。本研究发现在晚期NSCLC接受安罗替尼治疗的过程中,17.6%的患者肺部病灶出现了空洞,患者的性别、年龄、病理类型、临床分期、脑转移对患者肺部病灶中癌性空洞的形成无影响,而抽烟史是癌性空洞形成的独立危险因素,该结果与上述研究相近。综上所述,目前并没有明确的证据可以证明,抗血管生成药物治疗肺癌的过程中,患者的性别、年龄、抽烟史、肿瘤分期等会影响肺部病灶中空洞的形成。
关于抗血管生成药物治疗肺癌的过程中,癌性空洞与患者生存期是否有相关性,目前尚存在争议。相关研究发现,在抗血管生成药物治疗晚期肺癌患者过程中,病灶中是否出现空洞与患者生存期无相关性[10]。同样有报道指出,晚期NSCLC患者接受贝伐珠单抗治疗的PFS和OS与治疗过程中是否出现癌性空洞无相关性[11]。但是有研究指出,晚期NSCLC患者接受恩度联合长春瑞滨和顺铂治疗的过程中,肺部病灶中有空洞形成的患者生存期更长[13]。同样有研究报道,安罗替尼治疗小细胞肺癌的过程中,出现癌性空洞的患者能够获得更长的PFS[4]。在本研究中,入组的68例晚期NSCLC患者,出现癌性空洞患者的PFS明显长于未出现癌性空洞的患者,且近期疗效更佳。
在安罗替尼Ⅲ期临床试验中,安罗替尼产生的常见副作用包括高血压(64.6%)、乏力(46.3%)以及手足综合征(43.2%)等[9]。一项294例患者接受安罗替尼治疗的不良事件研究发现,高血压(57.8%),手足综合征(3.7%),腹泻(12.9%)。其中有24例(8.16%)和31例(10.54%)患者需要减量和停药[14]。在本研究中发现:安罗替尼治疗68例晚期NSCLC最常见的不良反应分别为高血压(38.23%)、乏力(36.76%)、手足综合征(36.76%),结果与上述实验接近。
由于本实验的研究期限不足,未获得患者总生存期(OS),故仍需要继续随访观察。因为目前尚无关于癌性空洞大小的统一测量标准,所以在本研究中只分析了是否出现癌性空洞,并没有探讨空洞的大小与患者生存期的关系。
安罗替尼治疗晚期NSCLC疗效和安全性良好,本研究结果对晚期NSCLC的治疗决策有一定的参考价值。
