慢性阻塞性肺疾病患者血清lncRNA IL-6-AS1水平及其与肺功能的相关性分析
2022-05-24赵寅生张辉管涛毛文凯曲毅
赵寅生 张辉 管涛 毛文凯 曲毅
慢性阻塞性肺疾病(慢阻肺)的特征是进行性气流阻塞和持续加重的气流限制,肺或气道对吸烟或其他有害气体和颗粒的异常和持续的炎症反应[1-2],其突出的病理特征就是呼吸性细支气管炎、实质性破坏(如肺气肿)和黏液高度分泌,其主要致病机制是慢性炎症、加速衰老和氧化应激[3-4]。白细胞介素6(Interleukin 6,IL-6)是一种关键的促炎症细胞因子[5]而慢性阻塞性肺疾病患者血清IL-6过度产生的机制尚不清晰,相关分子途径也鲜有报道。
长链非编码RNA(Long non-coding RNA, LncRNA)是长度超过200个核苷酸的转录本,在人类健康和疾病中具有调节功能[6]。Yi等发现lncRNA IL-6-AS1在慢性阻塞性肺疾病患者血清表达异常[7]。
因此,本文通过探讨慢性阻塞性肺疾病严重程度与lncRNA IL-6-AS1表达水平关系,为疾病诊疗提供参考。
资料与方法
一、一般资料
筛选2020年1月到2021年6月本院收治的132例慢阻肺患者,其中急性加重期54例,稳定期78例,并选取同期参加健康体检的同龄人群为对照组,具体一般资料(见表1)。
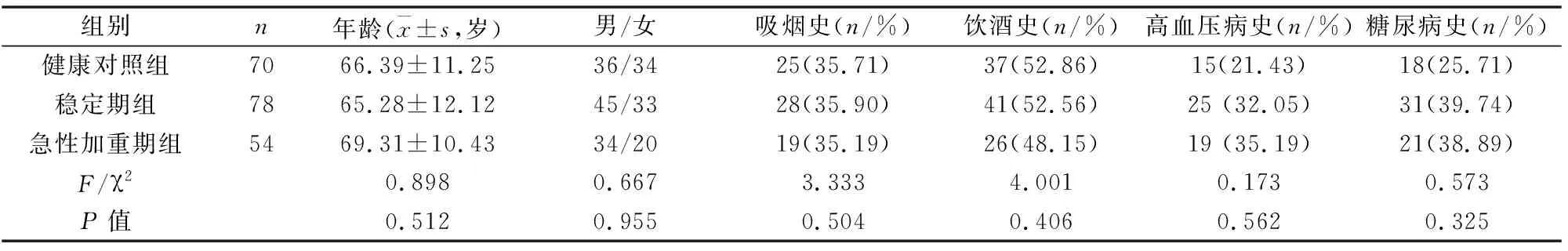
表1 一般资料
纳入标准:(1)符合《慢性阻塞性肺疾病基层诊治指南(2018年)》慢性阻塞性肺疾病稳定期和急性加重期诊断标准;(2)入组前4周患者并未使用过影响试验观察结果的药物,如糖皮质激素等。(3)患者可以无障碍沟通。患者及其家属了解研究内容,并签署患者知情同意书。
排除标准:(1)患者伴有其他肺病,有支气管扩张药物使用史;(2)伴有其他器官疾病,如心脑血管疾病、肝肾功能障碍、免疫功能障碍等患者;(3)有沟通障碍者。本研究符合赫尔辛格宣言,经本院伦理委员会同意。
二、指标检测
1. 血清lncRNA IL-6-AS1表达水平: 对各组研究对象清晨空腹采集静脉血5 mL,3000 r/min 离心15 min后收集血清,置于-80℃保存。采用RNA提取试剂盒(SolarBio,中国北京)提取血清总RNA,逆转录试剂盒(Thermo Fisher Scientific,美国)将RNA逆转录为cDNA。采用qRT-PCR仪(Bio-Rad,美国)对lncRNA IL-6-AS1表达水平进行分析,包括40个循环,95℃ 30s,95℃ 5s以及60℃ 30 s。单基因相对表达水平用2-ΔΔCT法计算。以GAPDH为内部参照,引物信息为IL-6-AS1正向F:5′-GCATAACATTTCAGGACCCGC3′,反向R:5′-GGAGCAGTGGCTTCGTTTCA-3′;GAPDH正向F:5′-CAGCCTCAAGATCATCAGCA-3′,反向R:5′-ACAGTCTTCTGGGTGGCAGT-3′。
2. 肺功能指标检测: 应用肺功能检测器检测研究对象肺功能,记录PEF% pred, FEV1% pred以及FEV1/ FVC等肺功能指标。
三、统计学分析
结 果
一、一般资料比较
慢阻肺患者与健康对照组一般资料比较,年龄、性别、吸烟史、饮酒史、高血压病史和糖尿病史比较均为差异不显著(P>0.05),具有可比性(见表1)。
二、血清lncRNA IL-6-AS1水平比较
各组患者血清lncRNA IL-6-AS1水平表达水平, lncRNA IL-6-AS1在慢阻肺患者中显著上调,相对表达水平为(1.43±0.13),急性加重期组患者lncIL-6-AS1相对表达水平(1.73±0.17)显著高于稳定期组(P<0.05)(见图1)。
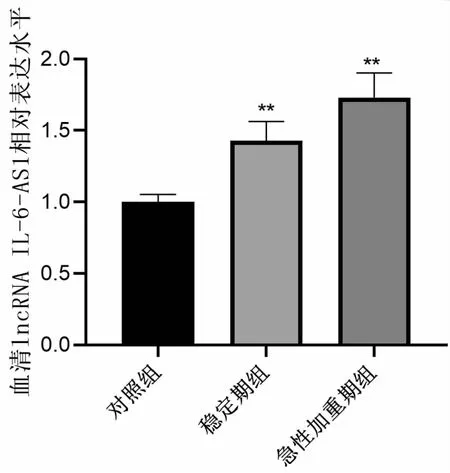
图1 血清lcnRNA IL-6-AS1相对表达水平注:与对照组相比,**P<0.05
三、各组人群肺功能指标比较
分析各组患者及健康对照组人群PEF%pred,FEV1%pred,FEV1/FVC(%),结果表明,与对照组相比,稳定期和急性加重期组患者肺功能指标显著降低(P<0.05),且急性加重期组患者显著低于稳定期组(P<0.05)(见表2)。
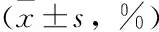
表2 不同组别肺功能指标比较
四、慢阻肺患者血清lncIL-6-AS1水平与肺功能指标相关性分析
利用Pearson相关性分析结果表明,慢阻肺患者血清lncIL-6-AS1表达水平与肺功能指标PEF%pred,FEV1%pred,FEV1/FVC(%)呈负相关,且P<0.001。结果说明,慢阻肺患者血清lncRNA IL-6-AS1随肺功能降低呈升高趋势(见图2)。
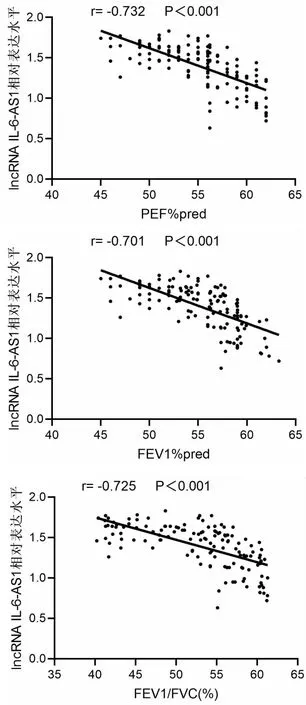
图2 lncRNA IL-6-AS1相对表达水平与PEF%pred,FEV1%pred,FEV1/FVC(%)相关性分析
讨 论
多种炎症因子会诱发慢阻肺,导致气道结构改变和气道重塑,慢性炎症可能是慢阻肺发病核心机制,但这一过程的确切机制尚不清楚。诸多研究表明,lncRNA可能成为慢阻肺的潜在生物标志物的有效工具。Tang等利用微阵列分析结果发现有8376个lncRNA表达异常,lncRNA的靶向预测和潜在功能特征有助于探索慢阻肺患者的潜在疗效,并提供更多新的治疗靶点[8]。LncRNA MALAT1可通过调控其靶点miR-125b,miR-146a和miR-203,在慢阻肺急性加重风险预测和管理中显示出临床意义[9]。CAS2在慢阻肺患者中表达下调,与肺功能指标FEV1呈正相关[10]。Song等人提出,LncMIR155HG通过调控miR-128-5p促进人肺微血管内皮细胞的凋亡和炎症,而且lnc MIR155HG的表达水平与烟雾暴露相关[11]。本研究发现,慢阻肺患者血清lncRNA IL-6-AS1表达水平与肺功能指标PEF%pred,FEV1%pred,FEV1/FVC(%)呈负相关,与Yi等人的研究成果一致。
IL-6 是多效性细胞因子,参与介导包括慢阻肺在内的多种肺部疾病的进展。在免疫系统中IL-6参与树突状细胞的分化,并调节Th1和Th2效应器功能之间的平衡。IL-6信号的局部增加与组织结构损伤有关,而且细胞局部IL-6浓度可能影响免疫细胞的调节[12]。诸多研究提出,慢阻肺患者血清中IL-6表达上调,在促进慢阻肺进展中发挥作用[13],这与本研究结果一致。本研究在慢阻肺患者血清中发现lncRNA IL-6-AS1高表达,且急性加重期患者表达水平更高,反应出慢阻肺患者病情加重。
综上所述,本研究发现lncRNA IL-6-AS1在慢阻肺患者血清中表达上调,且其在急性加重期表达水平更高,并与炎症进展相关。另外,lncRNA IL-6-AS1与慢阻肺病患者肺功能呈负相关。因此,lncRNA IL-6-AS1可能是慢阻肺临床诊疗很有潜力的分子靶点。但本研究并未深度挖掘lncRNA IL-6-AS1对慢阻肺疾病进展的作用机制,后期将深度探讨其对慢阻肺进展的相关分子机制。
