斑马鱼“裂头病”病原的分离与鉴定及常见疾病诊断*
2022-05-23柳力月潘鲁湲孙永华
柳力月 潘鲁湲 孙永华
(中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室,国家水生生物种质资源库国家斑马鱼资源中心,武汉 430072)

斑马鱼(Danio rerio)是开展脊椎动物遗传发育及其代谢调节、人类疾病模型和药物筛选、环境毒理、鱼类生理与育种等研究的重要模式动物。
因性成熟周期短、繁殖可控、体外受精、体外发育、胚胎透明、管理方便等特点,斑马鱼(Danio rerio)已成为国际学术界应用最广的实验动物之一。为了保证斑马鱼的养殖健康和数据质量,实验室饲养斑马鱼的养殖管理和疾病控制己成为研究过程中一个不容忽视的重要环节。然而,目前关于斑马鱼健康状态的研究比较少,这在一定程度上限制了其在生命科学、健康科学、环境科学等各领域的推广应用,也不利于中国斑马鱼研究的快速发展。自2012 年国家斑马鱼资源中心(China Zebrafish Resource Center,CZRC)成立以来,该中心长期致力于提供斑马鱼健康养殖咨询服务,推广规范的养殖技术方案,在斑马鱼健康养殖及鱼病诊疗等方面积累了大量的数据和资料[1]。
“裂头病”为近年来国内斑马鱼鱼房中频繁出现、死亡率高的新型鱼病。“裂头病”过去在经济鱼类养殖中较为常见,主要出现在鲇形目的黄颡鱼(Pelteobagrus fulvidraco)和斑点叉尾鮰(Ictalurus punctatus)中,由爱德华氏菌属的细菌感染造成。但是关于该病致病机理尚不清晰,药物治疗效果有限,因此对其防治存在一定困难[2]。在斑马鱼鱼房中,美国的实验室分别于2013 年和2021 年报道过2 次,共计5 例“裂头病”相关病例[3-4]。在2018年之前,CZRC未收集到国内斑马鱼鱼房出现“裂头病”的病例信息。2018 年1 月,CZRC 首次收到国内斑马鱼鱼房出现“裂头病”相关症状的鱼病咨询。2019 年7 月,CZRC 首次收集到“裂头病”病鱼。此后,中国斑马鱼鱼房中陆续爆发多起裂头病感染事件。
本文对该病的病原进行了分离和鉴定,确认其为鮰爱德华氏菌。同时,根据近5年来CZRC收集到的鱼病数据,对国内斑马鱼鱼房各类常见疾病及特征进行分析,并给出相应的鱼房健康管理建议。
1 材料与方法
1.1 野生型斑马鱼
本文实验使用的野生型斑马鱼为Tübingen 品系。斑马鱼饲养按照《实验动物实验鱼质量控制》(GBT 39649-2020)进行养殖。
1.2 病原菌的分离培养
挑选表现出典型病症,头顶部位溃烂穿孔的“裂头病”病鱼个体(尚未死亡),安乐死后,用75%酒精擦拭全身消毒,在无菌操作台中取裸露脑组织于100µl PBS 无菌缓冲液中匀浆,4000 r/min离心15 s 后,取上清涂布于脑心浸液琼脂培养基(brian heart infusion medium,BHIA,青岛海博生物技术有限公司,货号:HB8478)平板,培养48 h,分离病原菌。
1.3 16S rDNA基因序列鉴定及进化树构建
使用DNA 提取试剂盒(天根生化科技有限公司,货号DP103)从纯化培养的分离菌株中提取细菌基因组DNA,作为PCR模板。16S rDNA序列扩增引物如下:27F,5'-GAGTTTGATCCTGGCTCAG-3'; 1492R, 5'-ACGGCTACCTTGTTACGACTT-3'。扩增条件:94℃预变性5 min,94℃30 s,55℃30 s,94℃90 s,30 个 循 环,94℃延 伸10 min,4℃保存。扩增产物经电泳检测后送公司测序。测序结果通过NCBI中Blast检索系统进行在线比对,选取与其同属的细菌16S rDNA 基因序列,用MEGA7软件构建系统发育树。选用邻位相连法(neighbor-joining)获得系统发育树,通过自举分析(bootstraping)进行系统进化树的评估自举数据集为1000次。
1.4 生理生化特性鉴定
选取14 种常见生化指标进行生化测定,按细菌生化鉴定管(青岛海博生物技术有限公司,货号SHBG08)的说明对分离菌株进行测定,按《常见细菌系统鉴定手册》进行鉴定。
1.5 回归感染试验
将体长2~3 cm的野生型斑马鱼40尾暂养1周,水温保持在27~28℃,未发现异常情况后,平均分成4组进行人工感染试验。将分离菌株的培养物用0.80%无菌生理盐水洗涤、重悬,麦氏比浊法稀 释 菌 液 至1.5×1010CFU/L、 1.5×109CFU/L、1.5×108CFU/L 浓度梯度。取以上3 个浓度的菌悬液,采用腹腔注射方式对斑马鱼进行腹腔注射,每组注射10 尾鱼,注射剂量为100µl/尾,同时设置生理盐水对照组,连续观察14 d,实验期间不投喂,每天观察记录死亡情况。
2 斑马鱼“裂头病”病原的分离与鉴定结果
2.1 “裂头病”在中国斑马鱼鱼房的发病趋势与分布
2018年之前,CZRC未收集到国内斑马鱼鱼房出现“裂头病”的病例信息。2018 年1 月,CZRC首次收到国内斑马鱼鱼房出现“裂头病”相关症状的鱼病咨询。2019年7月,CZRC首次在国内斑马鱼鱼房内收集到“裂头病”病鱼活体。之后相关发病数据和咨询数量逐年增加:2018 年收集发病信息1例,2019年收集发病信息4例,2020年收集发病信息8例,2021年收集发病信息11例。5年共收集“裂头病”发生信息24 例,分布于19 家斑马鱼鱼房,鱼房所在城市包括北京、上海、济南、杭州、武汉、西安、重庆、南宁、广州等地,无明显地理位置偏好。对发病鱼房进行的回访调查显示,发病鱼房间无明显的传播关系,即发病之前3 个月,无斑马鱼或相关生物样本的直接传递。“裂头病”的发病表现为,鱼房内短时间爆发大量斑马鱼死亡,发病后1周内,整体致死率从10%至60%不等。病鱼主要症状为体侧皮肤紫斑、鳃盖后部出血、头顶部出血溃烂、头顶穿孔,暴露整个脑组织等。病症首次发现后,如继续日常实验工作,不进行控制,则在鱼房内迅速传播,主要传播途径为接触式传染及摄入式传染,包括病鱼传染同缸其他鱼、病死鱼尸体被其他鱼啃食、病鱼与未染病鱼交配产卵、对未染病鱼使用了接触过病鱼且未消毒的渔捞和配种缸等。
2.2 病原的分离与纯化
从患病斑马鱼的脑组织分离获得一株优势菌落,在BHIA培养基经30℃、48 h培养后可形成灰白色、半透明、边缘光滑、圆形细小菌落(图1),选取其中1 株(E1)进行纯化培养,以方便后续鉴定。
2.3 细菌16S rDNA基因序列测定与进化树分析
菌株E1 进行16S rDNA 扩增后片段长度约为1400 bp。通过NCBI DNA数据库BLAST分析,结果显示,菌株E1 测序序列与GenBank 中鮰爱德华氏菌(Edwardsiella ictaluri)序列的16S rDNA 序列一致性为100.00%,而与迟缓爱德华氏菌(Edwardsiella tarda)序列的16S rDNA 序列一致性为99.65%。根据比对结果,构建系统发育树发现菌株E1与鮰爱德华氏菌序列聚为一类(图2)。
2.4 病原的生理生化鉴定
鮰爱德华氏菌和迟缓爱德华氏菌生理生化反应存在细微差别:鮰爱德华氏菌为爱德华氏菌中生化活性最低的1 个种,其不产生H2S,且吲哚反应为阴性,迟缓爱德华氏菌则二者均为阳性[5]。因此对菌株E1 的常规生理生化进行测定,根据《常见细菌系统鉴定手册》,菌株E1最终鉴定为鮰爱德华氏菌(表1)。
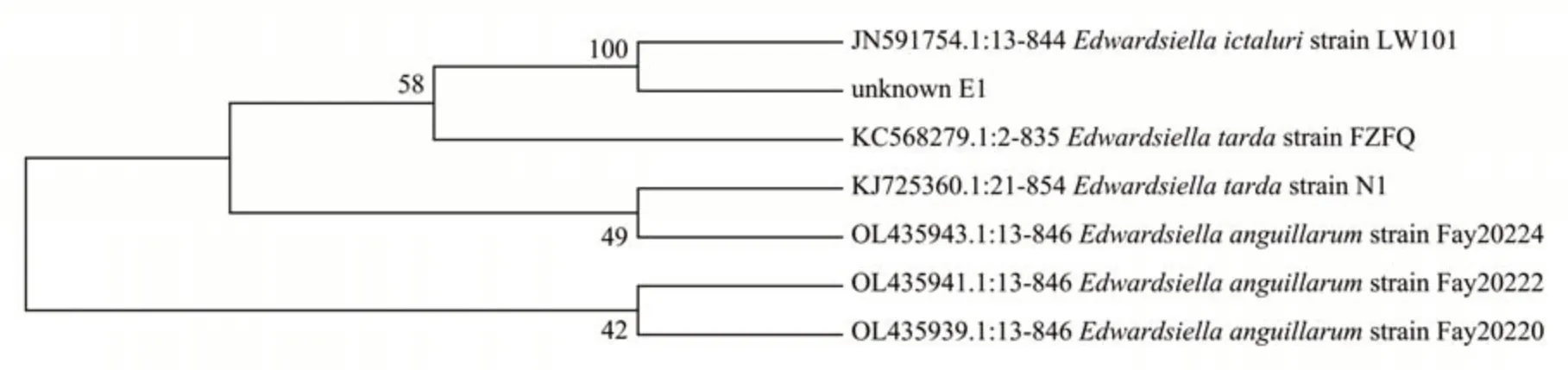
Fig.2 Phylogenetic tree of the 16S rDNA gene of isolated strain E1
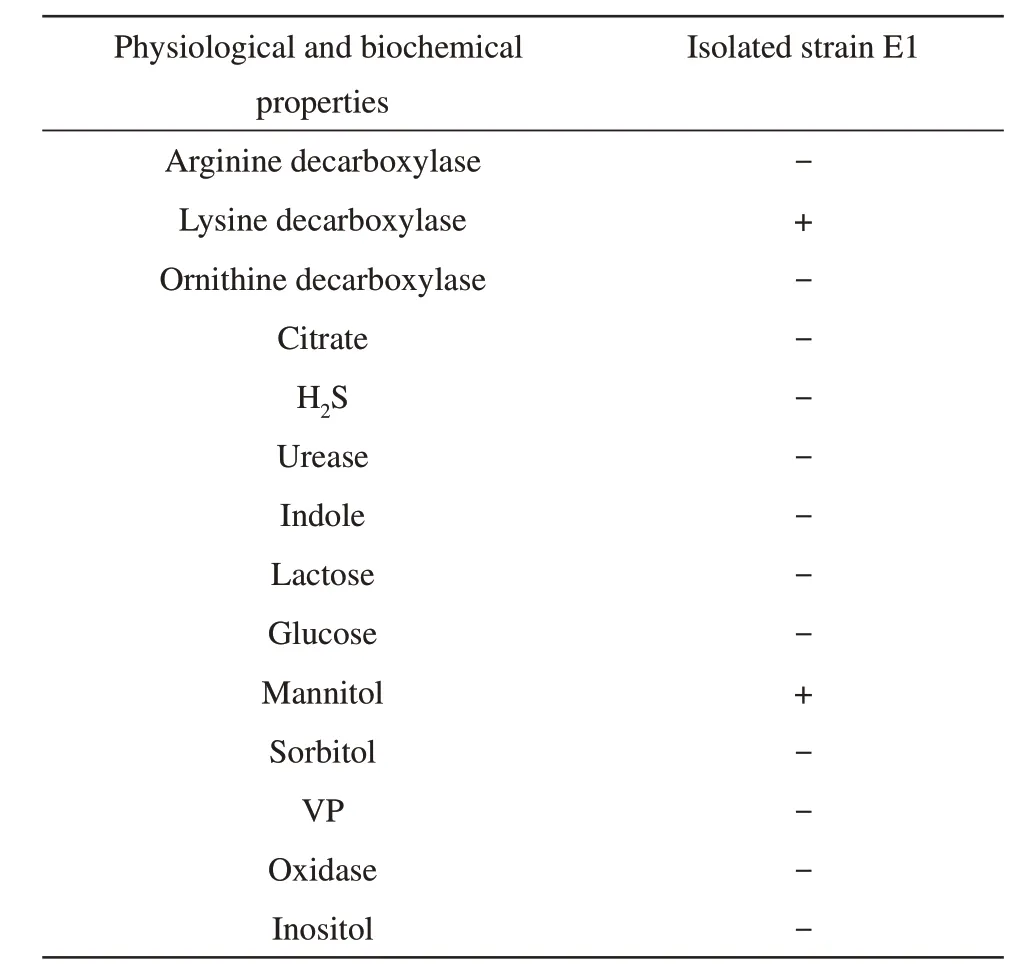
Table 1 Physiological and biochemical characteristics of isolated strain E1
2.5 回归感染试验
将分离到的E1菌株培养菌悬液,梯度稀释为3种浓度,分别对健康野生型斑马鱼进行腹腔注射,同时设置生理盐水注射作为对照,4组样品,每组10尾鱼。注射3个梯度的菌悬液试验组,在第2天陆续开始出现与自然发病相似的头顶出血、头顶骨溃烂至裸露整个脑组织(图3)等症状,观察14 d后死亡率达80%。对照组在观察14 d内,无死鱼出现,也无明显疾病症状。从人工感染后出现病症的病鱼身上再次分离的菌株,与原感染菌分子序列、生化特征完全相同,证实所分离的菌株E1,即鮰爱德华氏菌,为斑马鱼“裂头病”致病病原。

Fig.3 Natural infection and artificial infection of zebrafish“hole in the head”disease(a)Natural infection;(b)artificial infection;(c)negative control.
3 中国斑马鱼鱼房近5年鱼病分析
CZRC一直坚持为中国斑马鱼学界提供免费的鱼房健康和鱼病诊疗咨询,从而收集到大批斑马鱼鱼房病例信息。2017~2021 年CZRC 累计收集到来自全国65 家机构的78 个斑马鱼鱼房的鱼病病例121 例,发病数量逐年上升(图4a)。对这些病例的病症情况进行分析发现,主要病症依次为:体表出血(30 例)、溃疡(28 例)、头顶穿孔并出血(23 例)、竖鳞(18 例)、腹水(17 例)、异常瘦弱(8例)、鱼体有气泡(8例)、附有白毛(3例)、烂鳃(2例)、鱼鳍腐烂(1例)等。
分析发病原因发现,国内斑马鱼鱼房50.4%的鱼病是由于非生物因素直接或者间接导致的(图4b)。这些非生物因素主要是设备系统故障或实验操作不当引发水质问题,继而诱发鱼病。主要水质问题包括:pH 异常(19 例)、氨氮异常(13 例)、水温异常(8 例)、溶氧异常(8 例)、紫外灯损坏(5例)等。
在已知病原中细菌性病原最为常见,占比83.46%,真菌类病原占比2.47%,寄生虫类病原占比1.65%(图4b)。
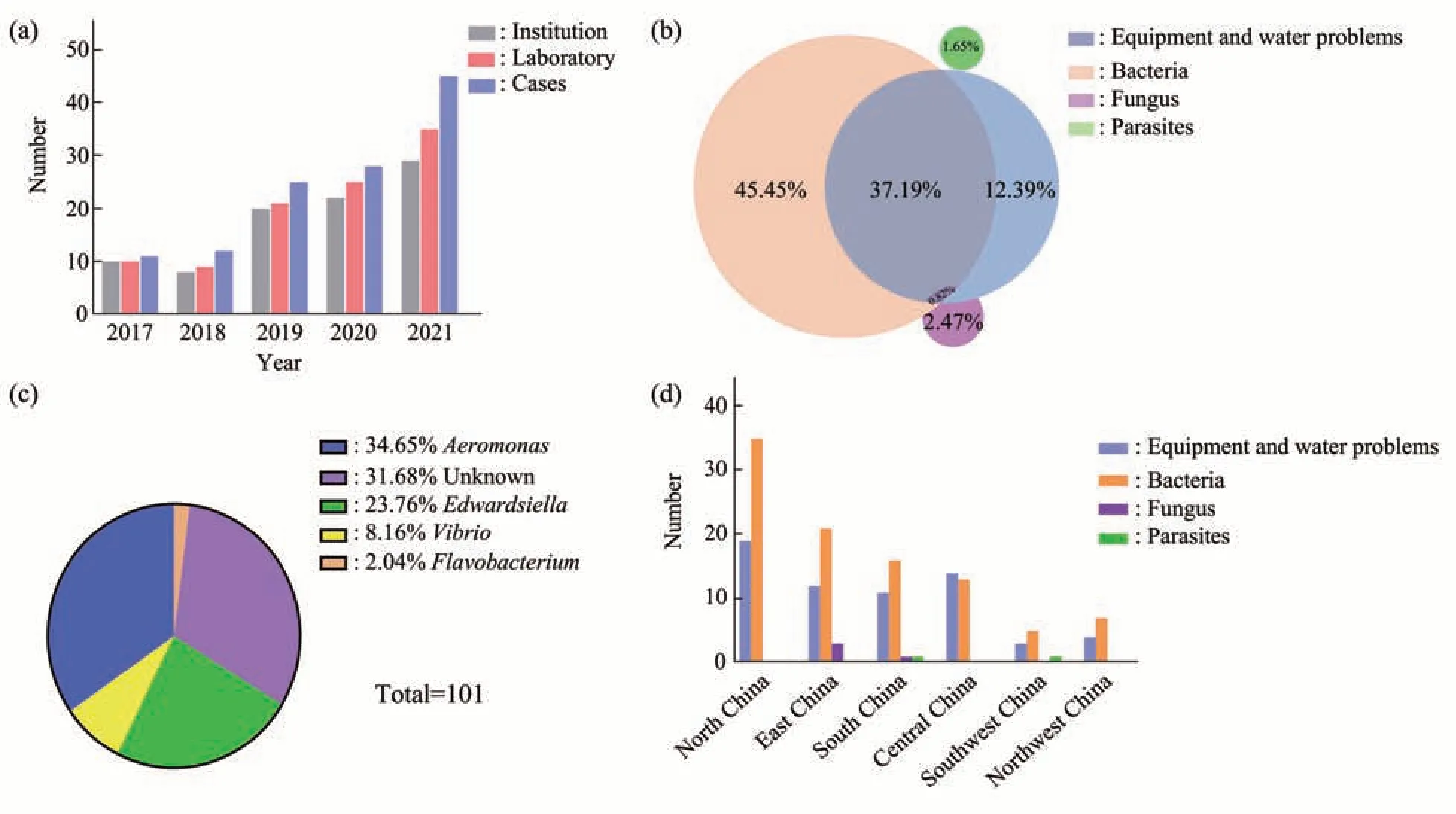
Fig.4 Statistical analysis of f zebrafish diseases in China(a) Statistics of consultation times for zebrafish disease; (b) statistics of the cause for zebrafish disease; (c) classification of bacterial pathogens in zebrafish;(d)statistics of etiology on regional characteristics.
在细菌性病原中,气单胞菌属占比34.65%,爱德华氏菌属占比23.76%,弧菌属占比8.16%,柱状黄杆菌属占比2.04%,而其他未知病原占比31.68%(图4c)。检出的气单胞菌属的病原主要为嗜水气单孢菌和温和气单胞菌,都是条件性致病菌。爱德华氏菌属的病原为鮰爱德华氏菌,也是条件性致病菌,但鮰爱德华氏菌感染导致的“裂头病”传播迅速,发病急,死亡率可超过50%[3-4]。
实验用斑马鱼生活在室内循环养殖系统内,一般条件下情况受外界气候环境影响较小,但是从目前掌握的数据来看,部分鱼病的发生存在一定的地理位置偏好性(图4d),其中真菌性疾病未在北方地区发现,而主要分布于长江流域及华南地区。
根据近5 年来CZRC 收集到的鱼病咨询数据,本文对国内斑马鱼鱼房各类常见疾病及特征进行分析。
3.1 细菌性疾病
3.1.1 气单胞菌属细菌感染
气单胞菌属为国内斑马鱼鱼房最常见病原,2017~2021 年在28 家斑马鱼鱼房内发现34 例。其中以致病性嗜水气单胞菌(Aeromonas hydrophila)为最主要致病菌,它也是人畜水产动物共患病病原菌[6-8]。病原可通过受损的皮肤或鳃进入体内导致鱼体表、鳃丝、眼眶严重充血发红,腹部及身体两侧呈点状或斑状充血,鳍基充血发红,严重病鱼肌肉充血,眼球突出,部分或全部鳞片张开竖起似松果状,造成竖鳞病(图5a)及细菌性败血症(图5b)等[9-10]。该属病原都属于条件行致病菌,鱼发病多为病原、体表损伤和环境因素共同作用的结果[9]。该病的初步诊断可以通过观察外观出血情况进行判断,确诊则需要分离病原菌,参照《致病性嗜水气单胞菌检验方法》(GB/T 18652-2002)进行。保持良好的水质和合理的养殖密度可有效预防致病性嗜水气单胞菌感染,室内养殖斑马鱼中尽量避免鱼体损伤,保存良好水质对于该病的早期预防具有重要意义。采用卡那霉素、庆大霉素等药物进行药浴治疗具有一定的疗效[9]。
3.1.2 鮰爱德华氏菌感染
在细菌性病原中,鮰爱德华氏菌为出现频次第二的常见病原,2018 年以来在19 家斑马鱼鱼房内发现24 例。病鱼表现为食欲减退、游动迟缓,严重时头朝上尾垂直向下悬浮,受到刺激时不停地快速旋转或不规则游动;鱼体腹部膨大,口腔、下颌、眼眶、鳃盖、肛门及鳍条基部等部位明显充血、出血,头顶正中部位皮下发红,头背部颅侧皮肤坏死、溃烂,病情严重的头骨裂开暴露出脑组织[4](图3a)。该菌感染途径有2 个:a.经鼻孔侵入嗅神经,然后进入脑内,最后侵害颅骨和皮肤;b.经肠壁进入血液引起败血症[3]。CZRC病原调查结果显示,鮰爱德华菌感染近两年来在国内多家斑马鱼实验室内爆发,传播迅速,死亡率高达50%,造成损失巨大;感染存活下来的斑马鱼依旧可以携带病原,其粪便经由水进入健康鱼体,或者通过摄食已感染鱼尸体而传染给其他健康鱼类造成第二次该类鱼病爆发[12]。国内斑马鱼中分离出的鮰爱德华氏菌与其同属的其他菌在16S rDNAs 上差别不大,但因该菌为爱德华菌中生化活性最低的1 个种,不能产生吲哚和H2S,该属其他菌可产生吲哚和H2S,故鮰爱德华氏菌的鉴定方法推荐以传统的生化分离鉴定为主,分子鉴定为辅。关于特异性鉴定鮰爱德华氏菌的方法还有待进一步开发。关于该病的防治,建议遵循“以防为主”的方针,即保持良好的养殖内外环境,严格卫生管理,提高养殖斑马鱼的免疫力,做好外来鱼的隔离,切断一切可能的传播途径。再者,一旦鱼房内出现鮰爱德华氏菌感染要及时捞出,所在缸内鱼建议全部处死,所有接触过病/死鱼的渔具需全部消毒处理;如因研究需要无法全部处死同缸内其他鱼,可考虑静水养殖2~3 d,减少应激降低死亡率。
3.1.3 柱状黄杆菌感染
几乎所有的淡水鱼类均对柱状黄杆菌(Flavobacterium cloumnare)敏感[12-13],在国内斑马鱼鱼房内目前出现次数不多,仅发现2例,但造成的死亡率约30%。该病原感染斑马鱼体后体表部分区域体色变浅(图5c),体表、鳍条、鳃丝腐烂,鳃盖骨内表皮充血[12]。柱状黄杆菌检测先分离出病原菌,然后参照2007 年Panangala 等[14]建立的一种多重PCR 方法进行确认。预防该病的方法是避免养殖密度过高,保证良好水质,避免鱼体损伤[15]。药物治疗方面,Bowker 等[16]研究显示6~15 mg/L 氯胺T 重复浸泡可以治愈感染柱状黄杆菌的鳜鱼,但该药物尚未在斑马鱼验证。
3.2 寄生虫类疾病
3.2.1 微孢子虫感染
噬神经微孢子虫(Pseudoloma neurophilia)为专性细胞内寄生真核生物,有报道该病原普遍存在于斑马鱼鱼房内[17]。该病原通常寄生于斑马鱼脑、脊髓等部位,一般感染后无明显外观症状,发病严重的斑马鱼表现异常瘦弱,无光泽,脊柱弯曲(图6a)[18]。噬神经微孢子虫感染会影响斑马鱼生长繁殖[19],对神经生物学及骨骼发育生物学方面的研究存在干扰[20-21]。该病原诊断可以参照Whipps等[18]发表的微孢子虫PCR分子检测方法,利用扩增引物Pn18S5F和Pn18S5R对病鱼脑部组织微孢子虫进行检测。噬神经微孢子虫的孢子体对消毒剂有抗药性,Ferguson 等[18]发现斑马鱼设施常规使用50 ppm 的次氯酸钠消毒胚胎10 min 仍无法有效杀死其孢子体。因此,建议目前对斑马鱼养殖系统内微孢子虫感染以预防为主,主要集中在对养殖水的紫外灯照度(照度大于30000 μw·s/cm2)进行控制[22],此外引进鱼的隔离和胚胎消毒也是目前阻断微孢子虫传播的一项重要措施。

Fig.5 Bacterial diseases in zebrafish(white arrows point to typical symptom)(a) Scale protrusion; (b) bacterial septicemia; (c) gliding bacteria disease.
3.2.2 毛细线虫感染
病 原 为 毛 细 线 虫 (Pseudocapillaria tomentosa),雌虫全长7~12 mm,雄虫全长4~7 mm,虫体大小肉眼可见[10],是国内鱼房检出过的主要寄生虫病原,过去5 年内有2 家斑马鱼鱼房内出现过线虫感染。病鱼主要表现为体表发黑、游动缓慢、瘦弱、剖检可见虫卵或者虫体。该病原主要寄生在斑马鱼的肠壁黏膜层,破坏组织,从而引起肠壁发炎[23],因此病原诊断以肠道内剖检或HE染色见到虫体或虫卵为据或者以分子方法在养殖环境或者鱼组织内检出虫体DNA为据[24]。毛细线虫可以采用三氯杀螨酮和甲苯咪唑的混合物进行有效治疗[25]。在毛细线虫的防控方面,建议要严格控制中间宿主寡毛纲蠕虫,例如水蚯蚓等进入循环养殖系统内,鱼卵表面消毒到位。
3.3 真菌类疾病
水霉菌(Saprolegnia)为国内斑马鱼房内出现的主要真菌感染病原,2017~2021 年,CZRC 共发现有3家实验室出现过水霉感染。一般情况下,水霉在水体中广泛存在,并不对鱼的健康造成危害,但当鱼体表受伤时,水霉菌孢子体可粘在伤口处,在鱼体表面繁殖,导致鱼或鱼卵感染[10],大量菌丝的附着可能增加鱼体负担,使鱼游动迟缓,食欲减退,最终瘦弱而死。而在胚胎孵化过程中,该病也常发生,其菌丝黏附在卵上然后穿透卵膜引起卵死亡,又称卵丝病[10]。斑马鱼感染后常可见鱼体表覆盖一层白色棉花状的絮状物(图6b)。由于水霉病的发生主要与体表受伤密切相关,对该病的预防主要是避免鱼体受伤,鱼卵养殖密度不可太高,防止氧气不够窒息死亡感染水霉后再危及其他健康鱼卵[9]。在斑马鱼水霉病防治方面发现,患病早期用2.5 mg/L的亚甲基蓝浸泡有一定作用。
3.4 水质因素引起的中毒
3.4.1 气体中毒
当水中总的溶解气体或是氮气过饱和都可引起鱼类气体中毒,俗称气泡病[26-28],该病是国内斑马鱼鱼房内已知出现的发病最急、死亡率最高的一种疾病。2017~2021 年,气体中毒事件共在8 家使用自动化循环系统的斑马鱼鱼房内发生过,造成的死亡率高达80%。气泡病可分为急性气泡病和慢性气泡病。急性气泡病可见鱼鳃、背鳍、胸鳍、腹鳍等部位有无法消除的小气泡(图6c),同时还会造成下颌及鳃盖基部充血,突眼;急性气泡病多数发病快,难以控制,造成损失严重[29-31]。而慢性气泡病则表现为肠道出现气泡[28],一般造成的死亡量较小,但随之而来会有继发性感染影响鱼的健康[32]。斑马鱼鱼房内,气泡病的主要发生原因为增氧泵故障、循环系统溶氧探头故障、人为操作不当等。最终管道内积压多余气体使系统水气体过饱和,这些过饱和部分气体游离出来,在水中形成微小气泡,气泡在鱼鳃部阻塞血液循环从而影响鳃部的生理功能,造成斑马鱼急性死亡;或者导致斑马鱼机体生理功能受到影响后免疫力降低,容易产生继发性感染,进而导致斑马鱼大批量出现烂身、溃疡、烂鳃、水霉、甚至死亡[26]。鱼房内气泡病应以预防为主,宜实时监测水体含氧量并设立自动报警,应定期检修增氧泵、溶氧探头、进水管等元器件,应严格按照规范操作更换循环系统的过滤耗材,应严格控制进入循环系统的水温,不可相差太大。一旦发现有鱼出现气泡病症时,应立即关闭增氧泵,排出系统水,同时注入温度较低的水,在系统内加入适量海盐也可以改变鱼体皮肤渗透压,使患病鱼体内的气泡逸出体外从而在一定程度上缓解气泡病。
3.4.2 氨氮中毒
养殖水体中的氨氮主要以两种存在形式:非离子氨(NH3)和离子氨(NH4+)。其中,NH3对所有养殖动物均具有致毒性,而离子氨的毒性较小或无毒;通常所说的氨氮中毒主要是指NH3超标引起的鱼病。过去5 年内,CZRC 供收集到国内斑马鱼鱼房发生的13 例氨氮异常死鱼事件。氨氮中毒的斑马鱼体表发红、鳃发暗红、鳃丝肿胀、呼吸急促、四处游窜[33],常见皮肤溃烂(图6d)。由于非离子氨不带电荷,容易穿透脂质性生物膜的疏水性微孔进入生物体内,可对鱼类造成诸多不利的影响,例如损伤鱼类的鳃组织,导致组织充血,影响气体交换,呼吸下降导致个体缺氧[34-36]。斑马鱼氨氮中毒现象多见于长途运输后进入新循环养殖系统的情况,或发生于硝化菌群失衡的养殖系统内。日常管理中,需定期监控养殖水体NH3的含量,一旦发现系统氨氮含量超标,应立即增大系统换水量,加入硝化细菌有助于重建和稳定水处理系统中硝化菌群,平衡氨氮含量。

Fig.6 Parasites disease,fungi disease,water quality caused problems in zebrafish(white arrows point to typical symptom)(a)Microsporidiosis;(b)saprolegniasis;(c)gas bubble disease;(d)ammonia toxicity.
4 讨论
中国的斑马鱼研究在近10 年来取得突飞猛进的发展,越来越多的实验室建立斑马鱼鱼房。与之相随,鱼病病例数量也逐渐增加。国内鱼房近5年的鱼病咨询数目急剧增长,其中细菌性感染最多。在细菌性感染案例中,约38%是由于设备维护不当导致水质(pH、氨氮、水温、溶氧)或紫外灯杀菌功能异常引起继发性细菌感染死鱼,此外单纯由设备维护不当,造成水质问题引起的死鱼也占比12.39%。因此对自动化循环养殖设备进行定期维护,对于斑马鱼健康养殖十分重要。在可追溯病原的鱼病病例中,细菌类疾病占比83.6%,这很可能是因为斑马鱼并非生活在一个无菌的环境下,养殖水体、饲料、粪便排泄物及室内空气均存在有很多细菌,这些细菌在特定因素下可以变成病原感染斑马鱼造成鱼病。与之相对,自动化循环可控过滤养殖系统及严格的鱼卵消毒措施,在一定程度上可有效减少生活环境中寄生虫类病原的影响,因此寄生虫类疾病仅占比1.7%。
“裂头病”斑马鱼是近几年国内斑马鱼鱼房内出现的一种新型鱼病,其发病急、传播快、死亡率高,本文通过对“裂头病”病原进行分离和鉴定,最终确定该病原为鮰爱德华氏菌。在收集到的鱼病数据中发现,从2018 年起有18 家斑马鱼鱼房共累计出现24次(2018年1例、2019年4例、2020年8例、2021 年11 例)鮰爱德华氏菌的感染,总发病数目呈逐年增加的趋势。然而,这些鱼房之间也缺少具有明确关联性传播链,因此怀疑该病原是某种环境因素引入,后续将做进一步追踪研究。在这些病例中也发现,该病原可通过鱼体接触传播或吞食传播;也可以通过接触过病鱼且未消毒的渔捞和配种缸等养殖器皿传播。一些常见的抗菌药物无法有效控制住病情。同时还发现,该病征首次出现后,如不进行人为控制(如卫生管理和隔离措施),该病会在鱼房内迅速传播导致高死亡率,发病2周左右,整体死亡率逐渐降低,但在3~6个月之后,该病往往又卷土重来。因此,严格的鱼房卫生管理和隔离措施被认为是目前最有效控制鮰爱德华氏菌的手段。
实验室饲养的斑马鱼大多数时候生活于流动的水体,其活动不易被察觉,病鱼往往无法被及时发现,即使发现也治疗困难。因此日常斑马鱼鱼房的工作中,需要牢固树立“防重于治”的思想,尽量完善并落实日常环境卫生及设备管理制度,把日常巡视、设备维护和水质监控作为维系鱼房健康必不可少的重点工作。尽管2020 年《实验鱼质量控制标准》(GB∕T 39649-2020)对实验用斑马鱼养殖环境、遗传质量、病原检疫等几个方面进行规范,但整体而言,斑马鱼研究领域尚缺乏一套斑马鱼鱼病诊断、鱼房健康及日常管理操作的详细标准与规范。本文通过总结CZRC在日常工作实践中收集到的各类健康养殖问题,对一些常见斑马鱼疾病给出了在实验室目前所知的切实可行的诊断、预防或者治疗方案,为今后疾病的诊断和防治提供一定的依据和参考,预期更好的服务于斑马鱼科学家和科研工作。
5 结论
本文对“裂头病”的病原进行了分离和鉴定,并根据近5年来CZRC收集到的鱼病数据,对国内斑马鱼鱼房中出现的各类常见疾病及特征进行分析。结果发现:“裂头病”病原为鮰爱德华氏菌;斑马鱼疾病发病率最高的为细菌性疾病,近一半斑马鱼健康问题是由非生物因素直接或者间接导致的,致死率最高的情况是气体中毒。这为斑马鱼房健康管理提供了重要的参考数据,有力地证明了设备良好运转、水质优良稳定是保证斑马鱼健康的重要前提,严格的鱼房日常卫生管理是防止鱼病发生的主要手段,细菌性疾病的预防是斑马鱼养殖的重中之重。
