Cystatin C敲除诱导的长爪沙鼠抑郁模型*
2022-05-23王诗媛胡彩姣吕建祎欣李长龙霍学云陈振文杜小燕
伍 颖 王诗媛 胡彩姣 朱 筱 郭 萌 吕建祎 刘 欣李长龙 霍学云 陈振文 杜小燕**
(1)首都医科大学基础医学院,北京 100069;2)首都医科大学北京宣武医院,北京 100053)

长爪沙鼠(Meriones unguiculatus),被广泛地应用于脑神经、寄生虫病、微生物、生殖、内分泌、营养、代谢、肿瘤、癫痫、听觉和焦虑等诸多研究领域,被称为“多功能”实验动物。
溶酶体半胱氨酸蛋白酶内源性抑制剂Cystatin C(CysC 或CST3)属于半胱氨酸蛋白酶抑制剂2型胱抑素超家族[1],由位于第20 号染色体短臂(20pl1.21)的CST3基因编码,在多种组织中表达[2]。CysC 具有调节细胞增殖[3-4]、分化[5]、迁移[6]、神经保护[7]等多种生理功能。研究显示,CysC 的表达水平在阿尔茨海默病、肌萎缩侧索硬化[8]、帕金森病(PD)[9]等神经退行性疾病和脑缺血[7]中发生不同程度的改变,例如CysC通过减少淀粉样蛋白β原纤维的沉积在阿尔茨海默病中表现出神经保护作用[10]。然而,CysC对神经行为的影响作用很大程度上仍然未知。
CysC 在大脑的平滑肌细胞、星形胶质细胞、小胶质细胞和血管内皮细胞中均有表达[11]。越来越多的证据表明,CysC 通过减少神经元细胞损伤发挥脑保护功能。CysC 可作为组织蛋白酶抑制剂减少脑缺血后的海马神经元损伤[12],还可以通过内体途径预防唐氏综合症小鼠模型的神经元丢失和行为缺陷[13]。研究发现,调节血管性痴呆大鼠损伤区血管形成[14]或减轻脑内皮细胞的氧化损伤和炎症水平[15]等保护血管细胞免受损伤也是改善神经行为的重要途径。最近的报道提示,CysC 外泌体对饥饿诱导下的CysC 敲除(CysC-KO)皮质平滑肌细胞和皮质神经元有保护作用[16]。此外,CysC还与PD小鼠和细胞模型中的血管生成以及通过血管内皮生长因子(VEGF)诱导血管生成从而提高神经-血管单元中的神经元自噬有关[17]。本课题组此前也发现CysC可能通过VEGFA参与血管生成过程[18]。但在缺氧、炎症等病理条件下CysC对内皮细胞和神经元的作用尚不清楚,推测CysC 的神经保护作用可能是通过提高内皮细胞和神经元细胞的活力来实现。
长爪沙鼠作为实验动物广泛应用于多个研究领域[19],是公认的脑缺血理想模型动物之一[20]。在认知行为研究中,Varty等[21]发现长爪沙鼠可用于测试具有潜在作用的抗焦虑药和抗抑郁药。另有研究表明,长爪沙鼠是利用强迫游泳试验(FST)评估抗抑郁化合物的理想动物[22]。通过7 种行为学测试长爪沙鼠基本行为特征的结果也证明,该动物可作为焦虑和恐惧领域的大脑行为研究工具[19]。本课题组前期利用CRISPR/Cas9基因组编辑技术成功建立了CysC 敲除(CysC-KO)长爪沙鼠,并发现CysC 缺失加剧了脑缺血模型长爪沙鼠缺血后脑损伤,提示CysC 可能参与脑缺血后血管和神经细胞的修复[23]。本研究通过评估CysC-KO 长爪沙鼠的神经行为建立抑郁模型以及观察CysC 在模拟病理条件下对HUVEC和N2a细胞活力的影响,以及阐明CysC在神经行为异常发生中的作用机制。
1 材料与方法
1.1 实验动物
本研究共使用29 只清洁级长爪沙鼠,分别为15只野生型(8只雄性,7只雌性)和8只CysC-KO纯合子(5 只雄性,3 只雌性)进行行为学测试;野生型和CysC-KO 纯合子各3 只(3 月龄,雄性2只,雌性1 只)进行qPCR 检测。动物饲养于干净的半透明塑料笼中,每笼不超过5 只,温度为(25±1)℃,湿度为55%~65%。环境安静,动物自由采食。动物实验经首都医科大学科学与伦理委员会批准(许可编号AEEI-2017-032)。
1.2 qPCR
采用Trizol法(Invitrogen,USA)提取组织总RNA,天根KR106-01 FastQuant cDNA第一链合成试剂盒(北京天根)进行逆转录,使用FastQuant RT 试剂盒(北京天根) 根据试剂盒说明进行qPCR。根据自行克隆的长爪沙鼠的CysC序列,采用Primer Premier 5.0 设计PCR 引物。正向引物序列:5'-CACGTGTACCAAGACCCAGC-3',反向引物 序 列: 5'-TTTCGACAAGGTCATTGTGCC-3'。qPCR 由Bio-rad CFX96 系统按照前期运行程序进行[24]。
1.3 旷场实验(open field test,OPT)
50 cm×50 cm×30 cm(长×宽×高)的方向箱体为旷场。在旷场中央划分一个边长16 cm的正方形作为中央区,其余为边缘区。动物放置于中央区域后,观察记录5 min。通过计算机视频跟踪系统(Ethovision XT)记录动物的运动速度、中央区运动时间、边缘区运动时间、进入中央区次数。
1.4 糖水偏好测试(sugar preference test,SPT)
糖水偏好测试(SPT)按照前期描述进行[19]。简言之,将动物单独饲养,并在测试前训练24 h。在剥夺水和食物15 h后,每个单独的笼子同时提供称重的蔗糖溶液(1%)和水各1 瓶。测试持续10 h,5 h 后交换瓶子位置。蔗糖偏好度定义为:糖水偏爱=糖水消耗/总液体消耗×100%[19]。
1.5 社交交互(social interaction,SI)
社交交互(也称为三箱社交)用于评估动物的自闭行为、社交能力和沟通能力。本文应用的箱体大小和实验条件与前期研究完全相同,该条件已被证实适用于长爪沙鼠行为评估[19]。
1.6 明暗箱(dark/light box)
明暗箱是通过测试动物的暗特性(趋于黑箱)和探索特征(趋于白箱)来研究自发探索行为。在明暗箱(45 cm×27 cm×27 cm)中,暗箱占2/3,明箱占1/3。盒子被灯光覆盖和照亮。两个盒子之间的隔板有一个7.5 cm×7.5 cm 的门供动物通过。将动物置于白箱上方,并在设备上方安装摄像系统,记录5 min 内动物通过明/暗箱的次数和在明/暗箱内停留的时间。
1.7 新物体识别(novel object recognition,NOR)
新物体识别根据啮齿动物的易感性评估其记忆能力。粉色球作为熟悉物体(FO),白色高尔夫球被作为新物体(NO)。实验在22 cm×22 cm×25 cm丙烯酸箱中进行。第一天为适应阶段,沙鼠在箱体中自由探索10 min。第二天为获得性阶段,沙鼠在5 min内自由探索两个相同的FO。1~24 h后为测试阶段,其中一个FO 被NO 取代,动物自由探索这两个物体5 min,并进行录像。记录和分析FO 或NO 的探索时间。偏好指数(PI)根据以下公式计算:PI=NO/(NO+FO)×100%。
1.8 细胞培养
人脐静脉内皮细胞(HUVECs)用RPMI-1640(Vistech,VM-2101BM)培养基、人动脉平滑肌细胞(HASMC)和小鼠神经母细胞瘤细胞(N2a)用DMEM(Vistech,VM-1101BM)培养基。完全培养基中含有10%胎牛血清(FBS)和1%青霉素链霉素。所有细胞均培养于37℃,5%CO2加湿培养箱中。
1.9 缺氧&饥饿(H&S) 和氧葡萄糖剥夺(OGD)处理
将对数期的HUVEC或N2a细胞定量到1×107/L,随后轻轻吹打混匀,取200 μl 加入96 孔板(细胞浓度2000/孔)。细胞在培养箱中生长贴壁4 h 后,分别用含有CysC(Solarbio,P00229)或CysC 抑制剂(Abgent,P01034)(200 μg/L) 或等体积PBS 的完全培养基处理细胞,然后将96 孔板置于混合气体(85%N2/10%CO2/5%O2)的低氧培养箱中培养24 h。对于N2a,接种贴壁培养4 h 后,用含CysC 或CysC 抑制剂(50 μg/L)或等体积PBS的无血清(用于H&S)或无葡萄糖(用于OGD)培养基替换正常培养基24 h,然后将板放入缺氧培养箱中2 h,MTT法检测细胞活力。
1.10 炎症刺激
将HUVEC和N2a细胞接种于96孔板(细胞浓度2000/孔),置于培养箱生长贴壁4 h。然后将培养基改为含有TNF-α或LPS(100 mg/L)的完全培养基。同时,分别加入浓度为200 μg/L 的CysC 或CysC 抑制剂,以PBS 作为对照。培养24 h 后,MTT法检测细胞活力。
1.11 MTT法
用于测定细胞活力。HUVEC 或N2a 细胞在处理结束时,向每个孔中添加MTT 培养基溶液,反应4 h 后,除去液体并用DMSO 溶解细胞20 min,使用Multiskan MK3 微孔板读数器(Thermo Fisher Scientific,USA) 在490 nm 处测量吸光度(A)值。将HASMC(4×106个/L)接种在96孔板中,然后用梯度浓度(100 μg/L、200 μg/L、400 μg/L、800 μg/L)的CysC及其抑制剂处理12 h。在处理结束时,按照上述步骤测量A值。
1.12 统计
所有统计分析均使用SPSS Statistic 16.0 进行。通过参数独立样本t检验和单因素方差分析分析数据。数据显示为平均值±SEM,以P<0.05表示差异有统计学意义。
2 结果
2.1 CysC缺失对沙鼠行为的影响
本研究首先使用qPCR检测CysC-KO长爪沙鼠不同组织中CysC 的表达水平。qPCR 检测结果显示,CysC-/-长爪沙鼠脑、肝、胃、肾和胰腺等器官组织中CysC mRNA 水平显著低于野生型(图1),提示CRISPR/Cas9 方法成功构建CysC-/-长爪沙鼠。
为了探究敲除CysC对长爪沙鼠行为学的影响,在CysC-KO野生型(WT)和纯合子(CysC-/-)长爪沙鼠青年(3~5月龄)、中年(10~12月龄)和老年(30~32月龄)阶段分别进行了一系列测试。首先用旷场实验检测动物的运动、探索行为,研究发现老年CysC-/-长爪沙鼠在旷场中央区活动时间和进入中央区的频率显著低于WT(图2a,b),说明CysC 敲除长爪沙鼠在老年期间表现出探索欲望降低和抑郁样行为。接着用蔗糖偏好测试评估了实验动物的抑郁样行为,结果显示,各年龄段CysC-/-组的蔗糖偏好(%)均低于对照组(WT),尤其中年阶段差异显著(图2c)。此外,还利用新物体识别实验检测了长爪沙鼠的学习、探索和记忆能力,得到与糖水偏好实验相同的趋势,即CysC-/-组长爪沙鼠对新物体的偏好度有所降低(图2d)。这些结果表明,CysC-KO 可诱导长爪沙鼠出现抑郁样行为,提示CysC参与神经行为异常的发生。
社交行为障碍出现在许多精神退行性疾病中,例如抑郁症、自闭症和精神分裂症。使用三箱社交评估青年、中年和老年WT和CysC-/-长爪沙鼠的社交行为。在社会新奇实验中:相对于WT,青年时期的CysC-/-长爪沙鼠在陌生鼠箱停留时间和与陌生鼠接触的时间均显著降低;而中年时期的CysC-/-长爪沙鼠在进入陌生鼠箱中的次数和进入陌生鼠箱中停留的时间显著低于WT;老年时期,CysC-/-长爪沙鼠进入陌生鼠箱中的次数仍显著低于WT(图2e~g)。还进行了明暗箱实验的测试,数据表明不同年龄阶段的WT和CysC-/-长爪沙鼠在明暗箱中的各项指标没有显著差异(附件图S1)。
2.2 H&S或炎症条件下CysC对HUVEC的保护作用
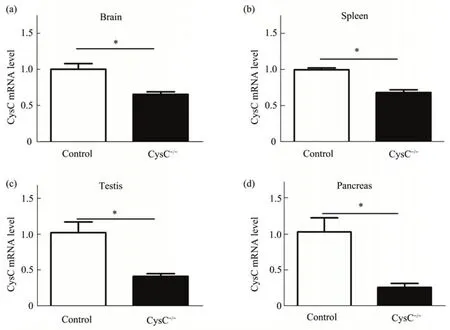
Fig.1 CysC mRNA expression level is decreased in different tissues of gerbilsComperred with the wild type (Control), the mRNA level in CysC knockout homozygous (CysC-/-) gerbils’ brain (a), spleen (b), testis (c) and pancreas (d) were dramatically downregulated when quantified by qPCR. Those results demostrated that CysC was successfully knocked out in different tissues of CysC-/-gerbils.Statistical analysis was performed by t-test,n=3,*P<0.05.
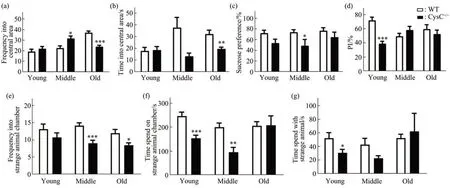
Fig.2 CysC knockout induces depression-like behavior in gerbils at different agesBehavioral tests were performed in wild-type(WT,n=15)and homozygous(CysC-/-,n=8)gerbils aged 3-5 months(young),10-12 months(middle)and 30-32 months(old),respectively.In the open field test(OFT),the frequency(a)and time(b)of WT&CysC-/-gerbil entering into the central area were detected.The frequency and time of CysC-/- gerbil entering into the central area were significantly lower than WT in old gerbil. In the sucrose preference test (SPT), the sucrose preference of middle CysC-/- gerbils was significantly lower than that of WT (c). In the novel object recognition test,the preference index(PI%)to new object of young CysC-/-gerbils was significantly lower than WT(d).In the social novelty preference test,the frequency into strange animal chamber(e),the time spent on strange animal chamber(f),and the time with strange animal(g)of CysC-/-gerbils were significantly lower than that of WT in different periods.Statistical analysis was performed by t-test,*P<0.05,**P<0.01,***P<0.001.
为了探索CysC-KO 神经行为异常的原因,检测了CysC对血管细胞和神经细胞的影响。用CysC或其抑制剂处理HUVEC 后MTT 检测的结果表明,外源CysC 可有效促进HUVEC 增殖(图3a),而CysC抑制剂显著抑制HUVEC增殖(图3b)。基于这一结果,本文探讨了CysC 在病理条件下(H&S或炎症刺激)对HUVEC细胞活性的影响。在H&S或TNF-α 条件下用外源CysC 或其抑制剂处理HUVEC 后发现,H&S 或TNF-α 显著抑制HUVEC活力,而外源CysC 可以解除该抑制作用(图3c,d)。上述结果表明,CysC可显著降低由H&S或炎症处理引起的内皮细胞损伤。
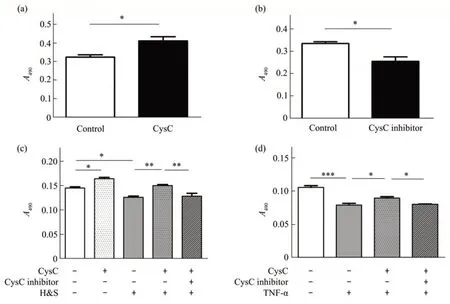
Fig.3 Protective effect of CysC to HUVECCysC (200 µg/L) (a) improved, or CysC inhibitor (200 µg/L) (b) decreased proliferation of HUVEC. HUVEC was treated by H&S condition (c) or TNF-α (100 mg/L) for 24 h (d), and CysC showed protective effect whereas CysC inhibitor displayed converse effect. Cell activity of HUVEC was measured by MTT assay.A490 are means±SD,with statistical analysis by t-test or one way ANOVA.*P<0.05,**P<0.01,***P<0.001.
2.3 CysC提高氧糖剥夺或炎症条件下神经元细胞的细胞活力
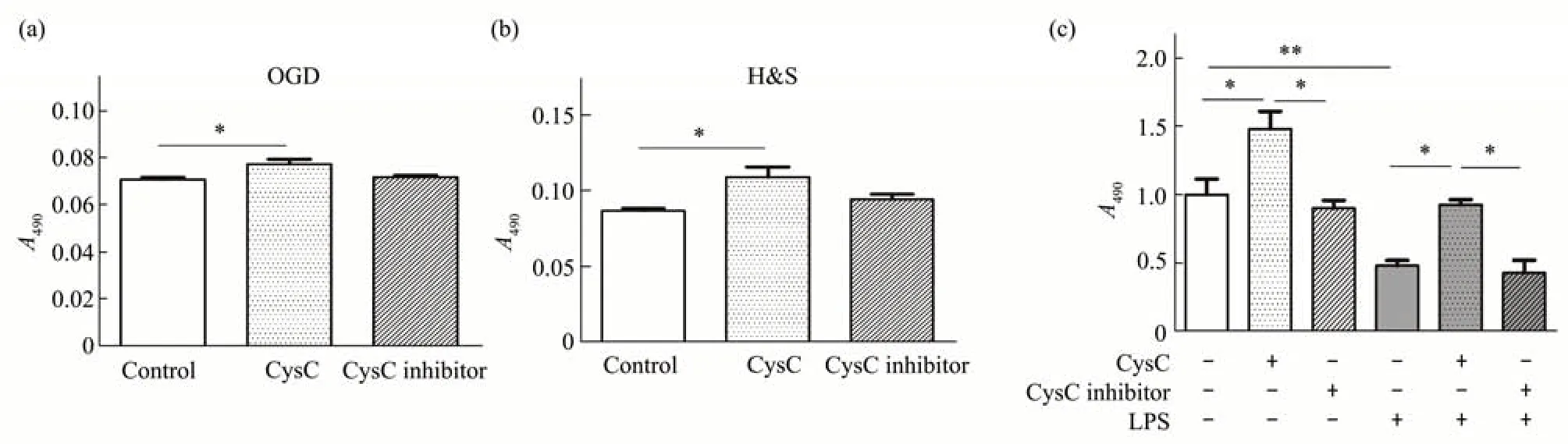
Fig.4 Protective effect of CysC to N2aN2a cells were treated with PBS,CysC(50µg/L)and CysC inhibitor(50µg/L)respectively for 36 h under OGD(a)or H&S(b)2 h treatment,or 6 hstimulating with LPS (100 mg/L) (c). CysC harbored significant protection on N2a cell viability tested by MTT assay. A490 are means±SD, with statistical analysis by one way ANOVA.*P<0.05,**P<0.01.
缺氧、营养缺乏和炎症是多种行为异常疾病中神经元细胞的常见病理状态。因此,本文研究了在H&S、OGD或LPS诱导下CysC对N2a细胞活力的影响。结果表明在H&S 环境下,N2a 的增殖显著减少,而CysC可逆转由H&S引起的增殖抑制,但CysC 抑制剂无效(图4a)。在OGD 条件下也观察到类似结果(图4b)。由图4c可知,正常培养条件下CysC 可显著增加N2a 细胞的增殖能力,在LPS模拟的炎症环境下,CysC 可以恢复LPS 对N2a 的生长抑制;相反,CysC 抑制剂则会加重损伤(图4c)。因此,可以认为CysC在病理状态下对N2a细胞具有保护作用。
2.4 CysC不影响HASMCs的增殖
平滑肌细胞是血管的另一种重要组成。为了探索CysC 的脑保护作用是否与平滑肌细胞相关,用不同浓度梯度的CysC 及其抑制剂处理HASMC。结果表明,CysC(图5a)或CysC 抑制剂(图5b)对HASMC的生长没有剂量依赖性影响。因此,推测CysC 对脑组织的保护功能主要靶向神经元和血管内皮细胞。
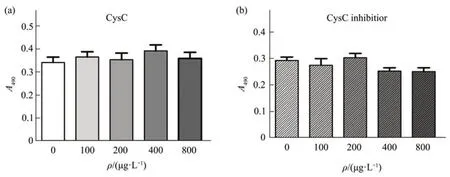
Fig.5 CysC has no effect on smooth muscle cellsAfter treating with 100 µg/L, 200 µg/L, 400 µg/L and 800 µg/L of CysC (a) for 24 h or CysC inhibitor (b) for 24 h, the proliferation level of HASMCs was detected by MTT assay. The result showed that there was no statistical difference between all dosage groups of CysC or CysC inhibitor.A490 are means±SD,with statistical analysis by one way ANOVA.
3 讨论
抑郁症是一种全球范围内常见的神经障碍疾病。WHO 的统计显示,截至2021 年5 月全球约有2.8 亿人罹患抑郁症,已成为全世界主要的致残、致死疾病之一[25]。多项研究表明,CysC的表达与抑郁症有关。在中国,血清CysC 水平与老年抑郁症风险增加有关[26]。荷兰一项关于抑郁症和焦虑症的研究显示,血清CysC 水平与男性重度抑郁症有关[27]。Minev等[28]研究比较了肾病患者治疗后肾功能与抑郁症之间的关系,发现血清中具有高水平CysC 的患者在肾病治疗后患抑郁症的可能性增加。然而,到目前为止还没有用动物模型证实CysC与抑郁症有关的报道。
抑郁症动物模型主要通过应激、手术、药物诱发、遗传修饰等方法制备[29];用于制备模型的动物包括大鼠、小鼠、非人灵长类动物等[30]。本团队在前期研究中通过7种行为学测试描述了长爪沙鼠基本行为特征,证明该动物可以作为焦虑和恐惧领域的大脑行为研究工具[19],是神经行为学研究的理想实验动物[19]。近期有研究表明,通过剥夺与褪黑素抑制相关的蓝光后,长爪沙鼠脑组织和血清中5-羟色胺水平显著降低,并且表现出抑郁样行为[31],提示长爪沙鼠可能对诱导抑郁因素敏感。本研究评估了前期成功建立的CysC 敲除长爪沙鼠的神经行为变化,发现CysC 缺乏导致长爪沙鼠不同月龄阶段出现抑郁样行为,包括蔗糖偏好显著降低、社会行为减少等。本研究首次描述了CysC 缺乏会明显影响动物的社交行为和焦虑行为,用长爪沙鼠CysC敲除动物模型证明CysC与抑郁症之间的关系,同时也提示CysC 可能是抑郁症研究的一个有价值的靶标。
为了探索CysC-KO 神经行为异常的原因,检测了CysC 对血管细胞和神经细胞的影响。基于动物和临床两个层次的研究表明,神经元丢失是抑郁症病理变化中的重要特征,抑郁症发生与大脑中海马与前额叶皮质中神经元的萎缩和神经细胞缺失相关[32]。CysC 在神经系统疾病中具有广泛的功能。CysC 可通过激活AMPK-mTOR 通路从而诱导神经元保护性的自噬流增加[33];Dutta 等[34]的研究结果表明,CysC 耗竭显著降低受损大鼠多巴胺神经元培养液对小胶质细胞的极化作用和神经毒性。本研究发现,CysC 显著增加缺氧和缺乏营养供应的病理环境以及LPS模拟的炎症刺激下N2a细胞的活力,这可能直接证明CysC 是病理环境中促进神经元生长和保护神经细胞的重要因子。
多个研究表明,包括冠心病、卒中、血管性痴呆在内的脑微血管疾病与抑郁症的高发显著相关[35],而越来越多的研究发现CysC与血管疾病有关,动脉粥样硬化患者中CysC 可以通过减少自噬来减少细胞死亡[36],血清CysC水平可能在兔球囊损伤腹主动脉的血管重塑中起重要作用[37]。因此,推测CysC 也可能通过血管细胞在抑郁症中发挥作用。本研究的结果显示,CysC 可以增加HUVEC的增殖能力,并抵抗由TNF-α、缺氧和饥饿引起的增殖抑制,但对HASMCs 没有影响。这些结果证实CysC 的神经保护作用可能通过靶向血管内皮细胞来实现。
本研究仍存在一些局限性。首先,尝试用免疫荧光或免疫组化方法在CysC-KO 大脑中明确CysC-KO 长爪沙鼠的大脑哪些区域与相应抑郁表型密切相关。由于缺乏针对长爪沙鼠CysC 的商品化抗体,本课题组自行开发了CysC 长爪沙鼠抗体并在免疫印迹(Western blot)中获得满意结果[23],但很遗憾该抗体在CysC-/-和CysC+/+动物中均呈阴性(数据未显示),下一步将设计寡核苷酸探针,利用FISH 技术实现这一目的。其次,本研究仅证实CysC 对内皮细胞和神经元细胞的保护作用,CysC-KO 对大脑的何种损伤会导致行为改变及其潜在的分子机制尚不清楚。此外,内皮细胞和神经细胞是否可以通过旁分泌CysC 或某些介质如外泌体[38]间接相互作用也需进一步阐明。这些问题将在以后的研究中进一步探索。
4 结论
综上所述,本研究表明长爪沙鼠中CysC-KO可引起抑郁样行为,可作为抑郁症研究的动物模型。并且结果表明,CysC 对脑组织的保护功能主要靶向神经元细胞和血管内皮细胞,而对血管平滑肌细胞无明显影响。
附件PIBB_20220115_Doc_S1.pdf 见本文网络版(http://www.pibb.ac.cn或http://www.cnki.net)。
