模拟航天失重病理特征的小鼠模型的制备*
2022-05-23梅天豪童志前
梅天豪 陈 莹 赵 夯 袁 野 童志前
(温州医科大学老年研究院,浙江省阿尔茨海默病研究重点实验室,精神医学学院,瓯江实验室,温州 325035)

C57BL/6小鼠(Mus musculus),一种广泛使用的实验动物,适用于Ⅱ型糖尿病、肥胖、代谢综合征、脂肪肝、动脉粥样硬化等多种疾病的模型研究或造模。
近些年来“神舟”系列载人飞船的发射成功及中国空间站的建立,为中国航天员在太空中长时间工作提供了高科技平台。但航天失重破坏宇航员的感觉、认知、平衡和运动功能,导致航天员返回地面后出现行走时空间方向感缺失[1]、肌肉激活模式改变[2-3]、步态和姿势紊乱、运动协调能力下降[4],严重影响宇航员返回地球后的正常生活。如何保障航天员健康是航空航天医学研究的重点及难题。
欧洲、美国、日本、中国等航天中心为探索航天失重对宇航员健康的影响,开展了在地面模拟航天失重环境动物模型的制备。目前常规方法是后肢悬吊法(hindlimb unloading,HU)来制备模拟失重动物模型[5],但也有一些缺点,如制备时间较长(一般为2 周)、受外界干扰因素多等。急需开发并制备耗时短、简单可行的模拟航天失重病理特征的动物模型。
已有的一些研究发现,内源甲醛在小脑的蓄积破坏躯体平衡能力[6]。本文首先探索标准模型组的后肢悬吊小鼠小脑顶核中甲醛是否蓄积、甲醛代谢相关酶的活性及表达,以及甲醛浓度变化与运动功能紊乱之间关系;并进一步采用向健康成年小鼠小脑顶核内注射病理浓度的甲醛(标准模型组小脑测得的浓度)来重现标准模型组的病理及行为特征。结果显示顶核注射甲醛制备的小鼠模型和后肢悬吊法制备的标准模型的病理及行为较为一致,这为探索航天失重的危害提供了一种药物筛选模型。
1 材料与方法
1.1 实验动物
健康雄性C57BL/6J小鼠,2月龄,无特定病原体级(specific pathogen free,SPF)。动物进入动物房后适应性喂养1周,分笼饲养,室内温度控制在(25±2)℃,光照周期为12 h,白昼交替(7∶00~19∶00),动物自由进食及饮水,定期更换垫料。
1.2 实验耗材
一次性防滑聚乙烯(PE)手套(海门市扬子医疗器械有限公司),1.5 ml 离心管(美国AXYGEN公司,货号:CC-4213-05),阳离子防脱玻片(北京中杉金桥生物技术有限公司,货号:ZLI-9506),一次性盖玻片(江苏世泰实验器材有限公司,货号:10212432C),小鼠双管微量给药系统(深圳市瑞沃德生命科技有限公司,货号:62028/62128/62228),PE管(1.5 mm×0.5 mm)(深圳市瑞沃德生命科技有限公司,货号:62329),徕卡一次性窄刀片(徕卡显微系统(上海)贸易有限公司,货号:819)。
1.3 实验仪器和设备
移液器(德国Eppendorf 公司, 货号:31110008),微量进样器(5 μl)(上海高鸽工贸有限公司),冰冻切片机(德国Leica 公司,型号:LEICA CM 1950),倒置相差显微镜及成像系统(德国卡尔·蔡司股份公司,型号:AxiocamERc 5s),酶标仪(美国Molecular DEVICES 公司,型号:Spectra Max i3x),超低温冰箱(赛默飞世尔科技(中国)有限公司,型号:905),小型台式高速离心机(德国Eppendorf 公司,型号:5430 R),低速离心机(德国Eppendorf 公司,型号:5702),小鼠立体定位注射仪(深圳市瑞沃德生命科技有限公司),涡旋振荡器(海门其林贝尔仪器制造有限公司,型号:VORTEX-5),净化工作台(上海博讯医疗生物仪器股份有限公司,型号:SW-CJ-2FD),小鼠转棒仪(西班牙Panlab公司),步态分析仪(美国Mouse Specifics 公司, 型号:DigiGait),超声波破碎仪(美国SONICS,型号:VCX150PB),高度分散匀浆机(上海启前电子科技有限公司,型号:FSH-2A)。
1.4 小鼠分组
动物于造模前进行平衡木和转棒行为实验训练,选取合格的小鼠随机分为4组:a.对照组(不做任何处理);b.后肢悬吊组;c.假手术组(磷酸缓冲液(PBS)注射);d.顶核甲醛注射组。每组8只,单笼饲养。
1.5 后肢悬吊组标准模型
标准模型参照常规的小鼠后肢悬吊法制备[5]。注意调节绳子长度使小鼠后肢刚好离地,身体长轴与水平地面形成30°的倾斜角度。保证小鼠前爪着地可以在鼠笼的一定范围内活动(自由摄食和饮水)。造模持续2 周。造模结束后进行平衡木、转棒、步态分析等行为学评估。
1.6 顶核注射组模型
1.6.1 小脑顶核立体定位
参照《小鼠脑立体定位图谱》确定顶核注射位点 坐 标(x= -6.25 mm,y= ±0.75 mm,z=-2.25 mm),向健康野生成年雄性小鼠顶核内注射细胞膜红色荧光探针,检测位点坐标是否准确。
1.6.2 小鼠双侧顶核导管埋入及给药
向顶核注射组的小鼠腹腔内注射2%戊巴比妥钠,待小鼠完全麻醉后,将其固定在立体定位仪上[7],用刀片剔除头皮上的毛发后进行双侧顶核埋管手术。手术后将套管内芯拔出,插入内导管,为保证药物进入目标脑区,内导管比套管长0.5 mm。用PE 管将5 μl 微量进样器与内导管露在外面的一端相连,并将含有1.5 mmol/L甲醛的微量进样器固定于微量进样泵上,参数设置为10 min内注射5 μl,注射完后停留5 min,使药物充分扩散。缓慢拔出内导管,插入内芯。给药过程中注意维持小鼠体温,密切观察小鼠状态。每天给药1次,持续14 d。造模结束后进行行为学评估。
1.7 小鼠运动功能检测
1.7.1 平衡木实验
小鼠通过平衡木的时间可用来评估小鼠的平衡和协调能力。8 mm 平衡木两端10 cm 处分别用无味的笔做标记,两标记之间的距离为80 cm,小鼠通过标记即开始或停止计时。记录小鼠在120 s 内通过80 cm 距离的时间(潜伏期,s),超过120 s,仍未通过的记为120 s。训练期第1 天在训练之前,先把小鼠放入平衡木一端的逃生箱内适应环境30 min,适应结束之后将小鼠放在平衡木上距逃生箱5 cm 处,小鼠能自行爬回箱内则开始训练,每天3 次,每次间隔5 min,造模结束后进行测试,选取训练期第3天和测试期小鼠通过较细平衡木的潜伏期平均值作为造模前后的数据进行统计[8]。
1.7.2 转棒实验
小鼠在转棒上的停留时间可用来评估小鼠运动协调能力。在造模前先对小鼠进行为期3 d 的训练。第1天先设置5 r/min的速度使小鼠适应转棒环境及运动方式1 min,期间掉落的小鼠仍然放回继续适应,间隔5 min后开始训练,以4 r/min的初始速度,匀加速5 min 至最大速度40 r/min,记录这期间小鼠在转棒上停留的时间,潜伏期不足1 min的小鼠放回转棒重新计时,超过1 min后掉落或抓紧转棒后跟随转棒转动2 周均停止计时,5 min 内未掉落者记录为300 s。造模结束后进行正式测试1 d,设置条件同造模前训练实验(5 min 内从4 r/min匀加速至40 r/min)。训练和测试均为每天3次,每次间隔5 min,选取训练期第3 天和测试期的潜伏期平均值进行数据统计[9]。
1.7.3 步态分析
步态分析仪由DigigaitTM成像和分析软件(Digigait,Mouse Specifics,Boston,USA)自动量化动物行走或跑步步态的空间信息,包括步宽、摆幅、推动力、步进顺序等参数,本研究只统计了步宽。正式测试前先将小鼠放在跑步机上以5 cm/s的速度适应5 min,休息5 min后开始测试。跑步机的测试速度设为15 cm/s,至少采集5个步伐。
1.8 小鼠小脑组织学检测
1.8.1 小脑甲醛荧光成像
三组小鼠腹腔内注射10 μm/L 的Na-FA(甲醛荧光探针)[10],30 min 后用2%戊巴比妥钠溶液深度麻醉,将小鼠颈椎脱臼处死,取出小鼠脑组织,PBS冲洗表面血液及杂质。将不同组的脑组织置于同一玻璃器皿中,吸干脑组织周围水分后放入成像暗箱平台。以上步骤在冰上避光操作。选择激发和发射滤片(λex/em=430 nm/543 nm),调整软件进行成像。
1.8.2 小脑组织甲醛和甲醛代谢相关酶类的检测
a.样本制备
行为学评估结束后注射2%戊巴比妥钠将小鼠麻醉,颈椎脱臼处死,冰上剥离小脑组织。电子天平快速称重脑组织并记录,加入预冷的PBS 液(pH=7.4)。组织匀浆机在冰浴条件下将小脑组织充分匀浆,4℃,12000g离心5 min,取上清液备用。
b.小脑组织蛋白质浓度检测
配制蛋白质标准品和BCA 工作液,加样后用酶标仪在562 nm 处检测吸光度。以蛋白质标准品的浓度为横坐标,吸光度为纵坐标,制作标准曲线,根据所得公式计算待测样本的蛋白质浓度。
c.小脑组织甲醛含量检测
吸取0.5 ml 样本,加入等体积的10%三氯乙酸,涡旋5 s,放入预冷至4℃的离心机中,10000 r/min,离心30 min。吸取0.4 ml 上清液加入到新的EP 管中,再向管中加入0.1 ml DNPH(1 g/L) 和0.5 ml 乙腈,充分混匀,60℃水浴30 min。再次离心后吸取上清液,注射到高效液相色谱仪专用测量瓶中检测甲醛含量[11]。
d. 小脑组织氨基脲敏感胺氧化酶(semicarbazide-sensitive amine oxidase,SSAO)活性检测
根据SSAO 试剂盒说明书进行(GMS50538.1,上海杰美基因医药科技有限公司,上海)。向待测样品中加入25 μl 混合液,37℃孵育待测样品20 min。用酶标仪测定498 nm 波长处的吸光度,37℃孵育1 h 后再次测定A498。绘制标准曲线,根据公式计算待测样本中的SSAO活性。
1.8.3 小脑SSAO免疫荧光组化
在行为学检测后,参照小鼠脑组织切片的方法制备样本[12]。同时为了防止切片出现冰晶,使用用蔗糖溶液(PBS配制)脱水。包埋前将脑组织块表面的液体用吸水纸吸干。一抗:VAP-1/SSAO(1 mg/L,ab42885,Abcam,Cambridge,MA),荧光二抗:Alexa Fluor 488 单抗鼠IgG(green,1∶400,Thermo Fisher Scientific);其 他抗 体:rabbit IgG(1 mg/L,R&D Systems,Minneapolis,MN)。一抗和二抗孵育后进行脑片免疫荧光染色[13], 用 激 光 共 聚 焦 显 微 镜(BZ-9000,BIOREVO,Keyence,Japan)进行图像采集。
1.8.4 小脑切片尼氏染色
尼氏体是神经元内合成蛋白质合成的重要部位,当神经元受到刺激后,胞体内的尼氏体会明显减少。通常尼氏体能被碱性染料如硫堇、亚甲蓝、甲苯胺蓝和焦油紫等染料染成紫蓝色。本实验使用的是焦油紫法。使用改良后的尼氏体染色法(C0117,碧云天,中国)对小脑切片进行染色[14],再用无水乙醇迅速脱水,并使用二甲苯透明和中性树胶封固,在光学显微镜下观察并拍照。
2 结果
2.1 后肢悬吊小鼠小脑甲醛蓄积及运动功能受损
小鼠的后肢悬吊,使其身体长轴与地面呈30°角(图1a)。采用甲醛荧光探针Na-FA 的小动物荧光成像观察到第14 天的后肢悬吊小鼠小脑中内源甲醛荧光强度增强(图1b,c),同时用高效液相色谱仪(HPLC) 测得的甲醛浓度急剧上升(图1d)。这和以前的研究中失重条件下甲醛含量增加基本一致[15]。
后肢悬吊第14 天用转棒(图1e)和平衡木(图1g)检测小鼠的平衡能力,结果显示较对照组模型组小鼠在棒时间缩短(图1f),通过平衡木的时间延长(图1h),说明模拟失重的后肢悬吊使小鼠平衡协调能力受到了损伤。这和以前的研究结果一致[16]。
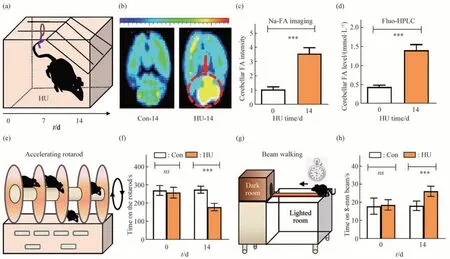
Fig.1 Move disorders of HU model mice assessed by rotating bar instrument and balance beam(a) Schematic diagram of mice model of hindlimb unloading (HU). (b) Formaldehyde fluorescence imaging of mouse cerebellum by injection of Na-FA probe on day 7 and 14, respectively. Con, Control; FA, formaldehyde. (c) Elevated fluorescence intensity of FA in cerebellum of HU model.(d)Increased levels of FA in cerebellum of HU model.(e)Schematic diagram of rotating rod instrument.(f)Comparison of staying time between HU and Con group.(g)Schematic diagram of balance beam.(h)Time of crossing balance beam in HU and Con group.***P<0.001,ns P>0.05,n=8.
2.2 后肢悬吊小鼠脑中甲醛产生酶活性及表达增加
采用组织免疫荧检测后肢悬吊组和对照组小鼠小脑内SSAO 含量,用SSAO 活性试剂盒检测了血液、小脑匀浆中SSAO的活性。结果显示:与对照组相比,后肢悬吊组小鼠小脑内SSAO 含量增加(图2a),活性增强(图2b),血浆中SSAO 的活性增强(图2c)。同时,SSAO 的组织免疫荧光结果也显示后肢悬吊组小鼠小脑血管壁中SSAO荧光强度较对照组显著增加(图2d,e)。
以上结果说明,后肢悬吊模拟失重确实导致了小鼠运动功能的紊乱,小脑中的甲醛蓄积可能与模拟失重导致的运动障碍密切相关[17],而SSAO 表达增加及肌氨酸脱氢酶(sarcosine dehydrogenase,SARDH)与甲醛蓄积有着紧密联系(图2f)[18]。这提示:向小鼠的小脑顶核内注射病理浓度的甲醛有可能用来制备类似失重诱发运动紊乱的病理小鼠模型。
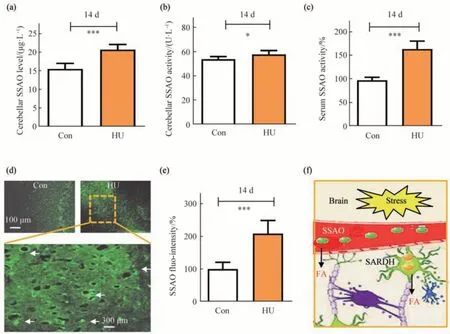
Fig.2 Increased in the levels of expression and activity of SSAO protein in the cerebellum of HU group detected by using immunofluorescence and SSAO kits,respectively(a,b)Elevated in the levels of expression and activity of SSAO enzyme in the cerebellum of HU mice than Con mice.(c)Increased in the activity of serum SSAO in HU mice than Con mice.(d,e)Enhanced immunofluorescence of SSAO in the cerebellum of HU mice.(f)Schematic diagram of FA accumulation in the cerebellum caused by increasing SSAO enzyme expression in blood and activating mitochondrial SARDH of neurons.Sarcosine dehydrogenase(SARDH).*P<0.05,***P<0.001,n=8.
2.3 顶核注射病理浓度甲醛小鼠的病理特征及行为变化
为探索是否小脑中甲醛蓄积是后肢悬吊模型小鼠出现运动功能紊乱的关键诱因,采用立体定位微量注射技术向健康成年雄性小鼠小脑的顶核注射病理浓度(1.5 mmol/L,2 μl/侧)的甲醛,观察小脑神经元死亡及运动行为变化。
为确定立体定位注射位点的准确性,将细胞膜红色荧光探针(Dil,25 μmol/L,C1036,碧云天,中国)量注射到小脑顶核(图3a),制作冰冻切片后用细胞核蓝色荧光染液(DAPI,C1002,碧云天,中国)孵育5~10 min,激光共聚焦的结果显示小鼠小脑顶核出现红色荧光,说明注射位置准确。
为检测病理浓度甲醛对小脑顶核神经元的毒性,将顶核微量注射甲醛后的小鼠脑组织灌注固定,制作冰冻切片后进行尼氏染色。结果显示:后肢悬吊组(HU)和顶核注射组(FA-1.5 mmol/L)的小鼠较对照组(Con)的小脑顶核神经元中紫蓝色尼氏体显著减少,说明神经元死亡增加(图3a)。
为检测病理浓度甲醛对小脑运动功能调节的影响,采用转棒仪、平衡木、步态分析仪检测小鼠的运动功能。结果显示小脑顶核微量注射甲醛后,小鼠在棒时间缩短(图3b),穿过平衡木的时间延长,表明平衡能力减弱(图3c)。特别是后肢悬吊组(HU)和顶核注射组(FA-1.5 mmol/L)的小鼠较对照组(Con)的步宽明显增加(图3d)。以上说明顶核注射组和HU 组的运动行为紊乱基本一致。
以上数据表明,顶核立体定位注射病理浓度的甲醛可使神经元死亡,并诱发小鼠表现出现运动失调、步态紊乱症状[19],与后肢悬吊组小鼠运动功能紊乱的行为特征类似。
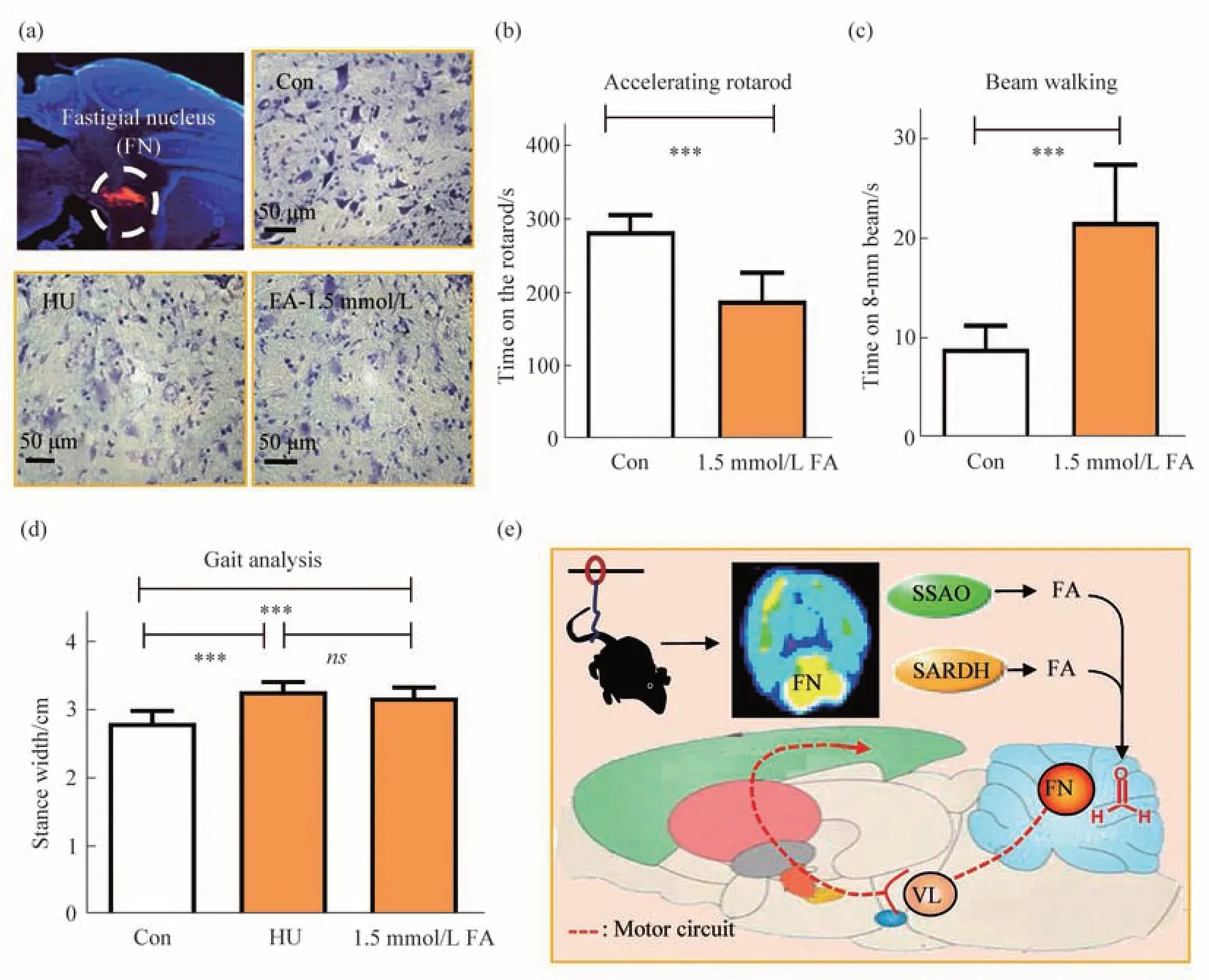
Fig.3 Mimicking pathological characters of HU model mice by injecting of excessive FA into the fastigial nucleus of male healthy mice(a)Injection site of the fastigial nucleus(FN)and Nissl staining showed neuronal death after injection of FA into FN of the cerebellum.(b)Decreased in the staying time in the rotarod in FA-injected mice.(c)Decline in the staying time in the beam waling in FA-injected mice.(d)Gait analysis of the stance widthin Con, HU model, and FA-injected mice. Con: the wild-type mice; HU: hindlimb unloading; FA: formaldehyde.(e) Presumed mechanisms of HU-induced move disorders through SSAO-derived FA impairing FN-pathway.VL:ventrolateral nucleus of thethalamus.***P<0.001,ns P>0.05,n=8.
3 讨论
本研究发现标准模型组的后肢悬吊小鼠小脑顶核中甲醛生成酶——SSAO 的活性及表达急剧增加,导致小脑中甲醛蓄积、神经元死亡,并伴随运动功能紊乱;而向健康成年小鼠小脑顶核内注射病理浓度的甲醛可以重现标准模型组的病理及行为特征。这说明航天失重导致小脑内源甲醛蓄积,而过高浓度的甲醛是诱发小脑运动调节功能紊乱的关键原因(图3e)。这提示消除小脑内过多的甲醛可能有助于挽救航天失重诱发的运动功能失调。
人类经过千万年的进化,形成了与地球重力环境相适应的生理结构与功能特点。而宇航员长时间处于航天失重环境下人脑和身体出现结构改变[20]。特别是宇航员完成长期太空飞行任务返回地面后,常常出现与神经肌肉系统退化相关的运动功能障碍,如手灵活性降低[21]、肌肉萎缩、肌肉力量下降[22-23]、小脑共济失调和空间定向障碍等表现[24],严重影响航天员的健康和工作效率。急需在地面环境探索和开发能模拟航天失重病理特征的动物,为应对航天失重的危害提供新的药物筛选模型。本研究采用后肢悬吊法来制备模拟航天失重小鼠模型[25-26]。造模2 周后,行为学结果显示,HU 组小鼠比对照组小鼠通过平衡木的时间延长、在转棒上停留的时间缩短,较难保持身体的平衡;组织生化指标检测结果显示,HU 组小鼠脑内和血液中的SSAO活性增强,甲醛代谢紊乱,导致小脑内甲醛急剧蓄积。这说明航天失重诱发了小脑中甲醛蓄积,而高浓度的甲醛直接诱发神经元死亡,破坏了小脑对运动功能的精细调节功能。
为探索小脑蓄积的甲醛是导致运动功能紊乱的直接诱因,本研究采用了顶核立体定位注射病理浓度的甲醛来制备新型模型,检验是否与标准的后肢悬吊模型的病理特征一致,包括SSAO 活性增强[27],小脑甲醛蓄积,小脑神经元数目减少,出现步态紊乱、平衡功能失调等。结果显示,顶核注射组小鼠的小脑受损及运动功能紊乱与后肢悬吊准模型的生化指标、行为特征基本一致,特别是小脑顶核中内源甲醛蓄积[28]。而过多的甲醛直接诱发神经元死亡,破坏顶核到大脑皮层的运动环路,导致运动功能紊乱(图3e)。
4 结论
本研究建立了航天失重病理特征的模型小鼠。此模型较好地模拟了失重环境下病理及运动行为的改变。这为探索失重环境下的运动障碍机制提供了新思路,同时也为应对航天失重危害的药物筛选提供了新的、潜在的动物病理模型。
