扁豆碳量子点/异硫氰酸荧光素比率荧光探针测定氯诺昔康的研究
2022-05-21孙凌波武文波王清清张越诚马红燕
孙凌波,武文波,王清清,张越诚*,马红燕*
(1.延安大学 医学院,陕西 延安 716000;2.延安大学 化学与化工学院,延安市分析技术与检测重点实验室,陕西 延安 716000)
碳量子点(CQDs)具有光电性能优异、生物相容性好、合成路线简单[1]等优点,在环境污染物控制[2]、肿瘤的纳米治疗[3]、膜改性技术[4]、生物样品发光免疫检测[5]等方面具有广泛应用。目前,利用CQDs的荧光分析大都基于单发射峰的荧光信号,易受激发光强度、探针浓度等因素的影响[6],进而影响检测准确性。相比于单发射荧光探针,比率荧光探针具有内校准功能,可通过两个荧光峰的比值消除或减少体系的干扰,使检测的准确性得到提高[7]。近年来,碳源材料的选择、CQDs 制备方法[8]、信号响应设计[9]以及比率型探针的构建和应用[10]成为新的研究热点。
氯诺昔康(Lornoxicam,LNXC)为非甾体类药[11],用量不当将导致肠胃出血、胃溃疡和穿孔等不良症状。因此,寻找一种能准确、灵敏、快速测定LNXC含量的方法非常重要。目前,测定LNXC的方法有基于铕(Ⅲ)荧光增敏的荧光分析法[12]、固相萃取-紫外可见分光光度法[13]、超声辅助离子液体分散-液液微萃取光度法[14]、胶束协同作用下的流动注射化学发光法[15]及HPLC 法[16]等。相较于其他方法,紫外可见分光光度法的灵敏度一般相对较低;化学发光分析法选择性不够好;HPLC 法通常需要复杂的仪器以及样品预处理。荧光分析法凭借其简单、灵敏等优势受到了广泛关注,尤其是基于CQDs的荧光分析法,近年来发展迅速。但目前为止,未见以CQDs 为参比信号构建比率型荧光探针测定LNXC的研究报道。
本研究以天然生物质扁豆为原料,通过一步水热法合成了荧光性能优良、水溶性好的扁豆CQDs(HB-CQDs),该量子点可通过静电作用与异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)形成新型HB-CQDs/FITC 复合物探针。MnO-4可通过电子转移和能量转移猝灭HB-CQDs/FITC 于400 nm 和510 nm 两峰处的双发射荧光信号;加入LNXC 后,由于能量转移过程受阻,复合物于510 nm 处的荧光信号恢复,而400 nm 处的荧光强度值基本不变。本文对上述体系的相互作用机理及荧光猝灭的类型进行了探讨,并提出了以HB-CQDs 为参比信号,FITC 为响应信号的双发射比率型荧光探针HB-CQDs/FITC 测定LNXC 的新方法。相较于已有的LNXC 测定方法,该方法的碳源绿色环保,无任何其他试剂添加,一步水热即可合成;同时比率型荧光探针的构建减少了光源不稳定等因素带来的检测误差,显著提高了分析方法的准确度。
1 实验部分
1.1 仪器与试剂
F-4500 荧光光谱仪、HT7700 透射电镜(日本日立);XRD-7000 XRD 衍射仪、Prestige-21 型IR光谱仪(日本岛津);Agilent 8453UV-Vis光度计(美国安捷伦);FLSP920瞬态荧光仪(英国爱丁堡)。
LNXC 标准品(上海甄准生物科技公司,含量≥98.0%);FITC(纯度≥95%)购于上海阿拉丁生化科技股份有限公司,使用时配成5.0×10-5mol/L 的溶液;KMnO4(纯度≥99.5%)购于天津科密欧化学试剂有限公司,使用时配成5.0×10-6mol/L 的溶液;HAc-NaAc 缓冲溶液(pH 5.80,冰乙酸购于天津耀华化学试剂有限责任公司,纯度≥99.5%;乙酸钠购于西安化学试剂厂,纯度≥99.0%);扁豆(市售)。实验用水为超纯水,试剂均为分析纯级。
LNXC 标准液(1.0×10-3mol/L):准确称取0.037 2 g LNXC 标准品,用5.00 mL NaOH(0.10 mol/L)溶解,搅拌、超声后定容(100 mL),4 ℃冷藏,使用时稀释。
1.2 实验方法
1.2.1 HB-CQDs 及HB-CQDs/FITC 复合物的合成HB-CQDs 的合成:将扁豆去皮、研碎成粉,称取6.0 g,置于水热釜中(50 mL),加20.0 mL 水,加热20 h(180 ℃),冷至室温,得到暗棕色HBCQDs 液,抽滤,经0.22 μm 微孔滤膜处理后定容于100 mL,即得HB-CQDs 母液,冷藏(4 ℃)备用。稀释200倍得到HB-CQDs工作液。
HB-CQDs/FITC 复 合 物 的 制 备:将5.00 mL 5.0×10-5mol/L 的FITC 溶 液 与HB-CQDs 工 作 液(17.0 mL)加入10.0 mL 的HAc-NaAc(pH 5.80)缓冲溶液中,室温下超声处理30 min 后转移至100 mL容量瓶中,即获得HB-CQDs/FITC复合物。
1.2.2 HB-CQDs/FITC 比率型荧光探针的构建将1.70 mL HB-CQDs/FITC、1.00 mL HAc-NaAc、0.80 mL 5.0×10-6mol/L KMnO4和一定量LNXC依次加入比色管(10 mL)中,定容,水浴(60 ℃)加热20 min,流水冷至室温后,测定其在单一激发波长λex=326 nm 下,于λem为510 nm 和400 nm 两处的荧光强度,并计算其荧光强度比值I510nm/400nm。
2 结果与讨论
2.1 HB-CQDs的形貌表征
图1A 为HB-CQDs的透射电镜(TEM)图,HB-CQDs的尺寸集中在5 nm 左右,无团聚,呈规则的球形形态。图1B为其X射线衍射(XRD)图,2θ=28.96°处为无定形态碳的特征衍射峰,且在XRD图中未发现明显的晶格线,说明制得的HB-CQDs 内部碳源之间具有无序性[17]。因此,该HB-CQDs 的晶型为无定型碳。
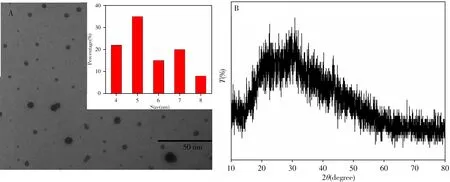
图1 HB-CQDs的TEM图(A)和XRD谱(B)Fig.1 TEM image(A)and XRD pattern(B)of HB-CQDs insert:particle diameter distribution chart
2.2 HB-CQDs的光学性质
扫描HB-CQDs 在不同激发波长下的荧光发射图,如图2 所示。当激发波长从306 nm 增加到346 nm 时,荧光发射峰从395 nm 红移到414 nm,荧光强度先增大后减小,表明激发波长影响HB-CQDs荧光强度的大小。这可能归因于HB-CQDs的表面缺陷[18]和粒径大小[19]的不同。λex= 326 nm 时,荧光信号(IF)最大,此时,λem为400 nm。
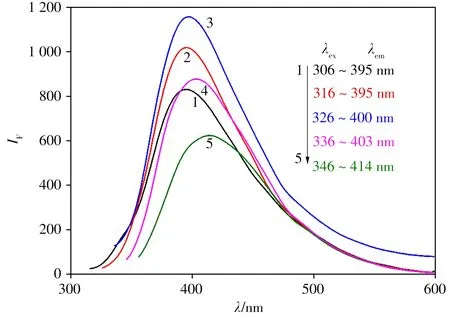
图2 不同激发波长(λex)下HB-CQDs的荧光发射图谱Fig.2 The fluorescence emission spectra of HB-CQDs under different excitation wavelengths
2.3 HB-CQDs/FITC复合物的光谱特性
对HB-CQDs、FITC 与HB-CQDs/FITC 复合物的荧光发射光谱进行分析,结果如图3A 所示。由图可以看出,在326 nm 激发波长下,HB-CQDs/FITC复合物分别于λem为510、400 nm 处有两个明显的发射峰,分别对应于FITC与HB-CQDs的特征荧光峰。但HB-CQDs/FITC复合物的荧光强度较二者简单加和(HB-CQDs+FITC)强度有所降低,表明HB-CQDs与FITC之间有相互作用存在。
图3B 为HB-CQDs、FITC 和HB-CQDs/FITC 复合物的UV-Vis 光谱。由图可知,HB-CQDs 在271 nm 处有一强吸收峰,320 nm 处有一弱吸收峰,这两个峰可能由共轭—C==C 的π-π*跃迁和—C==O 基团的n-π*跃迁[20]形成,说明HB-CQDs 溶液中有—COOH 等孤对电子官能团存在;FITC 于495 nm 处有一强吸收峰;HB-CQDs/FITC 复合物于271、320、495 nm 处有3 个吸收峰,分别与HBCQDs和FITC 的特征吸收峰一致。但HB-CQDs/FITC 复合物的吸光度值较HB-CQDs与FITC 的吸光度的加和有所降低,该结果进一步说明HB-CQDs和FITC之间相互作用的存在。
图3C 是HB-CQDs、FITC 和HB-CQDs/FITC 的红外光谱图(IR),由图可知:在HB-CQDs 中加入FITC后,HB-CQDs/FITC复合物中既有HB-CQDs 的特征基团,又有FITC的特征基团。HB-CQDs/FITC的红外光谱图中具有6个明显的特征峰,其峰值为3 400、2 970、2 395、1 750、1 375、1 150 cm-1,分别对应—OH、—CH2、—C≡C/—C≡N、—C==O、—C—O及—C—H的伸缩振动。与HB-CQDs比较,FITC偶联在HB-CQDs表面后,—C==O的峰位置发生红移,且峰强大大增加。综上所述,表明已成功制备出HB-CQDs/FITC复合物,并有—COOH、—C==O、—OH等含氧的亲水性基团存在于HB-CQDs表面。
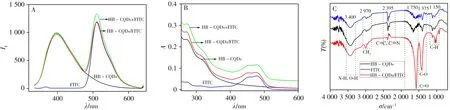
图3 体系的荧光发射图(A)、UV-Vis图(B)和IR图(C)Fig.3 The fluorescence spectra(A),UV-Vis absorption spectra(B)and infrared spectra(C)of the system
2.4 LNXC的测定原理
如图4A中曲线4和5所示,在单一激发波长λex=326 nm下,LNXC和MnO-4-LNXC均无明显荧光。相同条件下,MnO-4的加入可使单一HB-CQDs 的荧光信号猝灭,再加入LNXC 则可使被猝灭的HBCQDs 的荧光得到一定程度的恢复(图4B)。同时,测定了MnO-4和LNXC 分别对FITC 的响应,从图4C中可以看出,MnO-4的加入也使FITC 的荧光信号猝灭,但LNXC 对被猝灭的FITC 的荧光无恢复作用,反而与MnO-4有一定的协同猝灭作用。向HB-CQDs/FITC 复合物中加入MnO-4和LNXC时,MnO-4的加入使得HB-CQDs/FITC 复合物于510、400 nm 两处的荧光强度均降低,发生双猝灭;但向猝灭的体系中加入LNXC 后,FITC 于510 nm 处的荧光信号重新“开启”,而被猝灭的HB-CQDs 在400 nm 处的荧光未恢复。HB-CQDs/FITC与MnO-4与LNXC的反应也进一步证明了HB-CQDs/FITC复合物的形成。
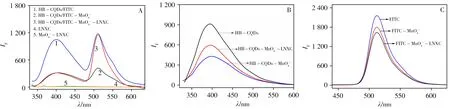
图4 不同物质结合的荧光发射谱图Fig.4 The emission spectra of the combination of different components
实验发现,将不同浓度的LNXC加入到HB-CQDs/FITC-MnO-4体系后,λem=400 nm处的荧光强度基本不变,λem=510 nm 处的荧光强度则随着LNXC 浓度的增加有规律的增强。据此,可基于I510nm/400nm与LNXC浓度之间的线性关系构建内标型比率荧光探针,实现LNXC的高灵敏度、高选择性检测。
2.5 LNXC测定条件的优化
2.5.1 pH 值及缓冲溶液FITC 在不同酸度下主要存在4 种型体,酸性或弱酸性条件下主要以FH3+或FH2的形式存在,而碱性或弱碱性条件下主要以FH-和F2-的形式存在[21]。因此,对测定体系pH值、缓冲液种类(Na2HPO4-柠檬酸、HAc-NaAc、K2HPO4-NaOH和BR)及用量进行了优化。如图5所示,选择加入pH 5.80的HAc-NaAc缓冲溶液1.0 mL。
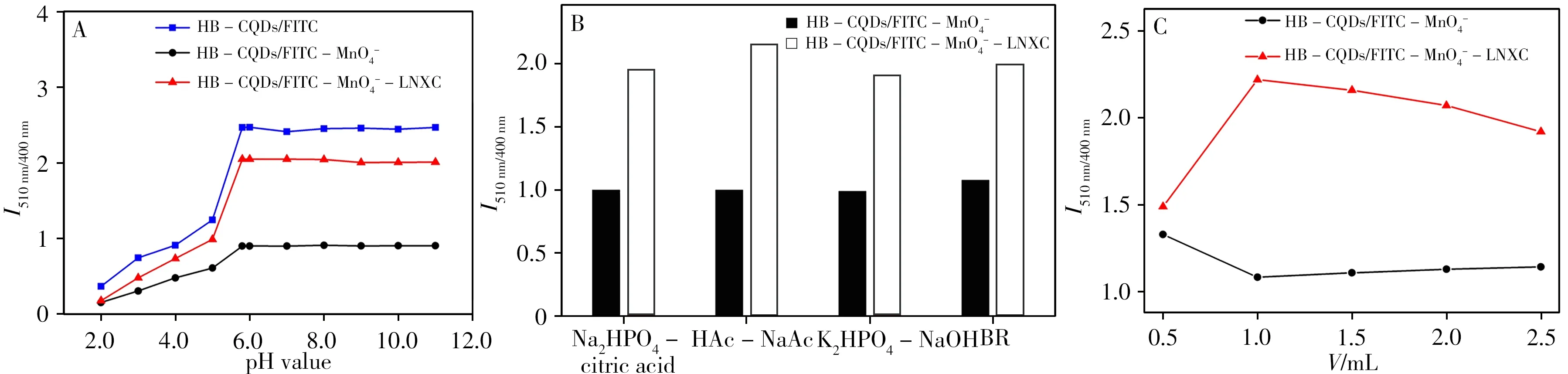
图5 pH值(A)、缓冲液种类(B)和缓冲液用量(C)对HB-CQDs/FITC-MnO-4 和HB-CQDs/FITC-MnO-4-LNXC体系的影响Fig.5 The effect of pH value(A),buffer(B)and buffer dosage(C)on HB-CQDs/FITC-MnO-4 and HB-CQDs/FITC-MnO-4-LNXC systems
2.5.2 MnO-4 用量的选择MnO-4的用量影响LNXC 检测的灵敏度及线性范围。对MnO-4的用量进行了优化,如图6所示。实验选择加入0.80 mL 5.0×10-6mol/L的MnO-4。
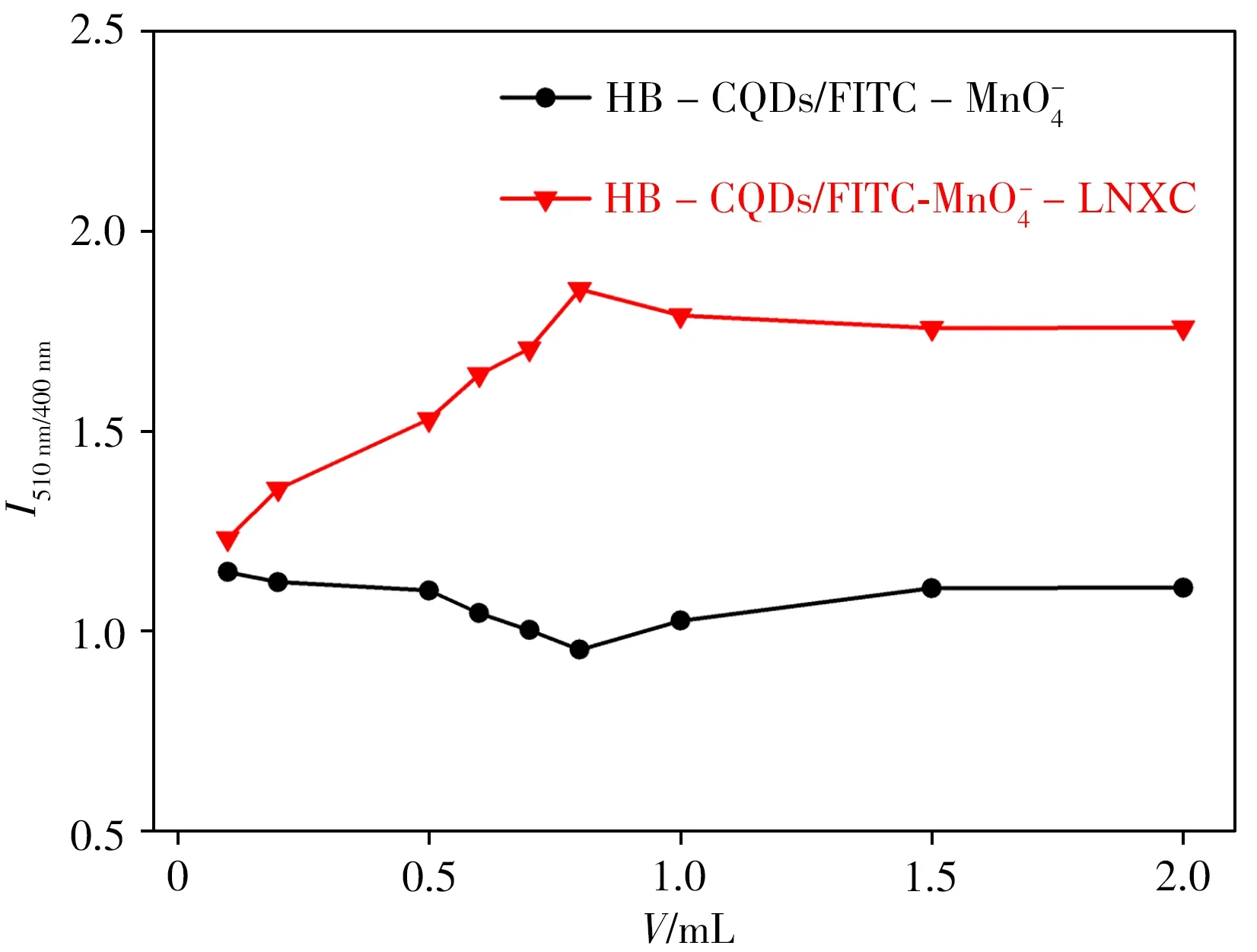
图6 MnO-4的用量对HB-CQDs/FITC-MnO4-和HB-CQDs/FITC-MnO-4-LNXC体系的影响Fig.6 The effects of MnO-4 dosage on HB-CQDs/FITC-MnO-4 and HB-CQDs/FITCMnO-4-LNXC systems
2.5.3 体系的反应时间与温度向被MnO-4猝灭的体系中加入一定量的LNXC 后,体系荧光信号比值I510nm/400nm在常温下恢复较缓慢。因此,考察了不同水浴温度(室温、水浴40 ℃、60 ℃和80 ℃)和时间对I510nm/400nm的影响。结果表明:在60 ℃水浴锅中加热20 min,荧光恢复比达最大,且在7.5 h内基本保持稳定。
2.5.4 特异性取cLNXC=5.0×10-6mol/L,在相对误差±5%范围内,以下可能存在的离子及药物辅料均不影响LNXC的测定:葡萄糖、羧甲基淀粉钠、纤维素、十二烷基硫酸钠、Mg2+、Ca2+、Cl-、SO24-、NO(-31 000倍);Ni2+、Ag+、Co2+、Cu2+、D-果糖、Zn2+(500倍);Mn2+、Al3+、F-、CN-、SO2-3(200 倍);Fe3+(50 倍);Hg2+(20 倍);Cr(Ⅵ)(5倍)。
2.5.5 线性范围与检出限在最佳实验条件下,LNXC在1.0×10-7~1.0×10-5mol/L 浓度范围内与HB-CQDs/FITC体系位于两发射波长处荧光强度的比值(I510nm/400nm)呈良好线性关系,线性方程为I510nm/400nm= 2.2 × 105c+ 1.3(r= 0.998 0)。方法的相对标准偏差(RSD)为1.2%(n=11,c=5.0×10-6mol/L)。根据IUPAC 的规定,以3σ/k计算得到检出限(DL)为9.0×10-8mol/L。
2.6 样品分析及加标回收
随机取同一批LNXC 10片(标示量:0.008 g),研成粉末,称取0.701 7 g(相当于0.037 2 g LNXC),用NaOH(0.10 mol/L)溶解,以水定容至100 mL。过滤,移取适量滤液测定LNXC 含量,结果见表1。为了进一步验证方法的准确性,进行加标回收实验。于样品溶液中加入3.00 mL 1.0 × 10-5mol/L 的LNXC标准品溶液进行测定,该方法的回收率为99.8%~105%,RSD不大于2.0%。

表1 LNXC样品的测定及加标回收率(n=5)Table1 Determination of LNXC in tablets and spiked recovery(n=5)
2.7 机理初探
对反应机理进行了初步探讨。首先,于λem= 510 nm 处测定了HB-CQDs/FITC 及HB-CQDs/FITC-MnO-4体系的荧光寿命(τ),结果见表2。其中,HB-CQDs/FITC 的加权平均荧光寿命(τ)[22]为4.05 ns,HB-CQDs/FITC-MnO-4为3.90 ns,τ1/τ0≈1。表明MnO-4与HB-CQDs/FITC 探针的相互作用方式为静态猝灭。

表2 荧光寿命对比Table 2 The comparation of fluorescence lifetime
其次,对体系的UV-Vis 吸收光谱进行研究。如图7A 所示,HB-CQDs/FITC 复合物有3 个吸收峰,分别位于271、320、495 nm 处,MnO-4在505、525、545 nm 处有吸收峰。加入MnO-4后,HBCQDs/FITC位于271 nm和495 nm处的吸收峰消失,于350 nm处出现了新的吸收峰,其吸收光谱发生明显变化。由于静态猝灭会改变物质的UV-Vis 谱图[23],因此说明MnO-4与HB-CQDs/FITC 之间以静态猝灭的方式相互作用,这与荧光寿命的推论一致。
图7B 为MnO-4、LNXC 及MnO-4-LNXC 体系的UV-Vis 吸收光谱图,在MnO-4溶液中加入LNXC 后,MnO-4的吸收峰消失,LNXC位于380 nm的峰也不复存在,表明LNXC与MnO-4之间发生了相互作用,有新物质生成。
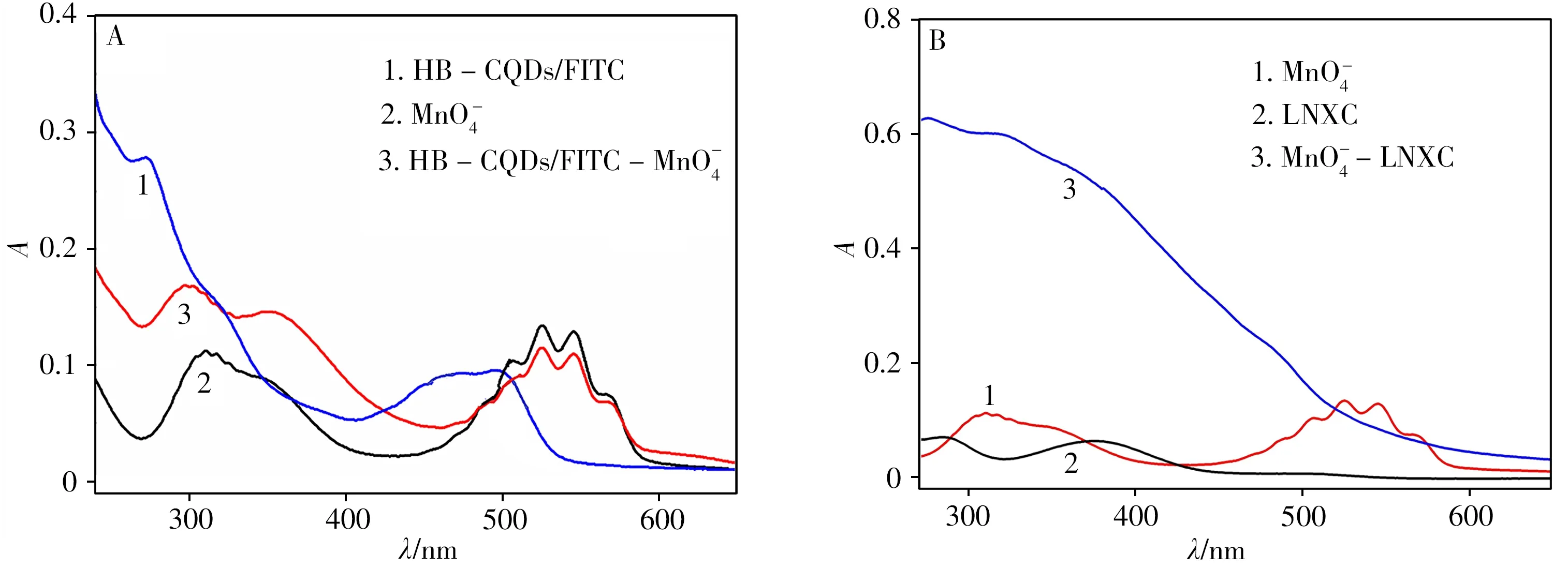
图7 HB-CQDs/FITC-MnO-4(A)和MnO-4-LNXC(B)体系的UV-Vis光谱Fig.7 The UV-Vis absorption spectra of HB-CQDs/FITC-MnO(-4A)and MnO-4-LNXC(B)systems
综上,体系可能的机理如下:pH 5.80 时,FITC 的水溶液呈正电性[21],可与表面存在大量—C—OR、—COOH 等吸电子基团且带负电荷的HB-CQDs 通过静电相互作用[24]自组装形成HB-CQDs/FITC复合物。加入MnO-4后,因MnO-4易得电子,可与HB-CQDs/FITC 发生电子转移[25],使HB-CQDs/FITC的荧光信号猝灭;同时,HB-CQDs/FITC 发射光谱中510 nm 处FITC 的峰与MnO-4的吸收光谱部分重叠,当MnO-4加入到HB-CQDs/FITC 复合物溶液中时,也可通过内滤效应(IFE)[26]的方式使其荧光猝灭;图7B显示LNXC可与MnO4-结合形成新物质,而LNXC的加入使MnO-4与FITC之间的能量转移过程受阻,FITC 被释放,使HB-CQDs/FITC 于510 nm 处的荧光信号重新开启,但MnO-4与HB-CQDs 之间的相互作用仍然存在,因此400 nm处的荧光信号基本保持不变。体系可能的机理如图8所示。
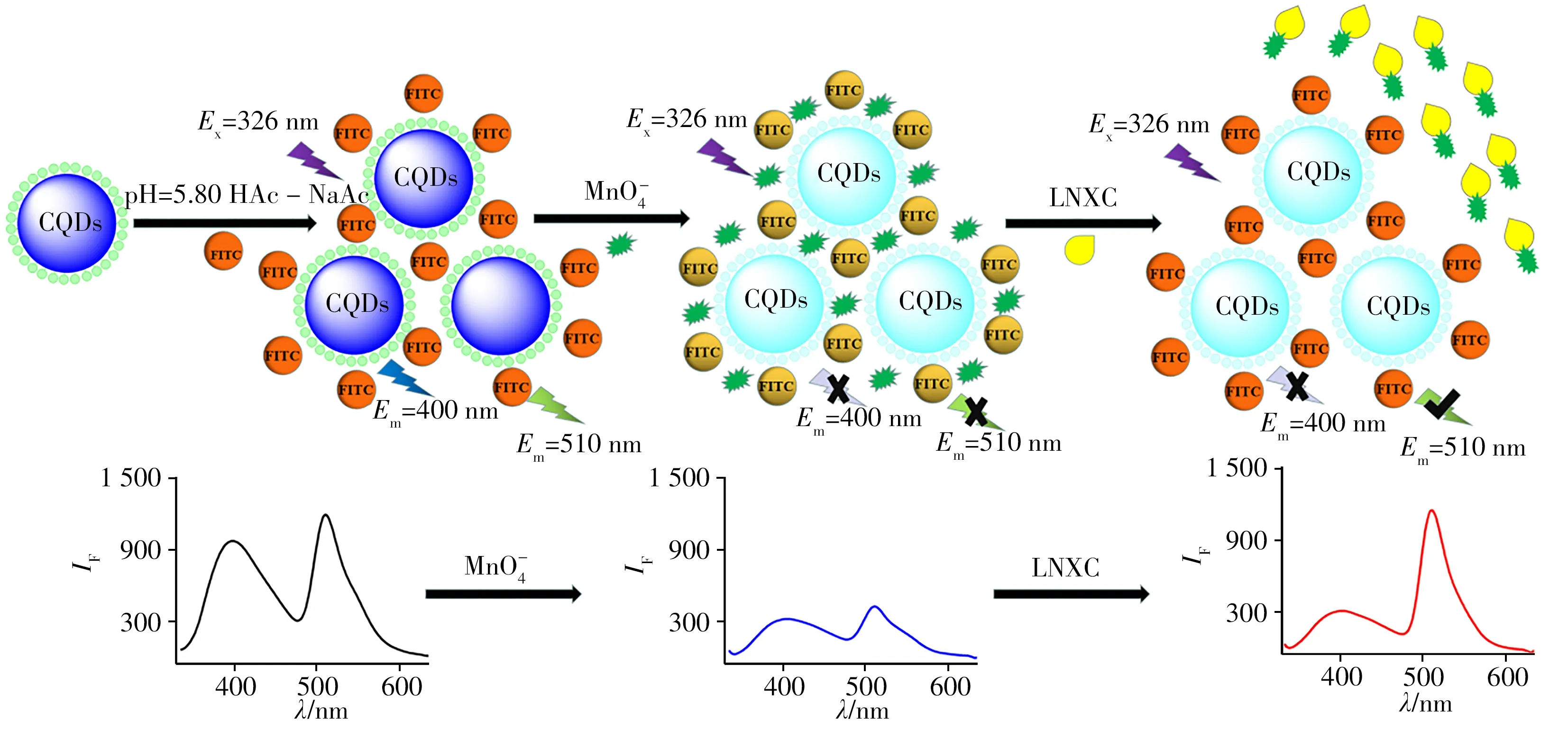
图8 HB-CQDs比率型探针作用机理图Fig.8 Mechanism diagram based on HB-CQDs ratiometric fluorescent probe
3 结 论
本文以绿色天然生物质扁豆为前驱体一步制备了绿色荧光HB-CQDs,其可与FITC 复合形成具有双发射荧光信号的新型HB-CQDs/FITC 探针。基于MnO-4的加入可使探针510 nm/400 nm 两处的荧光信号发生猝灭,而LNXC 的加入可使510 nm 处的荧光恢复,构建了“关-开”型HB-CQDs/FITC 比率荧光探针对LNXC进行高灵敏检测。方法简便、灵敏、准确,为LNXC的荧光测定提供了新思路。
