基于激发态分子内质子转移的新型聚集诱导荧光探针用于硫化氢的检测及细胞成像
2022-05-21刘芙蓉范哲锋温晓烨
刘芙蓉,闫 丽,范哲锋,温晓烨
(山西师范大学 化学与材料科学学院,山西 太原 030006)
硫化氢(H2S)主要以水溶液形式(HS-)存在,并以其刺激性气味和有害特性受到关注。生物系统中的H2S已被公认为是第三种内源性气体递质[1-2],有助于维持细胞健康的多种生理过程,如参与血红蛋白的变化、调节酶的种类、舒张血管等[3-4];但H2S 的异常积累也可能导致某些疾病,如阿尔茨海默病、肝病、糖尿病等[5]。另一方面,食品工业中,如发酵过程产生的H2S 对葡萄酒的品质有负面影响,不仅造成了大量经济损失,甚至会危害人体健康[6]。因此,设计和开发新颖有效的方法来检测和跟踪生物系统和食品材料中的H2S具有重要意义。
目前已报道了多种H2S 的检测方法,如电化学法、气相色谱法、比色法、化学发光法(CL)和荧光法[7-10],但存在样品制备相对复杂、操作时间长等缺点。研究者们基于荧光检测的优势,根据亲核加成反应、羟胺、硝基或叠氮化物的还原以及Cu2+置换等不同机理,设计了多种检测H2S 的荧光探针[11-12]。然而多数探针存在其他生物硫化物的干扰以及聚集诱导猝灭(ACQ)等缺陷,限制了其实际应用。因此,设计具有良好性能的H2S 荧光探针(例如可应用于水溶液介质,克服光漂白的影响等)具有重要意义。2001 年,Tang 课题组提出了聚集诱导发射(AIE)的概念[13-14],相对于传统的ACQ 分子,AIE 分子因具有高抗光漂白性、发射波长可调、可长期实时监测等独特的光物理特性,广泛应用于生物系统和食品材料[15-16]。
本文使用4-乙酰氨基苯甲醛和碳酸肼合成了一种具有AIE 特性的高效新型荧光探针1 用于检测H2S。从探针分子结构(图1)分析,探针的AIE特性可能归因于激发态分子内质子转移(ESIPT)效应和分子内旋转受限(RIR)效应。进一步研究表明,探针1+Cu2+对H2S 具有高时效、高灵敏的传感性能,由此成功构建了快速灵敏的开启型H2S荧光探针,并将其成功应用于酒液样品中的H2S检测以及活细胞中外源性H2S的生物荧光成像。另外,利用探针1制备了实时有效的H2S视觉传感器,并将其用于构建具有荧光强度差异的超灵敏逻辑门。本研究为设计应用于检测气体或小分子的新型AIE 荧光材料提供了新思路。
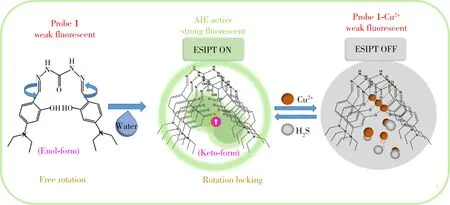
图1 探针1的检测机理示意图Fig.1 Proposed detection principle for the probe 1
1 实验部分
1.1 仪器与试剂
质谱数据由高分辨率质谱(HRMS)仪器Ultra flex TOF/TOF(德国布鲁克)记录,1H NMR 和13C NMR数据在ANAVCE III HD NMR 波谱仪(德国布鲁克)上测得,荧光光谱由Cary Eclipse 分光光度计(美国珀金埃尔默)记录,SEM 图像由JSM-7500F 显微镜(日本电子)获得,使用TU-1901 分光光度计(北京普析)记录样品的紫外吸收光谱。
4-乙酰氨基苯甲醛、碳酸肼、NaHS(作为H2S 的供体)购于阿拉丁化学试剂公司,乙醇、二甲基亚砜(DMSO)购于天津科密欧试剂有限公司。所有试剂均为分析纯,实验用水为超纯水。
1.2 合成过程
合成路线见图2。将碳酰肼(5 mmol,0.45 g)和4-乙酰氨基苯甲醛(10 mmol,1.93 g)溶于乙醇(25 mL)中,加入几滴乙酸作为催化剂,反应混合物在82 ℃下搅拌8 h。反应结束后冷却,纯化、蒸干,得到黄色固体颗粒(1.42 g,产率73%)。1H NMR(600 MHz,CDCl3)δ(ppm):δ10.36(s,1H),8.20(s,1H),7.33(s,1H),6.24(dd,J=8.8 Hz,1H),6.11(d,J=2.3 Hz,1H),3.34(dd,J=14.0 Hz,4H),1.11(t ,J= 7.0 Hz,6H)。13C NMR(400 MHz,CDCl3)δ(ppm):δ150.04(s,1H),107.85(s,1H),104.01(s,1H),98.02(s,2H),40.48(d,J= 17.8 Hz,17H),13.03(s,4H)。HRMS(EI):理论值[probe 1+H]+441.531,计算值441.275。
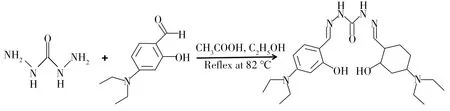
图2 探针1的合成Fig.2 Synthesis route of the probe 1
1.3 测试方法
溶液配制:将探针1 溶解在二甲基亚砜(DMSO)中配制为储备溶液(1.0 mmol/L);NaHS(作为H2S的供体)用超纯水溶解配制成10 mmol/L 的储备溶液;其他竞争分析物如F-、Cl-、Br-、I-、S2-、CH3COO-、PO34-、OH-、ClO-、CO23-、HPO24-、HCO-3、谷胱甘肽(GSH)和同型半胱氨酸(Hcy)均在去离子水中制备为储备液;使用时稀释至所需浓度。
光谱测量:为探究探针1 的光物理性质,在DMSO 和水的混合溶剂(水的体积分数为0%~99%)中测试了探针的荧光光谱和紫外吸收光谱。除特别说明外,所有光谱测试均在DMSO-H2O(1∶9,体积比),pH 7.4(PBS,0.2 mol/L)的水性介质中进行(λex=370 nm,狭缝宽度:5 nm/15 nm)。
1.4 生物成像过程
利用共聚焦显微镜探究了探针1 在HeLa 细胞中外源性H2S 的检测与生物荧光成像中的应用。首先在37 ℃,5%CO2条件下,于DMEM 培养基中接种HeLa 细胞并培养24 h,再将探针1 和探针1+Cu2+分别加入HeLa 细胞的DMEM 培养基中继续培养1 h。将上述HeLa 细胞用PBS(pH 7.4)清洗3 次并进行荧光成像,在加入HS-(作为H2S的供体)后进一步使用PBS(pH 7.4)处理,再次进行荧光成像。
2 结果与讨论
2.1 探针的光学特性
首先,在不同溶剂中测试了探针1 的荧光光谱,如图3A所示,探针1 仅在含有10%DMSO的水溶液中显示出很强的荧光发射。这是由于探针1仅溶于常见的有机溶剂,不良溶剂(水)会诱导其产生聚集,导致荧光增强。探针1 在不同比例的DMSO和水的混合溶剂中的荧光光谱显示(图3B),随着混合溶剂中水体积分数的增加,探针1 在500 nm处的荧光强度逐渐增强,呈绿色荧光。当水的体积分数达到90%时,探针1的荧光强度最大,是其在纯DMSO溶剂中荧光强度的60倍(图3C),当水的体积分数超过90%时,荧光强度有所降低,可能的原因是当混合溶剂中水的含量比较高时,导致溶液聚集成较大的颗粒使荧光强度有所降低。以上结果均说明探针1表现出良好的AIE特性。
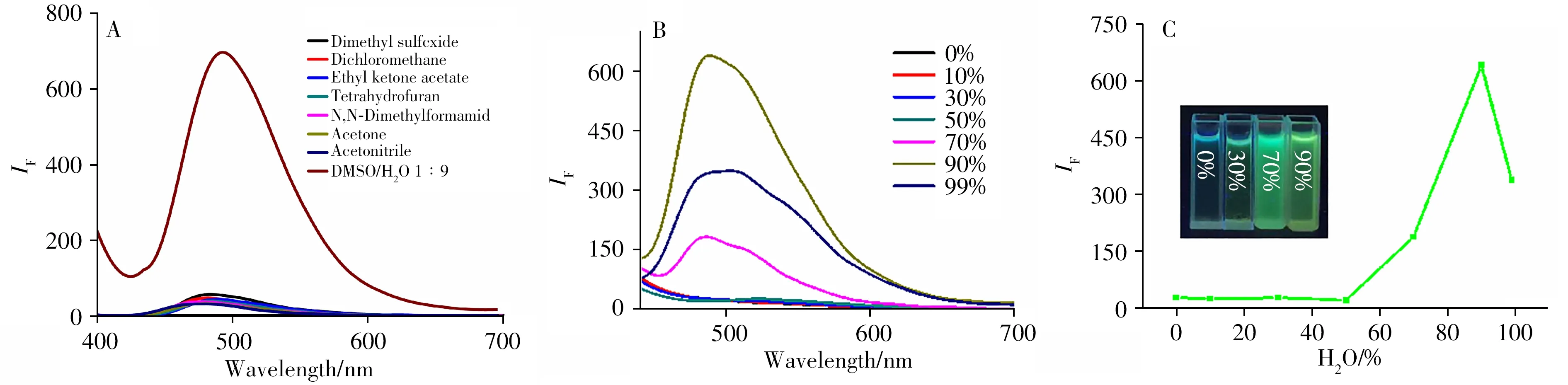
图3 探针1在不同有机溶剂中(A)及在不同比例的DMSO和水的混合溶剂中(B)的荧光光谱;探针1在DMSO中的发射强度与H2O体积分数(%)的函数关系(C)Fig.3 The fluorescence spectra of the probe 1 in different organic solvents(A)and in mixed solvent with different ratios of DMSO and water(B);the emission intensity of the probe 1 in DMSO as a function of H2O(%)(C)inset:the fluorescence photograph by a 365 nm UV lamp
以硫酸奎宁(0.1 mol/L 硫酸溶液,ΦF=0.56)为参照物,测量了探针1 在纯DMSO 溶剂和混合溶剂DMSO-H2O(1∶9)中的量子产率,基于以下公式进行计算:Φx=Φst(Ix/Ist)(η2x/η2st)(Ast/Ix)(x、st分别为被测物质和参照物;Φ、I、A、η分别为量子产率、荧光积分面积、吸光度和溶剂折射率)。结果表明,探针在混合溶剂DMSO-H2O(1∶9)溶液中的相对量子产率(0.532)明显高于纯DMSO(0.065)。
通过扫描电子显微镜对探针的形貌进行表征,如图4 所示,随着混合溶剂中水体积分数的增加,探针1的形态从片状变为堆叠簇状,这表明不良溶剂(水)诱导探针发生聚集,导致荧光增强。探针1的分散粒径图也证实了其AIE 特性,如图5A 所示,纯DMSO 中探针的粒径非常小,然而随着水体积分数的增加其粒径显著增大,这说明探针1发生了聚集。

图4 探针1(20 μmol/L)在不同混合溶剂中的SEM形貌图像Fig.4 SEM images of the probe 1(20 μmol/L)in different mixed solvent A-C:water content were 0%,50%,99%,respectively
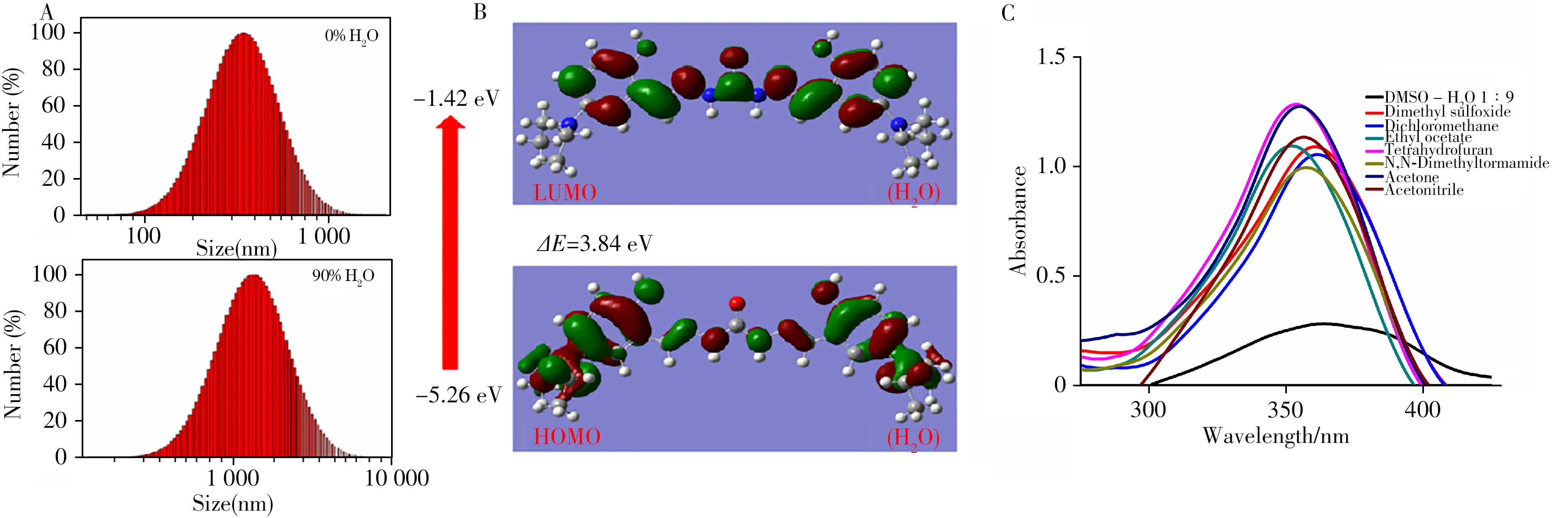
图5 探针1在纯DMSO和混合溶剂(DMSO-H2O,1∶9)中的DLS分析(A);探针1在水溶液中的电子云轨道图(B);探针1在不同有机溶剂中的紫外吸收光谱(C)Fig.5 The DLS analysis of the probe 1 in pure DMSO and in mixed solvent(DMSO-H2O,1∶9)(A);the electronic cloud orbital diagrams of the probe 1 in aqueous solution(B);the UV absorption spectra of the probe 1 in different organic solvents(C)
从探针分子结构分析,探针的AIE 特性可能归因于ESIPT 和RIR 效应。探针分子本身具有高度平面的刚性结构,在DMSO-H2O(1∶9)混合溶剂中,探针中的邻羟基和羰基分别作为供体和受体形成氢键[17-18],一方面激活了ESIPT[19];另一方面,探针1 的刚性和π 共轭进一步增强,探针分子旋转受限,无辐射消耗能量,荧光增强。
为进一步探究探针AIE 特性的发光机理,采用Gaussian 09 程序包,使用B3LYP/6-31G 基组基于DFT 计算方法对探针1 和探针1 + Cu2+进行结构优化。结果显示(图5B)探针1 中最高占据分子轨道(HOMO)的电子密度位于苯环和乙氨基上,最低未占据分子轨道(LUMO)的电子云位于水杨醛和碳酰肼上,这说明邻羟基和苯基与亚氨基部分的吸电子作用导致分子内电荷从苯乙胺基团转移到邻羟基和苯基。电子云密度的这种变化与探针1 的紫外吸收光谱(图5C)变化一致,即探针1 在DMSO-H2O(1∶9)混合溶剂中的吸收峰相较于纯有机溶剂中明显减弱,这归因于分子聚集态光散射。
2.2 探针1+Cu2+对H2S的传感性能及机理研究
探针1是典型的席夫碱化合物,含有N、C和O 等结合位点,是潜在的金属离子螯合剂[20]。通过光谱测试观察探针1与各种金属离子的结合情况(图6A),发现探针1(20 μmol/L)的荧光仅能被Cu2+猝灭。随着Cu2+浓度的增加,探针1 的荧光强度逐渐减弱并在Cu2+浓度为20 μmol/L 时达到荧光猝灭平衡(图6B),表明探针1 与Cu2+的结合比例为1∶1,猝灭率为85%,这说明探针1 能选择性地与Cu2+络合。通过等摩尔连续变化法(Job's-Plot)(图6B 插图上图)进一步证明了探针1 与Cu2+以1∶1 的方式配位结合。从1H NMR 谱(图7)可以推测其结合机理:探针1 在水溶液中易形成氢键,激发ESIPT 效应使其结构刚性增强,荧光发射增强。加入Cu2+后,探针1 与Cu2+结合,羟基的H1(10.37)消失,胺的H2 向高场移动,苯环对应的7.33 ~6.11 处的氢有小幅移动,表明羟基和胺基的氮原子参与了与Cu2+的结合,导致分子内氢键破坏,限制了ESIPT 过程从而使荧光猝灭。再添加HS-后,Cu2+与HS-具有更强的结合力,使H2又移回低场,ESIPT效应重新恢复,荧光发射恢复增强。
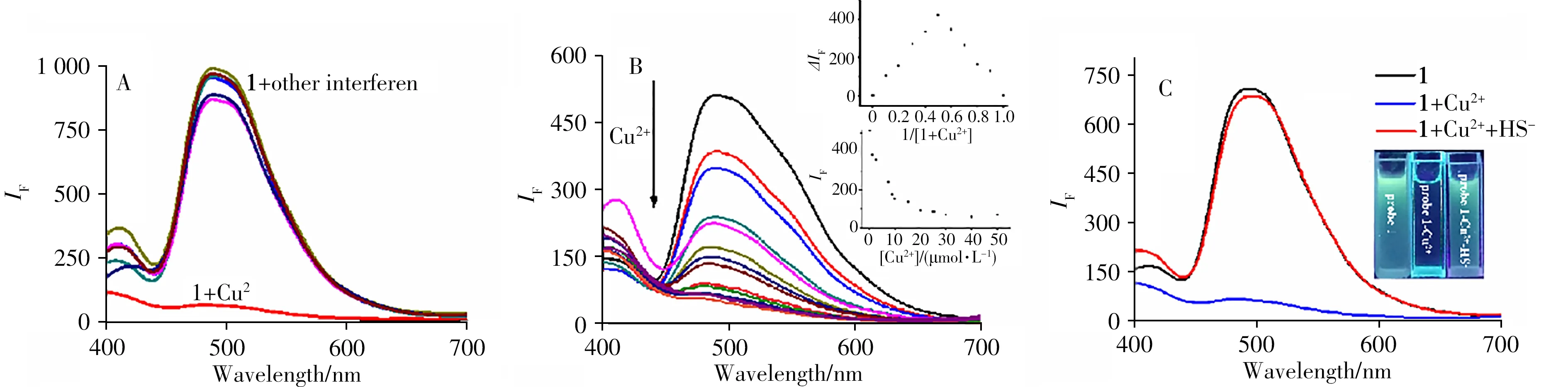
图6 在PBS缓冲溶液中加入各种离子后探针1的荧光光谱(A);添加Cu2+离子后探针1的荧光“关闭”(B);探针1、探针1+Cu2+、探针1+Cu2++HS-在PBS缓冲溶液中的荧光光谱(C)Fig.6 Fluorescence spectra of probe 1 after adding various ions in PBS buffer solution(A);fluorescence“turn off”of the probe 1 with the addition of Cu2+ion(B);the fluorescence spectra of the probe 1,the probe 1+Cu2+,the probe 1+Cu2++HS-in PBS buffer solution(C)inset C:the fluorescence change by a 365 nm UV lamp

图7 探针1、探针1+Cu2+、探针1+Cu2++HS-在DMSO-D6中的1H NMR分析Fig.7 The1H NMR spectra analysis of the probe 1,the probe 1+Cu2+,the probe 1+Cu2++HS-in DMSO-D6
在PBS(pH 7.4)-DMSO(体积比9∶1)中,探针1(20 μmol/L)可发出亮绿色荧光,加入等量Cu2+后,荧光几乎被猝灭。进一步加入HS-,荧光强度明显恢复增强。在365 nm 紫外灯下可以清楚地观察到探针1的荧光变化(图6C)。此外,在相同条件下添加200 μmol/L 的其它竞争分析物(HS-、F-、Cl-、Br-、I-、S2-、CH3COO-、PO34-、OH-、ClO-、CO23-、HPO24-、HCO-3、SO23-、HSO-3、GSH、Hcy),体系荧光几乎没有变化,只有添加HS-后荧光强度明显增强,表明探针1 + Cu2+对HS-具有高度选择性(图8A)。当存在其它竞争分析物时,添加特定量的HS-仍然使得探针荧光增强,证实探针1 具有优良的抗干扰性(图8B)。值得注意的是,I-的存在并不干扰检测,这可能是因为CuS的KS(P沉淀平衡常数)小于CuI的KSP[21]。
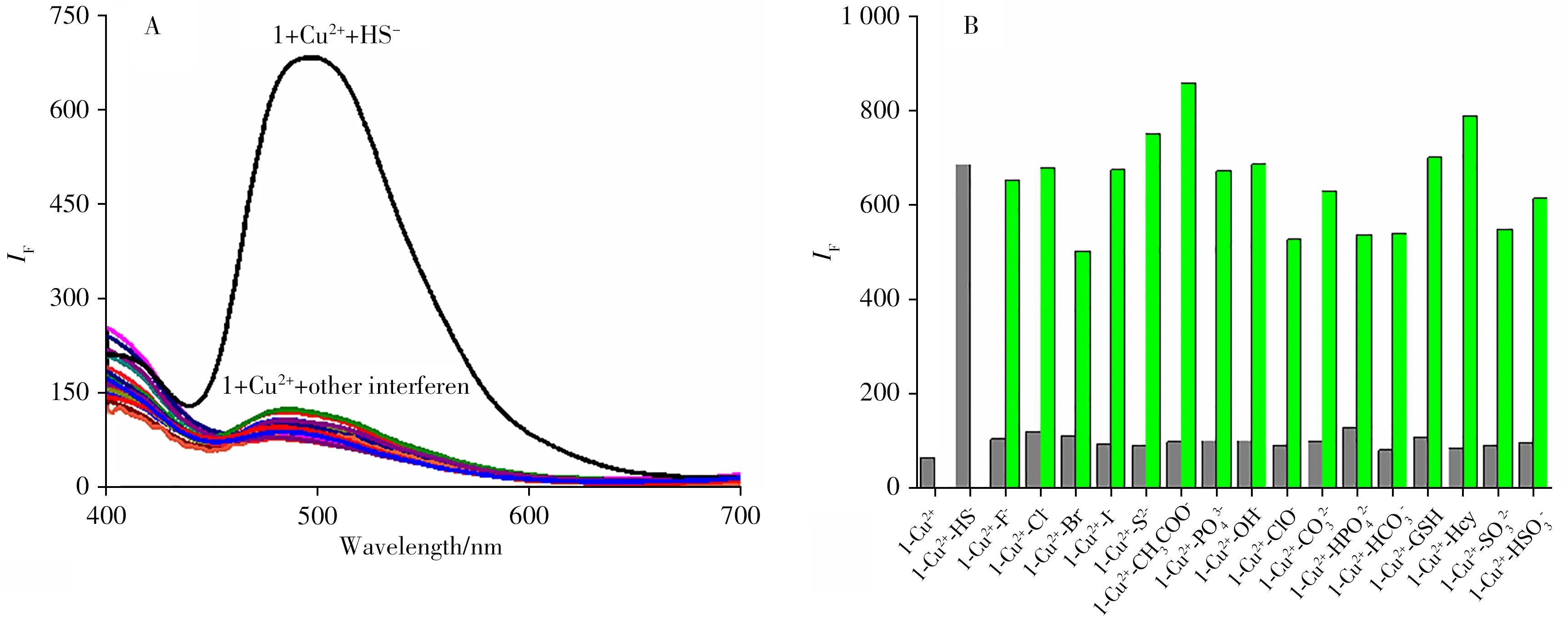
图8 在PBS缓冲溶液中加入各种竞争分析物后探针1+Cu2+的荧光光谱(A);依次添加各种相关竞争分析物以及HS-后探针1+Cu2+在PBS溶液中的发射强度变化(B)Fig.8 The fluorescence spectra of the probe 1+Cu2+with addition of various competitive analytes in PBS buffer solution(A);emission strength changes of the probe 1+Cu2+in PBS solution with sequential adding various relevant competitive analytes and HS-(B)
2.3 探针1+Cu2+对HS-的荧光响应
在PBS(pH 7.4)-DMSO(体积比9∶1)体系中,加入等体积不同浓度的HS-,进行探针1 + Cu2+(20 μmol/L)的荧光滴定实验(图9)。结果显示随着HS-浓度的增加,探针1+Cu2+的荧光强度在HS-浓度0~25 μmol/L 内呈线性增强,线性方程为y=23.32x+99.77,相关系数r2=0.991 8。根据公式D=3σ/k计算得到检出限为0.27 μmol/L。值得一提的是,将HS-加入探针1+Cu2+后,在30 s 内500 nm 处的荧光强度逐渐增强并趋于稳定,说明探针1 具有快速实时灵敏检测HS-的优势。目前能够快速实时检测H2S的荧光探针鲜少报道(表1)。

表1 与检测H2S 的其他荧光探针的比较Table 1 Comparison of other probes for H2S detection
2.4 实际应用
2.4.1 H2S 实时检测试纸的制备基于探针1 对H2S 的快速灵敏检测,制备了简单、便携、经济的检测试纸。将空白滤纸浸泡在探针1 + Cu2+(0.2 mmol/L)的PBS(pH 7.4)-DMSO(体积比9∶1)溶液中,在室温下自然干燥,然后浸泡在含有不同浓度H2S(0、 0.05、 0.10、 0.15、 0.20、 0.30、 0.40、0.50 mmol/L)的溶液中。随着H2S 浓度的增加,在365 nm 紫外灯下,观察到检测试纸荧光明显从无色(由于白色滤纸在紫外灯照射下而呈现蓝色)变为绿色(图9)。基于此方法,通过荧光图像和智能电子设备扫描,可制造视觉传感器并用于H2S的实时在线高效检测。
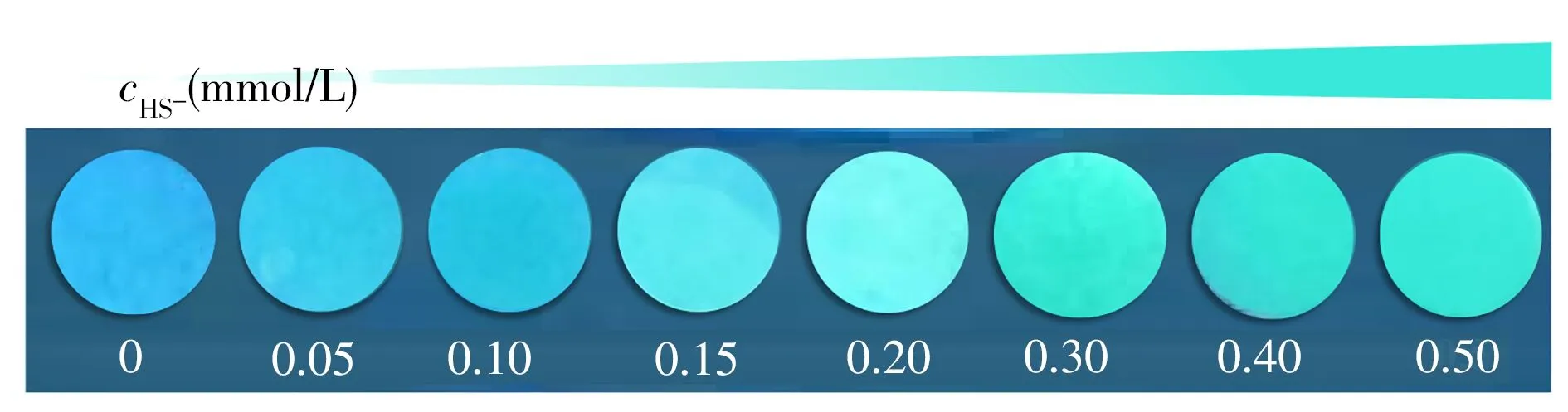
图9 基于探针1的H2S检测试纸的荧光图片Fig.9 The fluorescence photo of the filter paper based the probe 1 to detect H2S
2.4.2 探针1 + Cu2+检测实际酒液样品中的H2S据报道,H2S 不仅会影响白酒质量,甚至会导致白酒变质。采用探针1检测酒中的H2S浓度。酒液样品从临汾便利店购买。将样品稀释100倍,即可制备DMSO-酒(1∶9,体积比)溶液。将探针1+Cu2+添加到处理过的实际样品中,添加不同浓度的H2S(分别为0、5.00、10.00 μmol/L)。如表2所示,所有样品中均检测到H2S,包括白酒(1.24 μmol/L)、苹果酒(5.05 μmol/L)、啤酒(1.73 μmol/L)。根据标准回收方法,3 种样品的回收率为95.2%~113%,表明探针1可用于实际酒液样品中H2S的检测。

表2 白酒、苹果酒和啤酒中H2S含量的测定Table 2 Detection of H2S levels in spirit,cider and beer
2.4.3 生物荧光成像首先,通过3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物(MTT)实验评估探针1的细胞毒性。以正常细胞为对照,将探针1与细胞孵育20 h以上,细胞存活率超过85%,表明探针1对细胞的毒性非常低,可进一步用于细胞成像。HeLa细胞与探针1(50 μmol/L)孵育1 h后,在共聚焦显微镜下呈现亮绿色荧光。将上述HeLa 细胞立即与Cu2+(50 μmol/L)孵育1 h,细胞内荧光消失,表明探针1的荧光强度因探针1与Cu2+的结合而猝灭。为检测细胞内的H2S,在上述细胞中加入50 μmol/L HS-,于显微镜下观察到亮绿色的细胞内荧光(图10)。由于生物体内的内源性H2S 均来源于半胱氨酸蛋白水解酶或其衍生物,因此将生物硫醇抑制剂N-乙基马来酰亚胺(NEM,50 μmol/L)加入上述细胞中作为对照,结果发现细胞荧光消失,进一步证实细胞内的硫醇被NEM 抑制和破坏。以上结果表明探针1可以选择性地检测细胞中的外源性硫化氢。
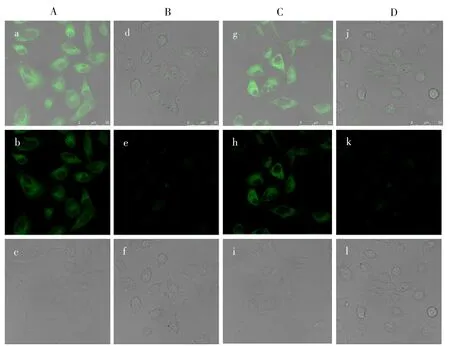
图10 活HeLa细胞与探针1(A)、探针1+Cu2+(B)、探针1+Cu2++HS-(C)、探针1+Cu2++HS-+NEM(D)的荧光成像Fig.10 The fluorescence imaging of living HeLa cells incubated with the probe 1(A),the probe 1+Cu2+(B),the probe 1+Cu2++HS-(C),the probe 1+Cu2++HS-+NEM(D)light field images(a,d,g,j);fluorescence images(b,e,h,k);overlay images(c,f,i,l)
2.5 逻辑门的设计与应用
基于探针1 检测H2S 的优越性,将探针1 应用于逻辑门领域。设置两个输入信号:H2S(input 1)和HSO-3/SO2-3/S2-(input 2),探针1 在500 nm 处的荧光信号被定义为输出信号。共进行4 种不同的设置(图11):H2S 存在(赋值1),但HSO-3/SO2-3/S2-不存在(赋值0);H2S 存在,HSO-3/SO2-3/S2-存在;H2S 不存在,HSO-3/SO2-3/S2-不存在;H2S 不存在,HSO-3/SO2-3/S2-存在。当(input 1,input 2)为(1,0),(1,1)时,550 nm 处的输出发射强度为“1”;当(input 1,input 2)为(0,1),(0,0)时,550 nm 处的输出发射强度为“0”,说明H2S是唯一能激活探针1荧光发射的因素。
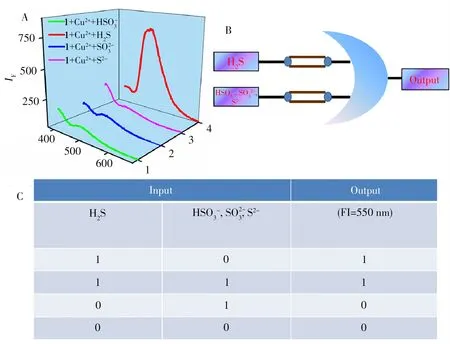
图11 探针1+Cu2+加入S2-、SO23 -、HSO-3、H2S后的荧光光谱(A);两个输入系统的逻辑门行为(B);逻辑门的真值表(C)Fig.11 The fluorescence spectra of the probe 1+Cu2+upon addition of S2-,SO2 -3 ,HSO-3,H2S(A);logic gate behavior from two input systems for constructed(B);the truth table for the logic gate(C)
3 结 论
本文基于聚集诱导荧光增强以及ESIPT 效应设计了一种新型活性探针1,并将其用于H2S的高灵敏度、选择性检测。首先对探针1 的光化学性质及其发光机理进行了详尽地讨论,并将该探针成功应用于酒液样品中H2S 以及活HeLa 细胞中外源性H2S 的检测,同时将其用于构建逻辑门。基于探针的灵敏性,设计了简单便携的H2S检测试纸。该研究为设计基于AIE的新型气体分子传感器提供了新思路。
