一株高产胞外多糖降血糖副干酪乳杆菌JY062(TD062)的黏附性与耐受性评价
2022-05-19张宇赵家源郑佳鹏满朝新姜毓君
张宇,赵家源,郑佳鹏,满朝新,姜毓君
(东北农业大学 食品学院乳品科学教育部重点实验室,哈尔滨150030)
0 引言
乳酸菌是一种重要的益生菌资源,其广泛存在于自然界和发酵乳制品中。乳酸菌具有丰富的物种多样性和功能性,副干酪乳杆菌作为代表性的乳酸菌,在食品、药品、畜牧业、基因工程等多个领域被广泛研究和应用。其广泛的益生功能被大量研究和临床所证实,如缓解乳糖不耐症、调控宿主肠道微生态、参与并调控宿主代谢、抵抗致病菌增强免疫力等[1]。每日补充性的摄入含乳酸菌的食物或乳酸菌制剂越来越被消费者接受,但乳酸菌持续发挥益生功效主要依赖于其在肠道内长期稳定的定植[2]。一般来说,口服摄入的乳酸菌主要有两个去向:一部分随胃肠道消化蠕动或肠上皮细胞脱落排出体外;另一部分黏附在肠道某些部位成功定植[3]。乳酸菌定植肠道最直接的作用是为宿主肠道提供生物屏障,增强肠屏障功能[4]。黏附作为乳酸菌定植肠道的前提,黏附率是开发具有肠道定植潜力菌株的重要参考指标,同时也是乳酸菌益生特性之一。现有的研究揭示了黏附主要涉及到特异性黏附素和非特异性黏附素的作用,其中,胞外多糖是乳酸菌在生长过程中产生的一种重要的特异性黏附素[5]。Zivkovic等人通过对比原生型产胞外多糖副干酪乳杆菌菌株和基因突变型不产胞外多糖副干酪乳杆菌菌株对Caco-2细胞的黏附率差异,证实了胞外多糖在肠道黏附中的作用[6]。胞外多糖不仅参与菌体结构构成,还是研究广泛的后生元之一。研究表明胞外多糖具有调节机体免疫、优化肠道菌群构成、抑制致病菌生长、抗氧化、降血糖等多种益生功效[7]。同时,在食品加工中,胞外多糖因其独特复杂的分子结构,可以赋予食品特殊优良性状,改善食品质地[8]。乳酸菌不仅可以依靠黏附素达到定植的效果,其菌株自身的对胃肠液的耐受性是其基本的益生特性,乳酸菌依靠自身对肠道环境的耐受性,通过胃肠道的一系列物理和化学障碍到达肠道并在肠道中定植。因此,一株良好的功能性益生菌对宿主发挥有益作用的前提是能够对模拟的人胃肠道条件具有良好的耐受性。
II型糖尿病(T 2DM)是一种发病机制较复杂的慢性代谢紊乱性疾病,以胰岛素抵抗和胰岛细胞损伤导致的慢性高血糖为主要特征[9]。传统的糖尿病药物(如双胍类、α-葡萄糖苷酶抑制剂等)成本高,毒副作用大,还伴随不同程度的不适症状,不适合长期服用[10]。因此寻找新型的经济安全的糖尿病药物具有重要意义。近年来,利用乳酸菌进行糖尿病的预防与治疗,不仅可以发挥乳酸菌本身的降血糖作用,同时还可以发挥乳酸菌其他的益生功能,对人体健康具有重要意义[11]。抑制α-葡萄糖苷酶的活性是调控糖尿病的主要方法之一,因此乳酸菌可能是通过抑制α-葡萄糖苷酶活性从而发挥调节血糖的功能作用,所以体外具有高α-葡萄糖苷酶抑制活性的乳酸菌将是潜在的辅助抗糖尿病的益生菌株。
本研究以分离自西藏传统发酵乳制品的副干酪乳杆菌JY062(原副干酪乳杆菌TD062)为试验菌株,通过胞外多糖产量测定,比较无胞外多糖菌株、有胞外多糖菌株对Caco-2细胞黏附性测定以及其对α-葡萄糖苷酶抑制活性的测定,综合各项测定指标确定副干酪乳杆菌JY062是一株高产胞外多糖,且具有高黏附性能的降血糖功能性副干酪乳杆菌菌株,为安全、高效、无副作用的新型功能性产品的开发与研制提供理论参考。
1 材料与方法
1.1 材料与仪器
1.1.1 试验菌株
从西藏传统发酵乳中分离出的副干酪乳杆菌JY062(原副干酪乳杆菌TD 062),保存于东北农业大学乳品科学重点实验室。Caco-2细胞保存于东北农业大学乳品科学重点实验室。
1.1.2 试剂与设备
MRS肉汤培养基、MRS琼脂培养基,青岛海博生物技术有限公司;α-葡萄糖苷酶、对硝基苯-α-D-葡萄糖吡喃苷(PNPG)、小牛血清、青霉素、链霉素、ConA液、无菌Hank's液、Tris-HCL缓冲液,北京索来宝生物科技有限公司。
冷冻高速离心机,德国Sigma有限公司;振荡器,瑞士Mettler Toledo有限公司;加样枪,美国Thermo公司;二氧化碳培养箱,上海龙跃仪器设备有限公司;酶标仪、分光光度计,美国Molecular Devices公司;超净工作台,北京东联哈尔仪器有限公司;高压灭菌器,山东博科BIOBASE有限公司;低温冰箱,美国Kaltis Merit有限公司;电子天平,瑞士梅特勒-托利多有限公司。
1.2 实验方法
1.2.1 副干酪乳杆菌胞外多糖产量的测定
37℃培养条件下,试验菌株在MRS肉汤培养基中培养24 h,在容量为1.0 L的三角瓶子中进行分批发酵,接种物的初始密度约为1.5×109CFU/mL,接种物浓度为5.0%。粗胞外多糖按照水提醇沉法[12]进行提取,采用三氯乙酸去除蛋白的方法[13]进行纯化,将去除蛋白的胞外多糖重悬于去离子水中,透析72 h(分子截流量为:12 000~14 000 u)。将上清液冻干,获得胞外多糖样品。然后对冻干后的胞外多糖样品进行称重,并用苯酚-硫酸法测定副干酪乳杆菌JY062胞外多糖中的多糖含量。
1.2.2 菌株对肠道黏附力的测定
(1)Caco-2细胞培养。将液氮保存的Caco-2细胞取出,使用含20%胎牛血清且含双抗的细胞培养液(过滤除菌)复苏细胞,在37℃温度条件下,5%CO2培养箱中至细胞培养瓶中聚合度达到80%,随后加入1 mL胰酶消化终止贴壁,收集细胞以105cells/mL的浓度接种于六孔板,加入含双抗细胞培养液继续孵育,每2天换一次液,在黏附试验前24 h将培养液换为无双抗培养液,当细胞培养至铺满细胞瓶状态时即可进行黏附试验。
(2)菌株黏附力测定。参照张紫薇的方法进行黏附试验[14],首先收集活化两代,生长至对数末期的副干酪乳杆菌JY062的菌泥,4℃温度条件下,12 000g,离心5 min,然后重悬于无双抗的细胞培养液中,调整菌液浓度为108CFU/mL备用。倒掉细胞六孔板中的培养液,加入含菌的细胞培养液,37℃条件下,5%CO2的培养箱中共培养2 h后使用无菌PBS缓冲液洗涤3次六孔板以除去未黏附的乳酸菌,加入胰酶消化收集贴壁细胞,迅速进行梯度稀释涂布,计数并计算黏附率。对照组是经PBS清洗掉胞外多糖的副干酪乳杆菌JY062的菌泥,黏附率公式如下:

其中,Nt为黏附后的活菌数,N0为初始活菌数。
1.2.3 体外降血糖活性的测定
将副干酪乳杆菌JY062以5%接种量接种到普通MRS液体培养基中,传代2次,37℃,18 h,在4℃,6 000g条件下离心8 min,吸取部分上清液,在无菌条件下用0.22μm的滤膜过滤,获得无细胞上清液。按照Zeng的方法[15]略加改动进行体外降血糖效果评价。首先将50μL的样品和100μL,1 U/mLα-葡萄糖苷酶溶液混匀,37℃孵育10 min,然后向混合物中加入50μL,5 mmol/L的PNPG溶液,混匀后,37℃反应5 min,用酶标仪测定405 nm处的吸光度。每组试验设置3个平行。其中,样品的吸光度用样品空白对照(体系中用100μL PBS(p H 6.8)代替α-葡萄糖苷酶)的吸光度进行校准。阴性对照(体系中无抑制α-葡萄糖苷酶的样品)用50μL PBS(p H 6.8)代替样品,阴性空白对照(体系中没有α-葡萄糖苷酶活性)用50μL PBS(p H值6.8)代替样品,100μL PBS(p H 6.8)代替α-葡萄糖苷酶。α-葡萄糖苷酶抑制率的计算公式为:
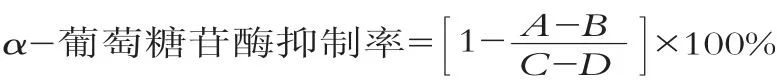
其中,A为待测菌反应组的吸光度值;B为待测菌对照组的吸光度值;C为空白反应组的吸光度值;D为空白对照组的吸光度值。
1.2.4 体外耐受性评价
1.2.4.1 消化道环境耐受性-耐酸性
将鉴定纯化后的副干酪乳杆菌JY062按照3%的接种量接种至MRS液体培养基中,37℃,培养18 h(对数生长后期)。4℃,12 000g,离心5 min,吸出上清液获得菌泥,随后用无菌PBS缓冲液洗涤菌泥3次并重新悬浮缓冲液中。吸取菌悬液以3%的接种量接种于p H值为3.0的无菌液体MRS培养基,充分混匀,37℃恒温培养箱培养至0、1、2和3 h时,再次混匀,分别吸取100μL菌液进行梯度稀释,随后取各梯度的稀释液分别在无菌固体MRS培养基上均匀涂布,37℃,培养48 h后取菌落数在30~300 CFU之间的平板精准计数。存活率计算公式如下:

其中Nt为各时间点的菌落数,N0为初始点的菌落数。
1.2.4.2 消化道环境耐受性-耐人工胃肠液
分别配制人工胃液和肠液:将胃蛋白酶溶于p H为3.0的PBS无菌缓冲液,调整胃蛋白酶浓度为3 g/L,为模拟胃液;将胰蛋白酶溶解于p H为8.0的PBS无菌缓冲液,调整胰蛋白酶浓度为1 g/L,为模拟肠液。随后,分别使用无菌滤膜(0.22μm)将模拟肠液和模拟胃液过滤除菌待用。菌悬液的处理和制备仍参考1.1耐酸性试验步骤,吸取菌悬液以3%的接种量接种于模拟胃液并混匀,37℃培养,分别于0、1、2和3 h时取100μL的菌液进行稀释涂布,计算存活率。随后吸取1 m L培养至3 h的菌-胃液,加入9 m L无菌模拟肠液中混匀,37℃培养,并分别于1、3、5和8 h时吸取100μL菌液用于稀释涂布,计算存活率。存活率计算公式同1.2.4.1公式。
1.2.4.3 耐胆盐
参考1.2.4.1耐酸性试验的步骤,收集副干酪乳杆菌JY062的菌泥,经洗涤后悬浮在无菌PBS缓冲液中。吸取菌悬液以3%的接种量接种于含0.3%胆酸盐的无菌液体MRS培养基中并充分混匀,37℃恒温培养箱培养至0、1、2、3和4 h时混匀体系,分别吸取100μL菌液进行梯度稀释,计算存活率。存活率计算公式同1.2.4.1公式。
1.2.5 实验数据统计
所有试验数据均使用SPSS软件进行单因素方差分析,使用Origin软件、Excel软件和GraphPad Prism 8.02进行绘图分析。试验结果以平均值±标准差(Mean±SD)表示,P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 胞外多糖产量的测定
本试验测定了副干酪乳杆菌JY062(原副干酪乳杆菌TD062)的胞外多糖产量及多糖含量,如表1所示。从表中可以看出,分离自西藏传统发酵乳制品的副干酪乳杆菌JY062表现出很好的产胞外多糖的能力,其胞外多糖产量为0.609 g/L。通过相关研究表明,不同乳酸菌产胞外多糖的能力存在明显差异,乳酸菌胞外多糖的产量范围在25~600 mg/L之间[16]。通过对比分析,发现副干酪乳杆菌JY062的胞外多糖产量在合理范围内。通过本研究对比相关研究发现,乳酸菌胞外多糖的产量差异性不仅存在于不同的菌种,还存在于不同的菌株。通过葡萄糖标准曲线(图1)计算副干酪乳杆菌JY062胞外多糖的多糖含量,如表1所示,副干酪乳杆菌JY062的胞外多糖中多糖为90.57μg/mL。
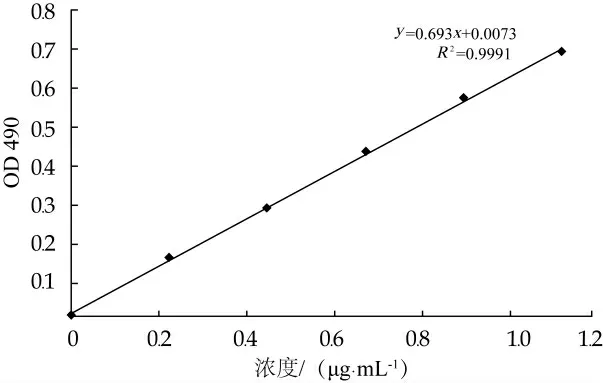
图1葡萄糖标准曲线

表1副干酪乳杆菌JY062(原副干酪乳杆菌TD062)胞外多糖产量及多糖含量
2.2 菌株黏附力评价
如图2所示,副干酪乳杆菌JY062对Caco-2细胞的黏附力。可以看出,未经清洗掉胞外多糖的副干酪乳杆菌JY062对Caco-2细胞的黏附率最高,达到91.2%,清洗掉保外多糖的菌株的黏附性能也较高,黏附率为54.37%。表明副干酪乳杆菌JY062是一株高黏附性菌株,且其分泌的胞外多糖显著提高其黏附性能。乳酸菌在宿主肠道内的黏附定植是其持续发挥益生作用的基础和关键,也是肠道定植工作需要优先考虑的指标之一[17]。这是因为,益生菌在肠道的定植至关重要,益生菌的长期定植可以为宿主提供稳固的生物屏障[18],同时增强肠屏障功能[19]、调节肠道微生态[20]、调节短链脂肪酸等代谢物的产生[21]。且副干酪乳杆菌JY062分泌的胞外多糖能够显著提高其黏附定植的能力,表明该菌株能够以胞外多糖为黏附素,定植宿主肠道,发挥其益生功能作用。
2.3 菌株体外降血糖评价
α-葡萄糖苷酶抑制剂是目前临床治疗T 2DM的常用药物,可通过抑制α-葡萄糖苷酶分解多糖为葡萄糖的作用减缓葡萄糖的吸收速度从而降低血糖水平[22]。而PNPG是一种麦芽糖的类似物,能够被α-葡萄糖苷酶分解为对硝基苯酚,可通过检测对硝基苯酚的吸光度值计算样品中各抑制剂的抑制率[23]。因此,本试验利用PNPG体外评价方法对菌株无细胞上清液的抑制率进行比较,结果如图所示。由表2可以看出,副干酪乳杆菌JY062对α-葡萄糖苷酶具有抑制作用,抑制率达到57.36%,这也说明了副干酪乳杆菌JY062具有体外降血糖能力。张欢欢等人对接入植物乳杆菌ST-III的豆浆溶液的研究中发现其α-葡萄糖苷酶抑制率为35.67%[24],比本试验结果略高。白等人[25]在34株供试菌中筛选出干酪乳杆菌K11、副干酪乳杆菌J5、副干酪乳杆菌G15这3株乳杆菌表现出了与阳性对照组鼠李糖乳杆菌LGG相同的良好抑制α-葡萄糖苷酶的能力。除此之外,有研究证实,活性物质如胞外多糖或γ-氨基丁酸可以降低血糖水平,缓解糖尿病症状[26]。因此初步猜测推测副干酪乳杆菌JY062这种α-葡萄糖苷酶抑制活性可能是由菌株产生的胞外多糖引起的。

图2副干酪乳杆菌JY062(原副干酪乳杆菌TD062)对Caco-2细胞的黏附率

表2副干酪乳杆菌JY062(原副干酪乳杆菌TD062)对α-葡萄糖苷酶的抑制率
综合副干酪乳杆菌JY062胞外多糖的产量、对Caco-2细胞的黏附性能以及对α-葡萄糖苷酶的抑制活性这3项指标,发现副干酪乳杆菌JY062的3项指标都很突出,说明该菌株不但高产胞外多糖,还对Caco-2细胞具有很好的黏附性能,且该菌株具有体外降血糖活性。
2.4 消化道环境耐受性
2.4.1 副干酪乳杆菌JY062的耐酸性
副干酪乳杆菌JY062的耐酸性试验结果见图3,由图3可知,JY062在p H为3.0时,在3个小时的酸刺激下,存活率呈现下降趋势,但经过3个小时的酸刺激菌株仍能保持91.08%的高存活率,这表明副干酪乳杆菌JY 062具有较强的耐酸能力。研究表明,在非空腹状态下,正常人胃液pH在3.0左右,食物在胃中停留时间大约3 h[27]。试验结果显示,副干酪乳杆菌JY062可以适应人体胃部强酸环境。

图3副干酪乳杆菌JY062(原副干酪乳杆菌TD062)耐酸性结果
2.4.2 副干酪乳杆菌JY062的耐人工胃肠液性
副干酪乳杆菌JY062在人工胃肠液环境下的存活率见图4和图5可以看出,经过连续的胃液和肠液消化,副干酪乳杆菌JY062的存活率呈现下降趋势,经3 h的胃液刺激后,菌株的存活率为91.27%,继续转入肠液消化8 h,菌株存活率为80.73%。结果表明,经过长时间的胃肠液消化,副干酪乳杆菌JY062存活率虽然降低,但仍有大部分菌株存活。其中,胃肠液中的胃蛋白酶和胰蛋白酶是主要的影响因素,它们会对菌体蛋白成分产生分解作用,从而破坏菌株蛋白空间结构,丧失生物功能[28]。副干酪乳杆菌JY062可以在消化酶的作用下多数存活,适应胃肠道极端环境。

图4副干酪乳杆菌JY062(原副干酪乳杆菌TD062)耐人工胃液结果

图5副干酪乳杆菌JY062(原副干酪乳杆菌TD062)耐人工肠液结果
2.4.3副干酪乳杆菌JY062的耐胆盐性
胆盐对细菌的结构有一定的破坏,进而抑制细菌的生理活性,菌株对胆盐的耐受能力强弱决定了菌株是否可以在肠道环境中存活,从而发挥其益生功能,研究表明人体小肠中的胆盐浓度一般为0.3%左右[29]。如图6显示的是副干酪乳杆菌JY062在胆盐胁迫下4 h的存活率。可以看出,在持续的胆盐刺激下,副干酪乳杆菌JY062的存活率呈现下降趋势,经过4 h的处理,菌株存活率为85.45%。这表明副干酪乳杆菌对于胆盐有较强的耐受力。

图6副干酪乳杆菌JY062(原副干酪乳杆菌TD062)耐胆盐结果
通过以上模拟人体消化道环境的试验,可以看出,副干酪乳杆菌JY062具有较高水平的环境耐受能力,而这种特性是口服益生菌不可缺少的,尤其是对于在存活状态下发挥益生功能的菌株。这种特性保证了菌株能够抵抗复杂的消化环境,得以存活并长时间发挥其益生功能。
3 结论
本研究通过测定分离自西藏传统发酵乳制品中的副干酪乳杆菌JY062(原副干酪乳杆菌TD062)产胞外多糖的能力、对Caco-2细胞的黏附能力以及PNPG体外降血糖方法,明确了副干酪乳杆菌JY062是一株高产胞外多糖、黏附性能突出,且具有体外降血糖活性的功能性益生菌。进而,模拟人体胃肠道环境,评价副干酪乳杆菌JY062的体外耐受性,发现该菌株具有较高水平的环境耐受能力。因此,副干酪乳杆菌JY062不但可以通过自身对人体胃肠道环境良好的耐受性,定植在人体胃肠道,还可以其自身分泌的胞外多糖为黏附素,提高其在人体胃肠道定植的作用效果,从而发挥其降血糖的功能作用。此研究为安全、高效、无副作用的新型功能性产品的开发与研制提供了理论参考。
