小麦白粉菌产孢相关基因 BgtFTT1的序列特征和基因表达分析
2022-05-18曾凡松史文琦向礼波薛敏峰龚双军杨立军
曾凡松,史文琦,向礼波,薛敏峰,袁 斌,龚双军,杨立军
(1.农业农村部华中作物有害生物综合治理重点实验室,武汉 430064;2.农作物重大病虫草害防控湖北省重点实验室,武汉 430064;3.湖北省农业科学院 植保土肥研究所,武汉 430064)
由禾谷类白粉菌小麦专化型(Blumeriagraminisf.sp.tritici,Bgt)引起的小麦白粉病危害叶片、茎秆和麦穗,影响光合作用和籽粒灌浆,导致产量损失,给小麦生产造成严重威胁。小麦白粉病在中国常年发生面积685万~730万hm2,一般发病田减产5%~10%,重病田减产达20%以上[1]。小麦白粉菌是专性活体寄生真菌,分生孢子是其生活史中无性世代的繁殖体,也是白粉病流行的重要侵染源。禾谷类白粉菌分生孢子降落到叶片上2 h后即可萌发,24 h后可成功侵入小麦,3 d后长出大量菌丝,4 d后在菌丝上形成足细胞,5 d后从足细胞上分化出分生孢子梗,6 d后能产生大量分生孢子,并随气流远距离传播,使病害快速蔓延[2-3]。因此,研究调控白粉菌分生孢子形成基因,将有助于了解白粉菌无性产孢的分子机制,为控制白粉病的流行提供依据。
14-3-3蛋白是一类广泛存在于真核生物中且功能上高度保守的酸性二聚体蛋白,它们在细胞凋亡、信号转导、基因表达调控和蛋白质聚集等生物学过程中发挥重要作用[4-5]。14-3-3蛋白的功能与真菌的生长发育、无性或有性繁殖、初生或次生代谢、对胁迫的响应以及毒性等密切相关,例如酿酒酵母菌(Saccharomycescerevisiae)、球孢白僵菌(Beauveriabassiana)和灵芝(Ganodermalucidum)的Bmh1和Bmh2及其同源蛋白,以及裂殖酵母菌(Schizosaccharomycespombe)的RAD24和RAD25,这些蛋白因缺少催化结构域,主要通过与其他蛋白互作来调控细胞信号转导、基因表达和蛋白质修饰过程[6-10]。蛋白互作研究表明14-3-3蛋白与其他蛋白的互作依赖于特定氨基酸的磷酸化,能与14-3-3蛋白发生特异性互作的蛋白几乎涉及所有细胞过程,这使得14-3-3蛋白成为互作网络的中心节点[11-13]。目前,国内外还没有关于白粉菌14-3-3蛋白结构和功能的相关报道,大麦白粉菌基因组注释发现3个预测的14-3-3蛋白(NCBI 登录号:CCU79787.1、CCU76816.1和CCU78877.1)[14],在小麦白粉菌基因组注释中未发现相关信息[15]。
由于白粉菌是专性活体寄生菌,不能在人工培养基上培养,无法进行遗传转化,导致基因功能研究进展缓慢。本研究采用生物信息学和分子生物学方法对小麦白粉菌1个14-3-3蛋白进行序列分析、功能预测和突变位点检测,对该基因在白粉菌分生孢子形成阶段的表达动态进行监测,为进一步研究该蛋白在小麦白粉菌无性产孢过程中的作用奠定基础。
1 材料与方法
1.1 菌株的保存和扩繁
供试菌株为Bgt21-2,于2011年采自江苏省盐城市,由湖北省农业科学院植保土肥研究所植物病理实验室分离和保存[16]。将小麦材料Chancellor的种子播种在含有营养土的塑料钵(20 cm×20 cm)中,(18±1) ℃、相对湿度70%、72 μmol·m-2·s-1光照16 h、黑暗8 h持续培养10 d。按照Zeng等[16]报道的方法将菌株Bgt21-2接种到小麦材料‘Chancellor’的离体叶段上,(17±1) ℃、72 μmol·m-2·s-1持续光照培养,每12 d扩繁1次。
1.2 14-3-3蛋白编码基因序列的获取
以大麦白粉菌(B.graminisf.sp.hordei)14-3-3蛋白(NCBI登录号为CCU79787.1)为查询序列,在小麦白粉菌菌株96224蛋白质数据库中进行BLASTp搜索(参数设置:E-value=1e-10),获得小麦白粉菌含有的候选14-3-3蛋白。采用BWA软件[17]将菌株Bgt21-2产孢阶段转录组reads[18]匹配到菌株96224基因组[15],用整合的基因组查看软件(IGV)[19]获得覆盖候选蛋白基因开放阅读框(ORF)的cDNA序列。 根据此序列中5′非翻译区和3′非翻译区,采用Primer Premier 6.0 软件设计特异性引物,送上海英骏生物科技有限公司合成。
将菌株Bgt21-2接种到感病品种‘Chanceller’离体叶段上,采用5%醋酸纤维素包埋法[20]在接种后5 d(5 day post inoculation, 5 dpi)取叶表面菌体样品(不含叶组织),液氮速冻,-80 ℃保存备用。采用RNA-iso plus试剂盒(TAKARA, Japan)和PrimeScriptTMcDNA合成试剂盒(TAKARA, Japan)进行总RNA的提取和 cDNA的合成。以上述cDNA为模板和特异性引物进行PCR扩增,获得包含完整ORF的目标基因片段。PCR反应体系50 μL,包括模板DNA 2.5 μL,ddH2O 35.75 μL,10×ExTaqPCR Buffer (TAKARA, Japan)5.0 μL,50 mmol·L-1Mg2+2.50 μL,10 mmol·L-1dNTPs 1.25 μL,上游和下游引物各1.25 μL,ExTaq酶(TAKARA, Japan)0.50 μL。 反应程序为95 ℃, 10 min;40个循环:95 ℃, 10 s; 55 ℃, 30 s; 72 ℃, 2.5 min;72 ℃ 10 min。将扩增产物用Genview DNA回收试剂盒(北京鼎国昌盛生物科技有限公司)纯化后连接到T-easy载体(TAKARA, Japan),并送上海生工生物科技有限公司测序。采用DNAMAN v6.0和NCBI ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)进行序列分析。为检测目标基因在自然群体菌株中的变异,收集菌株分生孢子样品,采用SP真菌DNA提取试剂盒(OMEGA,USA)提取菌株基因组DNA。以基因组DNA为模板,用上述特异性引物进行PCR扩增,PCR程序、产物连接、测序及序列比对方法与cDNA扩增部分相同。
其他物种的14-3-3蛋白质序列均来自NCBI蛋白质数据库。以下生物信息学分析均采用默认参数,自定义参数另行说明。
1.3 蛋白质理化性质和氨基酸序列分析
采用ProtParam软件[21](https://web.expasy.org/protparam/)计算蛋白质的长度、分子质量和理论等电点。采用ProtScale软件[21](https://web.expasy.org/protscale/)对蛋白质的亲水性/疏水性进行分析。分别利用SignalP v5.0 Server[22](http://www.cbs.dtu.dk/services/SignalP/)、BUSCA[23](http://busca.biocomp.unibo.it/)和TMHMM v2.0[24](http://www.cbs.dtu.dk/services/TMHMM/)在线服务器对信号肽、亚细胞定位和跨膜区进行预测。
1.4 蛋白质功能注释和结构分析
采用BLASTp将目标蛋白质序列与GO(Gene Ontology)、SwissProt、KEGG (Kyoto Encyclopedia of Genes and Genomes)、Reactome、NCBI nr蛋白质数据库进行比对,获得蛋白的功能注释。利用SMART在线工具[25]、NCBI保守结构域数据库[26](https://www.ncbi.nlm.nih.gov/cdd)和InterPro数据库[27](http://www.ebi.ac.uk/interpro/scan.html)预测蛋白质保守结构域。采用Motif Scan在线工具[21](https://myhits.sib.swiss/cgi-bin/motif_scan/)进行模体分析。采用I-TASSER蛋白质结构在线预测工具[28]预测蛋白质三级结构和与其他蛋白的互作位点。
1.5 多重序列比对和系统发生树的构建
用BLASTp程序,以目标蛋白质序列为查询序列,在NCBI nr蛋白质数据库中搜索并下载同源序列或者已知14-3-3蛋白质序列进行比对。多比对分析和作图通过Clustal-X v2.0.11软件[29]和DNAMAN v6.0软件实现。利用MEGA v6.0软件[30]和邻接法(Neighbor-Joining method)构建系统发育树,并采用bootstrap法进行检验(1 000次重复)。
1.6 qRT-PCR扩增和表达谱分析
将菌株Bgt21-2接种到小麦材料‘Chancellor’的离体叶段上,根据Yang等[3]报道的方法在3 dpi、4 dpi和5 dpi取叶片进行台盼蓝染色。同时采用“1.2”中描述的方法分别在3个时间点收集叶表面菌体样品,提取总RNA,合成cDNA。每时间点设置3次生物学重复。
采用实时荧光定量PCR技术对BgtFTT1基因在不同发育时间点的相对表达量进行测定。根据目标基因的ORF序列,采用Primer Premier 5.0软件设计特异性引物(表1)。引物序列由上海英骏生物科技有限公司合成。用SYBR GREEN PCR Kit (Life Technologies, USA)配制反应体系。PCR反应程序为:95 ℃, 10 min;40个循环:95 ℃, 10 s; 60 ℃, 30 s; 65~95 ℃收集熔解曲线。PCR反应在ABI 7500 real-time PCR仪上完成,所有PCR样品重复3次。以小麦白粉菌β-微管蛋白基因作为内参基因[20]。分别将4 dpi和5 dpi时的表达量与3 dpi时的表达量进行比较,采用2-ΔΔCT方法[31]计算基因相对表达量。采用student’s t-test进行统计分析。
2 结果与分析
2.1 小麦白粉菌14-3-3蛋白编码基因 BgtFTT1的克隆
在小麦白粉菌96224蛋白质数据库中发现1个14-3-3蛋白(NCBI登录号: EPQ65962.1)。菌株Bgt21-2转录组reads覆盖了菌株96224参考基因组第5染色体的12 863 213~12 865 699 bp之间的区域,且reads覆盖呈连续分布,说明该基因没有内含子存在。以cDNA为模板的特异性PCR 扩增,获得了长度为1 181 bp的cDNA序列。该cDNA两端分别处在5′非翻译区和3′非翻译区,中间跨越1条长度为891 bp的完整ORF序列,与菌株96224中的相应序列完全一致。该基因编码296个氨基酸的蛋白,暂定名为BgtFTT1。
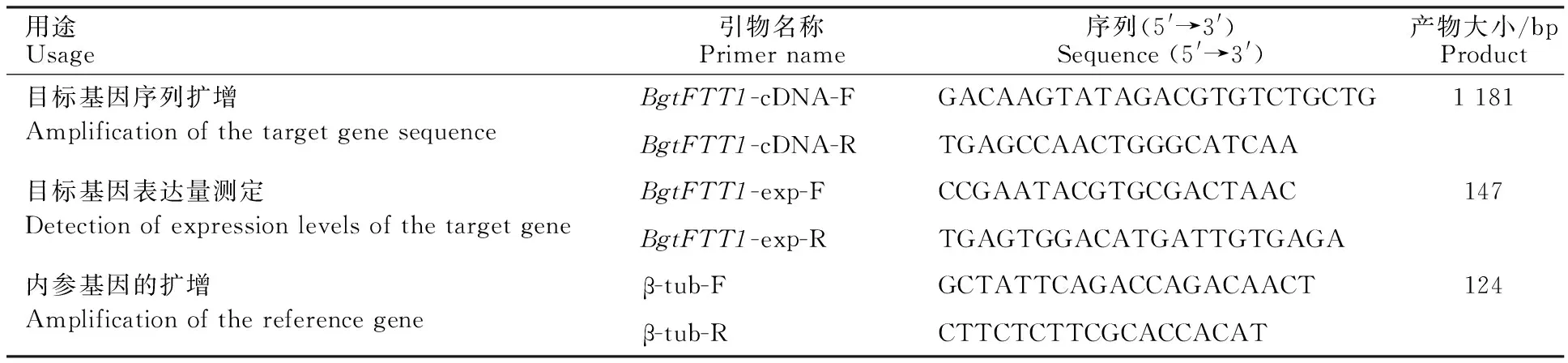
表1 用于 BgtFTT1基因序列扩增和基因表达分析的引物Table 1 Primers used for amplification of BgtFTT1 sequence and its expression analysis
2.2 BgtFTT1蛋白的理化性质分析
BgtFTT1蛋白预测的分子质量为34.18 ku,理论等电点值为8.51,属碱性蛋白质(表2)。 BgtFTT1亲水性氨基酸比疏水性氨基酸多,属亲水性蛋白,序列C端的第269~278位氨基酸残基亲水性最强,其次是靠近N端的第42~50位和第69~77位。

表2 BgtFTT1蛋白生物信息学特征Table 2 Bioinformatic characteristics of BgtFTT1
2.3 BgtFTT1蛋白的序列特征和功能注释
序列分析表明, BgtFTT1不含信号肽和跨膜螺旋,预测的亚细胞定位在细胞质(表2)。BgtFTT1包含5个蛋白激酶C 磷酸化位点、2个酪蛋白激酶Ⅱ磷酸化位点、1个N-酰基化位点、 1个糖基化位点、1个酪氨酸磷酸化位点和1个七残基重复模体(图1)。从大麦白粉菌、山茱萸白粉菌(Erysiphepulchra)和葡萄白粉菌(E.necator)中各找到1个与BgtFTT1同源的蛋白,除七残基重复模体外,11个模体序列在这些14-3-3同源蛋白中均相对保守(图1)。
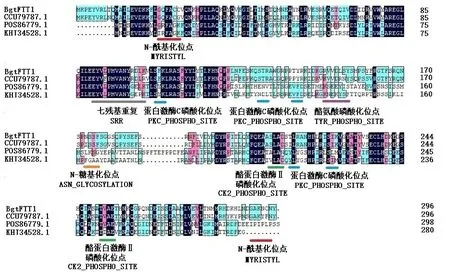
大麦白粉菌、山茱萸白粉菌和葡萄白粉菌14-3-3蛋白NCBI登录号分别为:CCU79787.1、 POS86779.1、KHJ34528.1;红色、桔色、绿色、蓝色、紫色和灰色下划线分别表示N-酰基化位点、N-糖基化位点、酪蛋白激酶磷酸化位点、蛋白激酶C磷酸化位点、酪氨酸激酶磷酸化位点和七残基重复等6种模体的位置
BgtFTT1在GO、KEGG和Swissprot数据库中均未获得其相关注释信息,是一个假定蛋白。BgtFTT1含有保守的14-3-3结构域(位置:第205-277位氨基酸,SMART登录号:SM000101),属于14-3-3蛋白质家族(IPR000308),14-3-3蛋白质超级家族(IPR036815)。从reactome数据库中找到5个与这一蛋白质家族成员功能相关的通路,其中2个通路与Ca2+信号通路有关(R-HSA-111447、R-HSA-5625740),2个通路与糖代谢和能量代谢有关(R-HSA-1445148、R-HSA-5628897),1个通路与细胞周期有关(R-HSA-75035)(表3)。
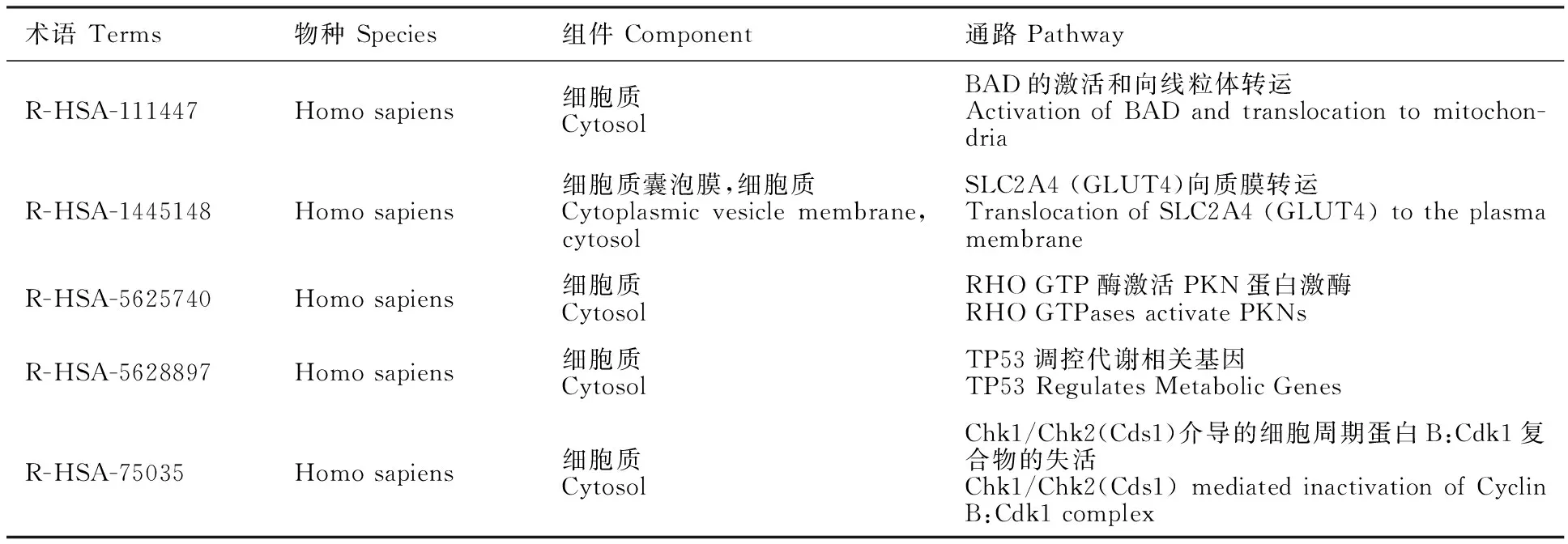
表3 BgtFTT1蛋白在Reactome数据库中的注释结果Table 3 Annotation of BgtFTT1 from the Reactome database
2.4 BgtFTT1蛋白的高级结构分析
二级结构预测结果表明,BgtFTT1包含α-螺旋、无规则卷曲、延伸链和β-转角等4种二级结构。α-螺旋是占比最大的二级结构(51.4%),其次是无规则卷曲(38.2%),占比最小的是β-转角(3.4%)。来自大麦白粉菌等其他白粉菌的同源蛋白均与BgtFTT1存在相似的二级结构特征。其中大麦白粉菌14-3-3蛋白(CCU79787.1)具有与BgtFTT1几乎完全相同的α-螺旋结构(图2)。BgtFTT1整个蛋白呈“球状”(图3-a),其结构与二级结构结果基本一致。配体预测分析结果表明,人(Homosapiens)的14-3-3蛋白ETA与BgtFTT1三级结构相似,能与配体蛋白14-3-3ε(NP_006752.1)发生空间上的互作,形成复合物,大部分结合位点(第40、41、48、108、115、116、225、228、229、232、236、273、276、280、283和284位氨基酸残基)位于C端的α-螺旋区域(图3-b)。将14-3-3ε氨基酸序列与菌株96224蛋白质数据库进行BLASTp比对,结果返回2个推定的14-3-3蛋白(EPQ65210.1和EPQ62128.1),提示这些蛋白可能是候选互作靶标蛋白。
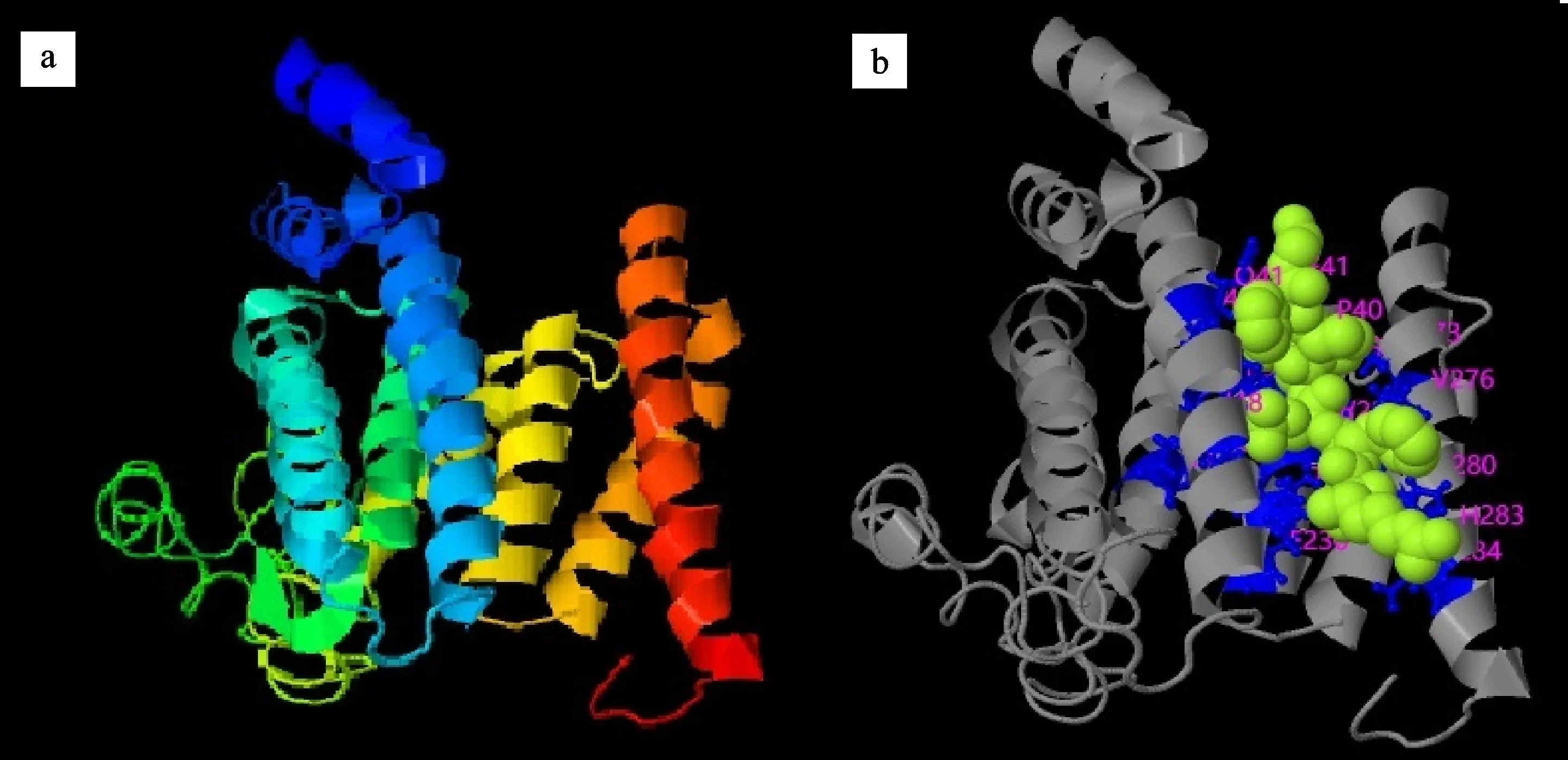
a.BgtFTT1蛋白的三级结构图;b.与BgtFTT1蛋白具有相似三级结构的人类14-3-3蛋白ETA与配体蛋白互作位点图
2.5 BgtFTT1与其他14-3-3蛋白系统进化关系
从其他真菌中选取8个已知功能的典型14-3-3蛋白:BMH1(CAA46959.1,S.cerevisiae)、BMH2(CAA59275.1,S.cerevisiae)、 FTT1(XP_006963731.1,Trichodermareesei)、FTT2(XP_006966399.1,T.reesei)、nfh-2(XP_964462.1,Neurosporacrassa)、rad24(CAA55795.1,S.pombe)、rad25(CAA55796.1,S.pombe)和ArtA(AAK25817.1,Aspergillusnidulans)。将 BgtFTT1与这些蛋白质进行BLASTp比对后没有返回符合条件的结果,说明BgtFTT1与这些蛋白质亲缘关系较远,属于不同的蛋白质家族。
根据BgtFTT1在NCBI nr蛋白质数据库中BLASTp的查询结果,选择14-3-3同源蛋白序列构建系统进化树(图4)。5个白粉菌14-3-3蛋白与灰葡萄孢(B.cinerea)等12个兼营腐生真菌的同源蛋白处于两个不同的分支中。在白粉菌分支中,BgtFTT1(红色方框)与大麦白粉菌的同源蛋白亲缘关系最近,构成1个独立的小分支,与山茱萸白粉菌、葡萄白粉菌和番茄白粉菌的14-3-3蛋白亲缘关系次之。因此,白粉菌14-3-3蛋白与其他真菌14-3-3蛋白的进化距离均较远。
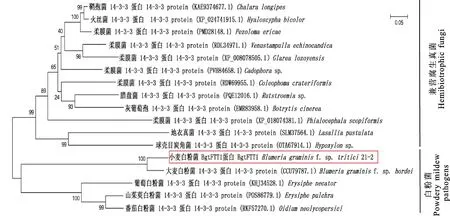
图4 BgtFTT1蛋白系统进化树分析Fig.4 Phylogenetic analysis for BgtFTT1 protein
2.6 BgtFTT1基因在小麦白粉菌自然群体中的变异
对采自全国12个省(自治区)的小麦白粉菌菌株的BgtFTT1基因进行PCR检测,结果表明,8个菌株的BgtFTT1基因ORF中第407位碱基和第644位碱基发生点突变,分别导致蛋白质第136位氨基酸由丙氨酸(A)变为甘氨酸(G),第215位氨基酸由苏氨酸(T)变为异亮氨酸(I),均属于非同义突变,且都在单个菌株中同时出现(表4)。第136位突变位于蛋白激酶C磷酸化位点附近,第215位突变位于蛋白激酶C磷酸化位点中。这两个位点都不属于与配体互作的氨基酸位点(图3)。而且,突变的发生与菌株的地理来源没有明显的相关性。
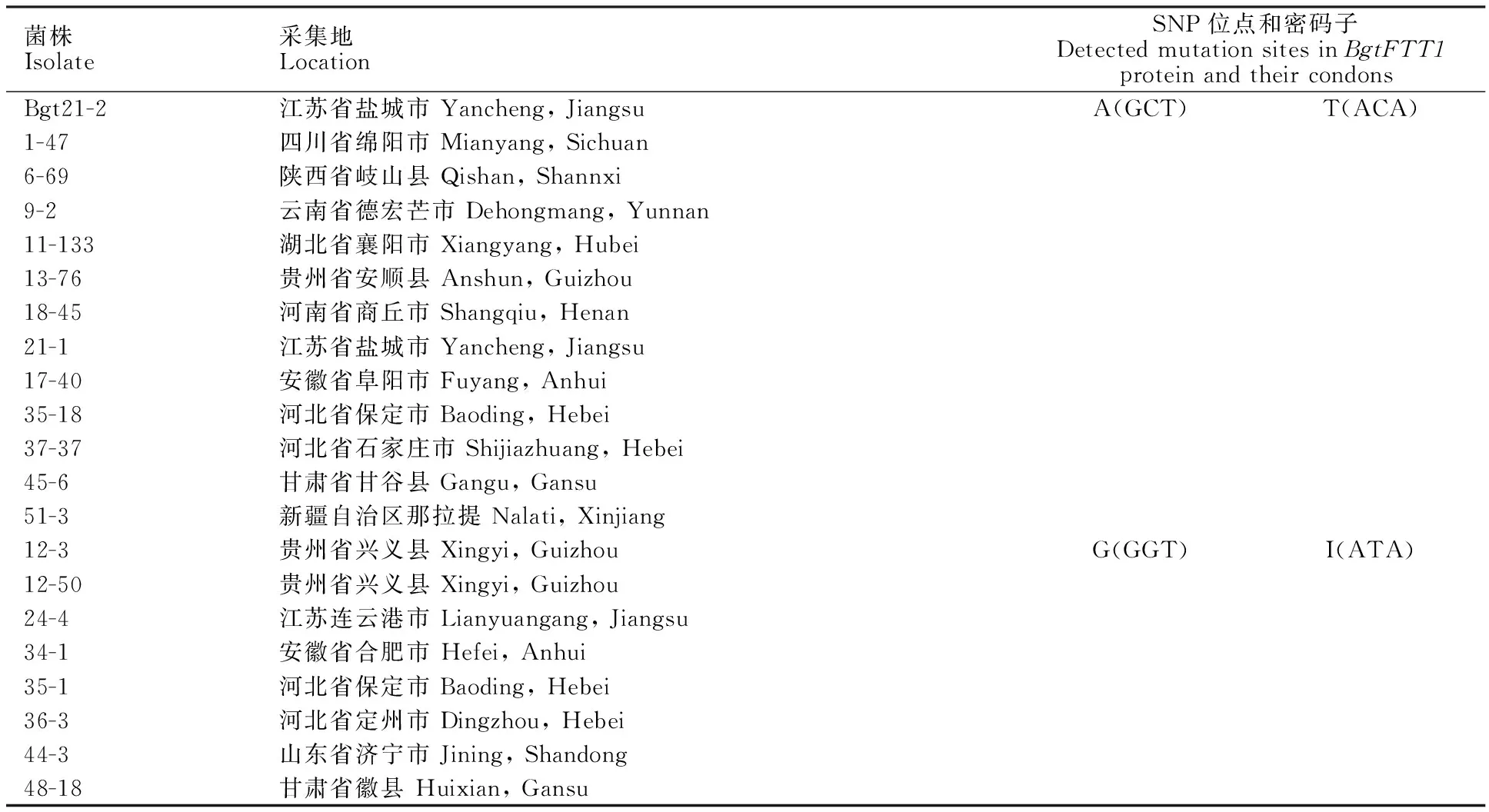
表4 BgtFTT1基因在21个小麦白粉菌菌株中的突变位点检测Table 4 Detection of mutation sites in BgtFTT1 among 21 Bgt isolates
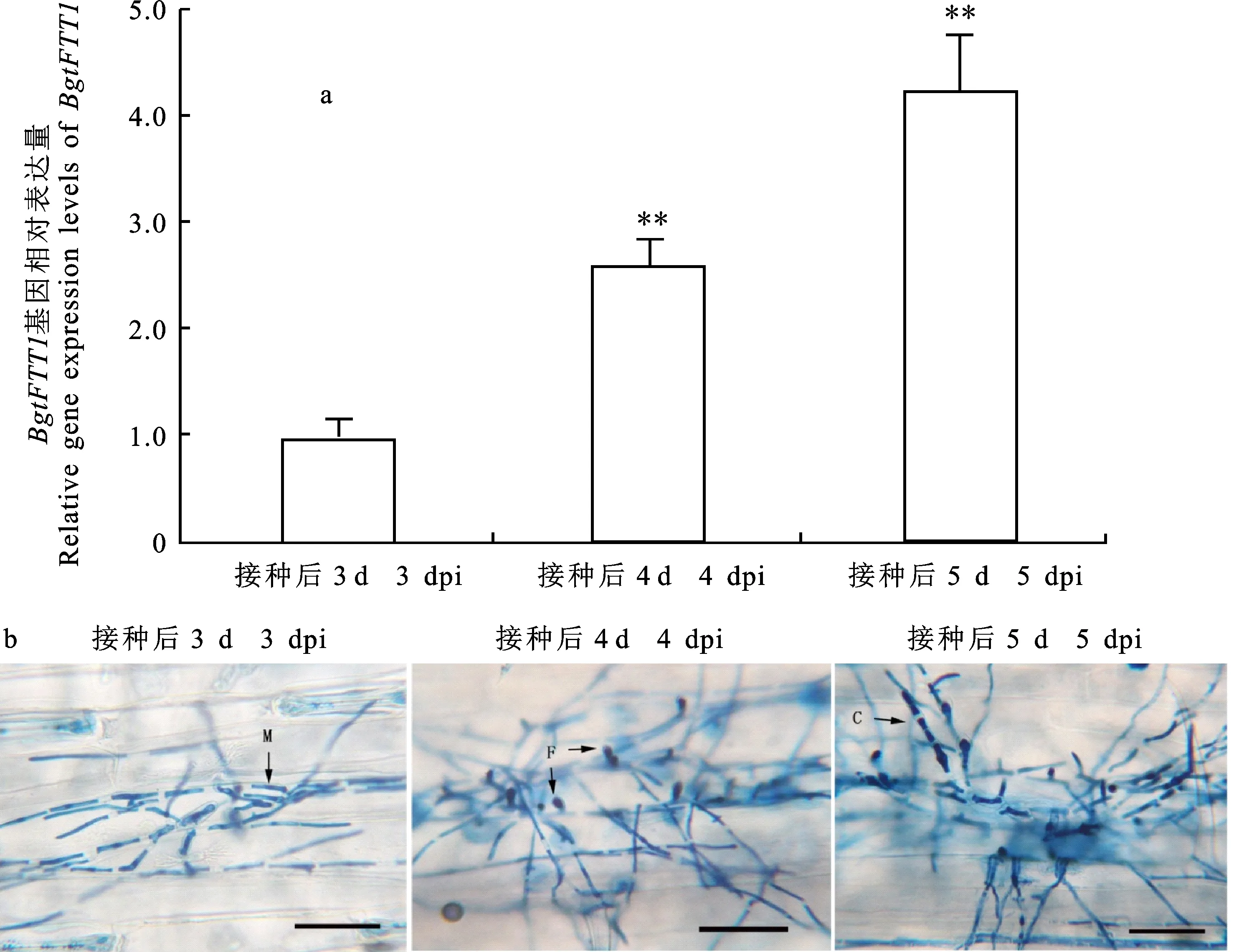
a.柱形图表示通过qRT-PCR获得的基因相对表达量;**代表在P=0.01水平有显著差异; b.菌株Bgt21-2在Chancellor上的产孢过程的台盼蓝染色照片;M.菌丝;F.足细胞; C.分生孢子梗。标尺为50 μm
2.7 BgtFTT1基因在小麦白粉菌产孢阶段的表达动态
BgtFTT1在小麦白粉菌从营养生长到分生孢子产生阶段的基因表达水平监测结果表明,与营养生长阶段(3 dpi)相比,BgtFTT1在足细胞形成期(4 dpi)和分生孢子梗形成期(5 dpi)均显著上调,表达水平呈持续上升趋势。其中,4 dpi和5 dpi时的基因表达水平分别是3 dpi时的2.6倍和4.2倍(图5-a)。这些结果说明,BgtFTT1的功能与小麦白粉菌无性产孢过程相关。
3 讨 论
本研究对小麦白粉菌1个14-3-3蛋白BgtFTT1的理化性质、序列特征、功能模体和系统进化进行了生物信息学分析。 BgtFTT1是1个低分子质量,偏碱性,亲水性蛋白。以往的研究表明,真菌14-3-3蛋白是一类低分子质量(约30 ku)的二聚体酸性蛋白,其中多数蛋白的亲水性强于疏水性[5,32]。 BgtFTT1碱性氨基酸比酸性氨基酸多,蛋白偏碱性,这是该蛋白与其他14-3-3蛋白的主要差异之一。BgtFTT1与BMH1/BMH2等典型的14-3-3蛋白[6]没有显著的序列相似性,说明它们属于不同家族的成员。而且,白粉菌的14-3-3蛋白与兼营腐生真菌的14-3-3蛋白形成两个独立的进化分支,说明白粉菌14-3-3蛋白可能具有与其他真菌来源的蛋白不同的进化历史,这可能与白粉菌形态建成完全依赖于寄主的生活方式有关。
BgtFTT1不含有酶活性位点,但含有N-酰基化位点、糖基化位点和PKC蛋白磷酸化位点等结合位点,提示BgtFTT1不具有催化功能,但在翻译中或翻译后可能发生酰基化、糖基化和磷酸化等蛋白修饰过程。酰基化和磷酸化修饰在酿酒酵母菌的14-3-3蛋白修饰中已有发现[33-34],而关于糖基化修饰还未见报道。真菌的14-3-3蛋白是一类没有催化功能的结合蛋白,主要通过与靶标蛋白相结合来执行它们的功能[10,35]。 BgtFTT1可能通过其C端的α-螺旋区域与其他14-3-3蛋白互作来行使其功能。而且,经过不同修饰的14-3-3蛋白可以与不同的靶标蛋白互作,调控不同的生物学过程[36]。因此,研究BgtFTT1蛋白的修饰过程及其互作靶标蛋白将有助于进一步解析其分子功能和参与的调控网络。另外,BgtFTT1在小麦白粉菌自然群体中出现非同义突变,且均与蛋白激酶C磷酸化位点有关,这些位点的突变是否会影响其功能,需要后续研究来 证实。
Ca2+信号通路在小麦白粉菌产孢过程中起重要作用[18]。蛋白激酶C是Ca2+信号通路的重要组件之一,它的激活依赖于细胞Ca2+浓度的升高[37]。 BgtFTT1具有5个蛋白激酶C磷酸化位点,说明该蛋白可能与蛋白激酶C的调控网络有关。BgtFTT1基因在小麦白粉菌分生孢子形成阶段显著上调,说明它与小麦白粉菌产孢相关。以往研究发现,14-3-3蛋白可参与Ca2+信号通路中Ca2+泵的调控,影响真菌的无性产孢[8,38]。BgtFTT1是否通过Ca2+信号通路调控小麦白粉菌无性产孢过程,可利用寄主诱导的基因沉默技术[39]将BgtFTT1沉默,检测细胞内Ca2+离子水平,监测与BgtFTT1功能有关的基因和参与Ca2+离子信号通路基因表达水平的变化,结合表型分析,揭示BgtFTT1在小麦白粉菌产孢中的作用。
