异源表达菊芋HtHCT基因对受体植物木质素相关生理生化指标的影响
2022-05-18张新业苏彦苹王聪艳侯晓强李文静
张新业,苏彦苹,朱 姝,王聪艳,2,侯晓强,李文静
(1. 廊坊师范学院 生命科学学院,河北廊坊 065000; 2. 河北省动物多样性重点实验室,河北廊坊 065000; 3. 廊坊市细胞工程与应用研究重点实验室,河北廊坊 065000)
木质素是植物体内重要的大分子高聚物,含量仅次于纤维素,是维管植物细胞壁的重要成分。木质素是植物由水生向陆生进化的重要标志,在支撑植物体,保持细胞内的水分,长距离运输水分和营养物质及抵御干旱、病原微生物等方面具有重要的生物学功能[1-4]。然而,木质素的存在却不利于植物资源的利用。在造纸工业中,纸浆内木质素的去除,不仅高能耗、高成本,而且污染环境。木质素含量过高还会影响牲畜对饲草植物的消化及木质纤维生产燃料乙醇的效率。因此,植物资源木质素含量的改良越来越受到重视[3,5]。
木质素通常由3种木质素单体—对羟基苯基木质素(H型木质素)、愈创木基木质素(G型木质素)和紫丁香基木质素(S型木质素)氧化聚合而成[6]。羟基肉桂酰辅酶A:莽草酸/奎宁酸羟基肉桂酰转移酶(HCT)是一种酰基转移酶,其以香豆酰辅酶A(p-coumaroyl CoA)为底物,将苯丙烷代谢引入木质素单体的合成[7]。到目前为止,已有多个物种内的HCT基因被鉴定,HCT基因在植物体内多以基因家族的形式出现,其蛋白结构中通常含有保守基序HXXXD和DFGWG[4,8-10]。由于物种的不同,HCT基因家族成员数目会有所差异。如Ma等[9]从苹果(Malus×domestica)、桃(Prunuspersica)、草莓(Fragariavesca)、拟南芥(Arabidopsisthaliana)和梨(Pyrusbretschneideri)基因组中分别鉴定到90、60、72、50和82个HCT基因。茄科植物的HCT基因数目较少,烟草(Nicotianatabacum)、番茄(Solanumlycopersicum)和辣椒(Capsicumannuum)中分别存在4、2和6个HCT基因[4]。最近,Chao等[11]从毛果杨(Populustrichocarpa)中鉴定到10个HCT基因家族成员。功能研究表明,HCT基因能够参与并调节木质素的合成,其下调表达能够显著降低木质素含量并改变木质素单体的组成[9]。
菊芋(Helianthustuberosus)是菊科、向日葵属的一种多年生草本植物,又名洋姜、鬼子姜。菊芋抗盐碱、抗旱、抗寒能力较强,且具有较好的防风固沙作用[12]。目前关于菊芋的研究主要集中在种质资源收集评价、生物能源开发、饲草营养品质、抗逆生理及糖类代谢等方面[13-14],而关于菊芋木质素代谢相关基因的研究鲜见报道。此外,菊芋中木质素含量较高,亦不利于其在造纸、饲料及生物能源等领域的应用[15-17]。廊坊师范学院植物分子遗传学研究室前期从菊芋品种‘廊芋8号’中克隆了HCT基因—HtHCT,其开放阅读框(open reading frame,ORF)长 1 293 bp,编码430个氨基酸,HtHCT在菊芋茎中的表达量显著高于其他被测组织,且能响应干旱、盐胁迫处理[18]。本试验构建HtHCT基因的植物表达载体,并对拟南芥和本氏烟(Nicotianabenthamiana)进行遗传转化,初步研究其对木质素及类黄酮合成的影响。
1 材料与方法
1.1 试验材料
野生型拟南芥(Col)种子经5%的次氯酸钠溶液消毒后,接种到MS培养基上,4 ℃春化48 h,置于人工气候室中(22 ℃、光照16 h/黑暗8 h、光照强度80 μmol·m-2·s-1)萌发生长。选取萌发后7~10 d的健壮幼苗,移栽到营养土中 [V(泥炭)∶V(蛭石)∶V(珍珠岩)=2∶7∶1],继续培养,条件同上。
本氏烟种子经5%的次氯酸钠溶液消毒后,接种到MS培养基上,置于人工气候室中(23 ℃、光照16 h/黑暗8 h、光照强度70 μmol·m-2·s-1)萌发生长,待长出2~3片叶后,将幼苗移至培养瓶中,并在同一条件下继续培养。
含HtHCT基因CDS序列的原核表达载体pET-28a-cHtHCT及植物表达载体pCAMBIA1390(含CaMV 35S启动子、卡那霉素抗性、潮霉素筛选标记)均由廊坊市细胞工程与应用研究重点实验室保存。
1.2 植物表达载体的构建
以原核表达载体pET-28a-cHtHCT为模板,利用含有酶切位点PstⅠ、EcoRⅠ的引物对HCT4F/HCT4R进行PCR扩增,利用限制性内切酶[宝生物工程(大连)有限公司]对PCR扩增产物和植物表达载体pCAMBIA1390分别进行双酶切,利用琼脂糖凝胶DNA回收试剂盒(北京庄盟科技有限公司)回收纯化目的基因片段和pCAMBIA1390载体骨架,二者经Ligation high(日本TOYOBO公司)连接后,转化大肠杆菌(Escherichiacoli)Trans 10感受态细胞,经双酶切鉴定后送出测序,获得重组植物表达载体pCAMBIA1390-HtHCT。
1.3 植物遗传转化及转基因植株鉴定
将植物表达载体pCAMBIA1390-HtHCT导入根癌农杆菌(Agrobacteriumtumefaciens)感受态细胞GV3101中,经菌落PCR鉴定后,阳性克隆用于遗传转化。利用蘸花法[19]转化拟南芥(Col),收获T0代种子。T0代种子经消毒后,点播到1/2MS培养基上(含30 μg·mL-1潮霉素),进行抗性筛选,提取抗性苗基因组DNA进行PCR鉴定,得到的阳性苗进一步提取RNA,并进行RT-PCR检测(表1),收获T1代阳性植株的种子。T1代种子继续使用潮霉素抗性平板筛选,抗性苗移栽到营养土中,利用PCR进行进一步鉴定,获得T2代阳性植株,长至开花期后,将T2代阳性植株按T1代来源混收茎秆,用于生理生化指标测定。
用手术刀将生长至4~5周的本氏烟无菌苗叶片切成小块,利用叶盘法[20]进行遗传转化,提取T0代植株DNA,进行PCR检测,获得的阳性苗进一步利用RT-PCR鉴定(表1),阳性植株自交收种。将T0代种子按株系点播于营养土中,长至3~4叶时,提取叶片DNA,进行PCR鉴定,剔除阴性苗,保留T1代阳性植株,将生长约7~8周的T1代阳性植株按T0代来源混收茎秆,用于生理生化指标测定。

表1 引物信息Table 1 Primers used in this study
1.4 转基因植株生理生化指标测定
将上述混收的植物材料105 ℃杀青15 min,70 ℃烘干至恒量,粉碎后过80目筛,用于以下性状的测定(江苏三黍生物科技有限公司)。
1.4.1 总木质素含量测定 采用乙酰溴法[23]测定总木质素含量。称取50 mg样品,加入1 mL 70 %的乙醇,10 000 r·min-1离心10 min,弃上清液;加入1 mL氯仿/甲醇(1∶1)溶液重悬沉淀,离心后弃上清液;加入1 mL丙酮混匀,干燥后再加入1.5 mL 0.1 mol·L-1pH 5.0的醋酸钠缓冲液,80 ℃加热20 min;加入10 μL 0.01 %的叠氮化钠、10 μL 0.1 mg·mL-1淀粉酶和10 μL 1.10~1.30 g·mL-1普鲁兰酶,37 ℃过夜;加热至100 ℃终止反应,离心弃上清液,加水清洗沉淀;加入1 mL丙酮,混匀并干燥丙酮。称取约1 mg上述沉淀,加入100 μL乙酰溴(25%)溶液,50 ℃加热3 h;然后加入400 μL 2 mol·L-1氢氧化钠和70 μL 0.5 mol·L-1盐酸羟胺,混匀后,用乙酸定容至2 mL,取200 μL于280 nm波长下测定吸光值。总木质素含量计算公式为:总木质素含量(μg·mg-1)=[ΔOD280/(C×L)]×(V/m)×100%×10,其中C为吸光系数15.69,L为光程0.539 cm,V为反应体积2 mL,m为样品质量。
1.4.2 木质素单体含量测定 称取10 mg样品,加入500 μL硫解液(2.5%三氟化硼、10%乙硫醇、87.5%二氧六环);100 ℃加热4 h;加入300 μL 0.4 mol·L-1碳酸氢钠,混匀后加入0.2 mL水和0.3 mL乙酸乙酯;14 000 r·min-1离心10 min,取上清液;干燥后加入150 μL吡啶(含内标反式肉桂酸)和50 μL三甲基硅烷,60 ℃反应1 h后,10 000 r·min-1离心10 min,取上清液利用Agilent7820A-5977B气质联用仪[24]进行测定。
1.4.3 总黄酮含量测定 采用亚硝酸钠-氯化铝法测定总黄酮含量[25]。称取50 mg样品于2 mL离心管中,加入1 mL甲醇,60 ℃抽提4 h。取50 μL提取物,加入950 μL甲醇和4 mL水,再加入300 μL 5%亚硝酸钠溶液,室温静置5 min。加入300 μL 10%氯化铝溶液,静置6 min。加入2 mL 1 mol·L-1氢氧化钠,最后定容到10 mL,静置15 min。于510 nm处测定吸光值。类黄酮含量测定公式:类黄酮含量=C×V/M,其中C为根据标准曲线计算出的结果,V为提取液总体积,M为样品质量。
以芦丁为标样制作标准曲线。称取芦丁 1 mg,加入甲醇配制成浓度为0.1 mg·mL-1、 0.2 mg·mL-1、0.4 mg·mL-1、0.6 mg·mL-1、0.8 mg·mL-1、1 mg·mL-1的标准溶液,测定方法同上。
2 结果与分析
2.1 植物表达载体构建
以引物对HCT4F/HCT4R扩增质粒pET-28a-cHtHCT,得到长约1 300 bp的HtHCT基因片段,经PstⅠ、EcoRⅠ双酶切后连入经相同内切酶酶切的pCAMBIA1390,转化大肠杆菌后,阳性克隆抽提质粒,经双酶切后得到长度一致的目的基因片段(图1),酶切鉴定无误后送公司测序,从而获得重组表达载体pCAMBIA1390-HtHCT。
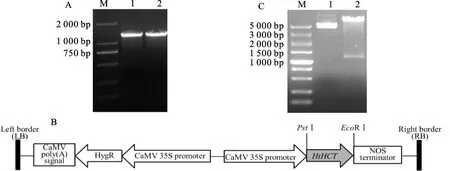
A. HtHCT基因片段的PCR扩增; M.DL2000; 1~2. HtHCT基因片段; B. 植物表达载体pCAMBIA1390-HtHCT构建示意图; C. 植物表达载体pCAMBIA1390-HtHCT的双酶切鉴定; M. DL5000; 1. pCAMBIA1390-HtHCT; 2. PstⅠ/EcoRⅠ的双酶切产物
2.2 植物遗传转化及转基因植株鉴定
分别利用蘸花法和叶盘法对拟南芥和本氏烟进行遗传转化,并获得转基因材料(图2)。以重组质粒pCAMBIA1390-HtHCT和野生型材料分别作为阳性和阴性对照,利用引物对HCT4F/HCT4R对拟南芥T1代抗性植株和本氏烟T0代抗性植株进行PCR检测。结果表明,阳性对照和转化成功的阳性植株均扩增出长约1 300 bp的目的片段,说明HtHCT基因已整合到受体材料的基因组中,而阴性对照和未转化成功的材料则没有相应的扩增产物(图3-A、C)。

A~E. 拟南芥转化流程; A. 种子萌发; B. 幼苗移栽; C. 花序侵染; D. 转基因植株生长发育; E. 种子采集; F~J. 本氏烟转化流程; F. 侵染后共培养; G. 愈伤诱导; H. 愈伤筛选及幼苗分化; I. 幼苗生根; J. 幼苗移栽
分别以拟南芥Actin基因和本氏烟60Sribosomalprotein基因作为内参,利用引物对AtActin2sqF/AtActin2sqR和NbL23qF/NbL23qR对经PCR检测呈阳性的T1代转基因拟南芥和T0代转基因本氏烟进行RT-PCR检测。结果表明,野生型拟南芥和本氏烟中均无扩增产物,而经PCR鉴定为阳性的植株均扩增出特异性片段,说明HtHCT基因已成功转录(图3-B、D)。
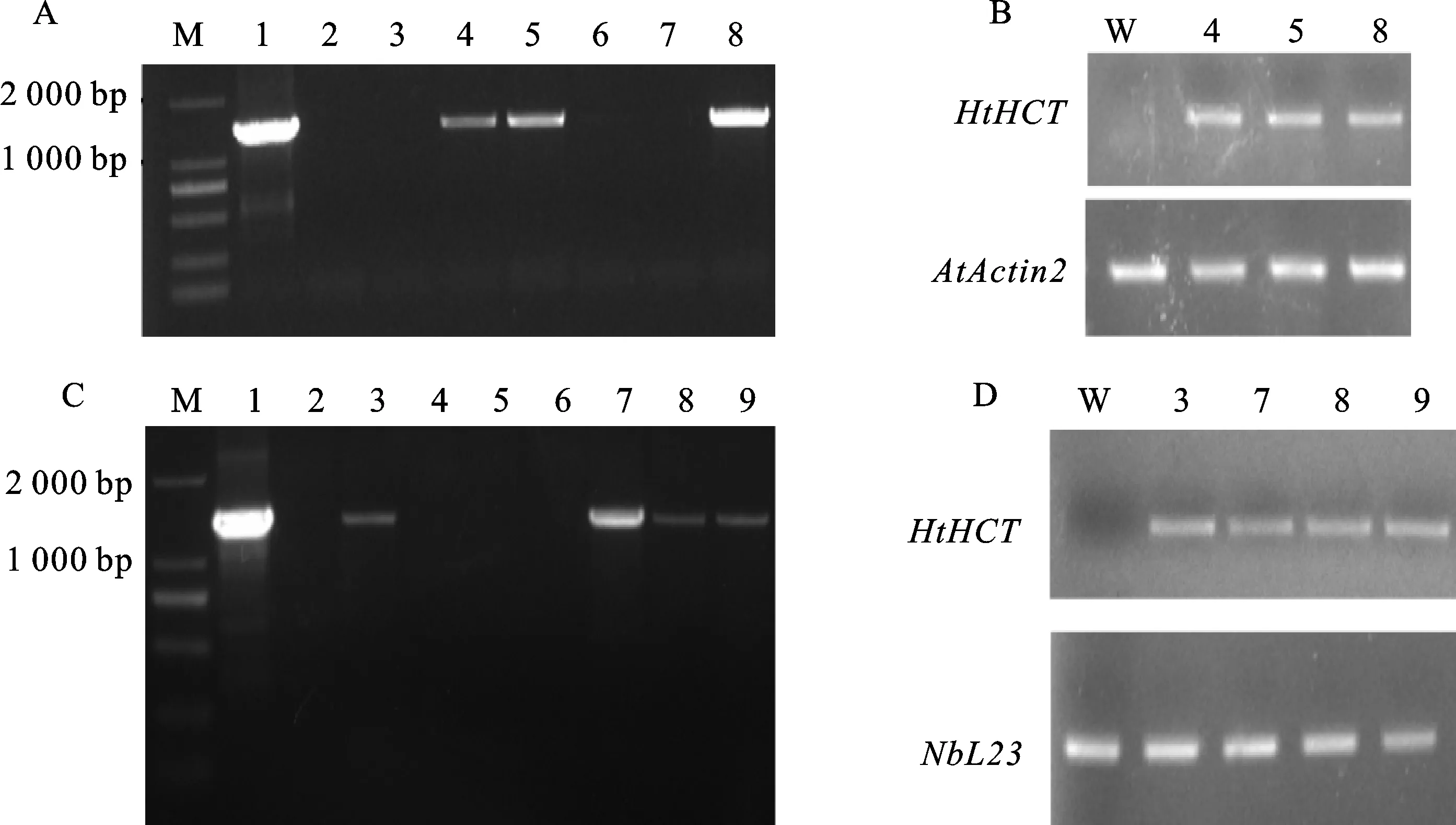
A. T1代转基因拟南芥的PCR检测; M. DL2000; 1. 重组质粒pCAMBIA1390-HtHCT; 2. 野生型; 3~8. 转基因拟南芥植株; B. T1代转基因拟南芥的RT-PCR检测; W. 野生型; 4,5,8. 转基因拟南芥植株; C. T0代转基因本氏烟的PCR检测; M. DL2000; 1. 重组质粒pCAMBIA1390-HtHCT; 2. 野生型; 3~9. 转基因本氏烟植株; D. T0代转基因本氏烟的RT-PCR检测; W. 野生型; 3,7,8,9. 转基因本氏烟植株
2.3 转基因材料生理生化指标测定
2.3.1 转基因材料总木质素含量测定 将载体pCAMBIA1390-HtHCT转入拟南芥和本氏烟中,分别测定野生型和转基因株系的总木质素 含量。
在拟南芥中,转基因株系AtL4和AtL5的总木质素含量高于野生型,其中株系AtL5与野生型之间差异极显著。而转基因株系AtL8的总木质素含量则极显著低于野生型。在本氏烟中,转基因株系NbL3和NbL7的总木质素含量极显著地高于野生型,株系NbL9的含量则低于野生型(表2)。以上结果表明,HtHCT基因能够影响木质素的合成。
2.3.2 转基因材料木质素单体含量测定 木质素单体含量的测定结果表明,拟南芥和本氏烟中的木质素单体均以G型木质素和S型木质素为主,而H型木质素含量最低。在拟南芥中,HtHCT基因的导入对G型木质素含量的影响最大,S型木质素次之,而对H型木质素含量的影响最小。在本氏烟中,仅有转基因株系NbL7的木质素单体组成与野生型之间存在显著差异,表明HtHCT基因对本氏烟木质素单体构成的影响较小。无论在拟南芥还是本氏烟中,G型木质素的含量一般与S型木质素的含量呈负相关,而H型木质素含量变化规律不明显(表2)。
2.3.3 转基因材料的类黄酮含量测定 鉴于HCT与查尔酮合成酶均可以香豆酰辅酶A为底物,并分别将苯丙烷代谢引入木质素单体合成及类黄酮合成途径[6]。因此,本研究也测定了转基因材料的类黄酮含量。
以吸光度值为横坐标,不同浓度的芦丁标准品为纵坐标,进行线性回归,得到标准曲线的回归方程为y=31.625x-1.330 2(R2=0.996 6)。据此,对类黄酮含量进行测定。结果表明,拟南芥转基因株系AtL4和AtL8的类黄酮含量均极显著地低于野生型,本氏烟中亦有2个转基因株系(NbL3、NbL9)的类黄酮含量显著或极显著低于野生型含量(表2)。
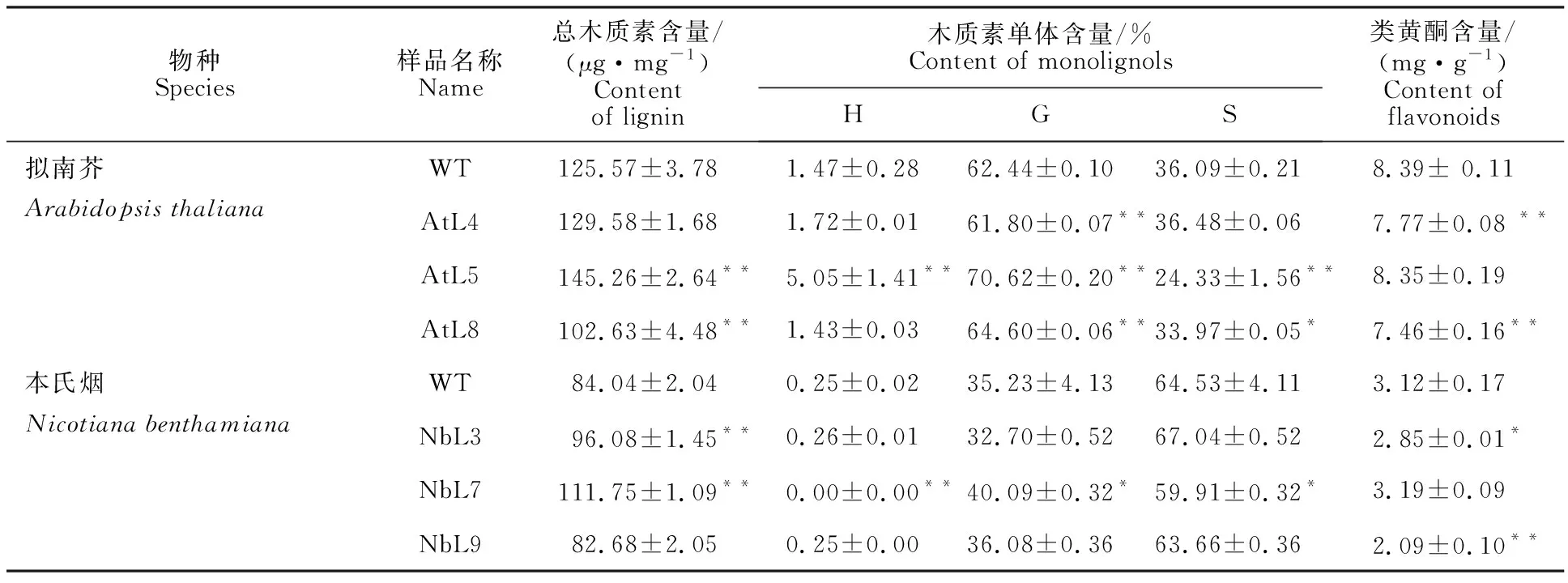
表2 转基因植株生理生化指标测定Table 2 Determination of physiological and biochemical indicators of transgenic plants
3 讨 论
木质素是重要的植物代谢产物,通过现代生物技术手段调节植物木质素代谢已成为研究热点,这不仅有利于抗倒伏植物新品种的培育,而且有利于植物资源在造纸、生物能源等方面的应用。
HCT是将苯丙烷代谢产物香豆酰辅酶A引入木质素单体合成的关键节点,在木质素合成过程中具有重要作用[26]。HCT基因表达量的变化对植物木质素的含量及组成具有重要影响。拟南芥HCT基因沉默后,叶片颜色加深,S型木质素含量降低,植株生长受抑制,部分材料出现不育现象,但类黄酮含量增加。本氏烟HCT基因沉默后,木质素含量降低,木质素组成亦发生改变(S型木质素减少,H型木质素增多),其部分植株矮化[7,27]。紫花苜蓿(Medicagosativa)HCT基因的下调表达,会显著降低木质素含量并改变其组成,但却提高了类黄酮含量、紫花苜蓿消化率及其对逆境胁迫的抗性[28-29]。为解析菊芋HtHCT基因的功能,本研究构建了植物表达载体pCAMBIA1390-HtHCT,并分别转化了拟南芥和本氏烟草。与野生型拟南芥相比,3个转基因株系的总木质素含量表现不一,其中两个株系含量升高,而AtL8却显著降低。本氏烟草中亦有两个株系含量增加,一个株系(NbL9)含量降低。说明HtHCT基因的导入能够影响受体木质素代谢,与前人研究结果[27-28,30]一致。与野生型相比,拟南芥转基因株系AtL8和烟草转基因株系NbL9的木质素含量呈现下降趋势,可能是外源HtHCT基因的表达抑制了拟南芥和本氏烟中自身HCT基因的表达而出现了共抑制现象[31],与韩伯涛等[32]的研究结果相近。从木质素组成看,转入HtHCT基因后,拟南芥和本氏烟的木质素组成均发生了不同程度的改变,且G型和S型木质素含量之间存在此消彼长的负相关关系,而H型木质素含量变化规律不明显。HCT基因通常以基因家族的形式存在于植物基因组中,且不同物种间HCT基因家族成员的数目亦有不同[9]。本试验在前期同源克隆‘廊芋8号’HtHCT基因的基础上,对该基因进行初步功能研究。由于菊芋是向日葵属六倍体物种(2n=6x=102),其基因组大小及全基因组序列均未知[33],对全基因鉴定和分析菊芋HCT基因造成了极大困难,并导致有关菊芋HCT基因数目、结构、染色体分布及表达特性的信息十分匮乏。因此,在以后的研究中,可以借助转录组测序及其他已公布基因组序列的向日葵属物种信息来挖掘更多的菊芋HCT基因,并结合基因表达分析和HCT酶活分析,筛选在木质素合成过程中发挥主要作用的HCT基因[9]用于菊芋木质素含量的遗传改良。查尔酮合成酶也可以香豆酰辅酶A作为底物,从而将苯丙烷代谢引向类黄酮物质的合成,因此其与HCT间可能存在一定的底物竞争,故本研究也测定了转基因植物中的类黄酮含量。除本氏烟转基因株系NbL7外,在其余的拟南芥和本氏烟转基因材料中,类黄酮含量较野生型材料均发生不同程度的下降,这与Besseau等[7]在HCT基因发生沉默的拟南芥株系中测得较高的类黄酮含量结果相近。木质素合成过程复杂,受多种酶的调控及时间、空间和外界环境的影响[34],而相较于单个酶基因的调节,同时调节多个木质素合成相关酶基因对木质素的改良效果更明显[35]。此外,植物木质素含量的调节应在一定的范围内,既要保证植物的正常生长,还要兼顾实际生产中对木质素含量和组成的要求[36]。
本研究在拟南芥和本氏烟中异源表达菊芋HtHCT基因,初步探明了该基因在木质素合成过程中的作用。在后续的研究中,笔者将继续挖掘菊芋木质素代谢相关基因,建立和完善菊芋的遗传转化体系,以期为菊芋木质素含量的遗传改良奠定基础。
