轮斑病导致的桉树叶片内生真菌群落结构差异分析
2022-05-18钟雅婷邹东霞廖旺姣赵鹏飞
钟雅婷,邹东霞,廖旺姣,赵鹏飞,黄 宁,罗 辑
(1.广西壮族自治区林业科学研究院,广西 南宁 530002;2.广西林业有害生物天敌繁育工程技术研究中心,广西 南宁 530002)
桉树Eucalyptus是我国速生丰产林的主要树种之一,也是广西的重要经济林木,具有生长迅速、伐期短、产量高、用途广、效益好等特点,是优良的绿化和工业两用林[1]。桉树轮斑病是一种由Coniella eucalyptorum引起的桉树叶部真菌病害,可造成桉树叶片大面积枯斑,影响光合作用,导致芽枯和嫩梢枯等,极大影响桉树的速生丰产[2-3]。该病全年均可发生,尤其在7—9月高温、高湿、多雨季节扩展迅速。植物真菌或细菌性病害的发生和发展与内生菌群结构的改变密切相关。一方面,植物内生菌中可能存在潜伏期的植物病原菌,当内生菌与植物之间的共生平衡被打破时,这些病原菌即大量增殖,引起病害的发生[4];另一方面,外来病原菌侵入植株,引起内生菌群的群落结构和数量变化,病原菌成为内生菌群落中的优势种群,导致植株进入病理过程[5]。同时,内生菌群结构的改变也可能是造成染病植株症状复杂多样的原因之一[6]。除此之外,染病植株中还可能存在与病原菌相互促进、相伴发生的微生物,两者共同加剧了病害的发展[7]。
森林病害防控是林业生产首要关注的研究方向之一。病害的发生,会导致林木减产甚至死亡,直接影响林业经济。因此,研究植物内生真菌群落组成和结构,有助于揭示桉树病害的发生和发展机理。但由于大部分的内生真菌均为不可培养的微生物,无法从植物组织中分离,这给全面了解内生真菌群落组成结构与病害发生之间的关联带来了较大困难。本研究基于高通量测序,分析轮斑病害叶片内生真菌群落的变化,并以轮斑病菌为指示菌,研究对其可能有拮抗作用的菌株。旨在明确桉树叶内轮斑病菌与内生真菌间的关联,探讨轮斑病菌的致病成因,同时也为拓展桉树轮斑病的防控思路奠定实验基础。
1 材料与方法
1.1 桉树叶样品的采集与处理
于2020年5月在广西国有东门林场发生轮斑病害的桉树林地(107°51′E,22°20′N)采集树龄为1.5 a 的尾巨桉叶样品(尾巨桉基因型暂处于保密阶段)。采集地属于亚热带季风气候,当月平均温度为24~33℃,平均降水量为134 mm。按照“Z”形随机选取20~30 棵树,每棵树间隔15 m 以上,在每棵树的东南西北四个方位、高1.5~2.0 m 处随机采集健康叶片(304JN)和有轮斑病病斑的桉树叶片(304BN)(病斑范围为叶片表面积的1/5以上),每棵采6~10 片叶。将采集到的健康叶片、病害叶片分别混合,随后各分为5 组重复,每组重复约20 片叶。所有叶片样品均用无菌水冲洗后晾干,75%乙醇洗涤2 次,每次2 min,2.5%NaClO(含0.1% Tween 80)浸泡5 min,随后再用无菌水冲洗3 次,晾干后提取基因组DNA,用于内生真菌多样性测定。
1.2 基因组DNA 的提取
用液氮将处理好的桉树叶样品研磨成粉末,按 照E.Z.N.ATMMag-Bind Soil DNA Kit 试剂盒(OMEGA,M5635-02)操作说明书提取样品基因组DNA。完成基因组提取后,用1%琼脂糖凝胶电泳检测提取的基因组DNA。
1.3 内生真菌多样性测定
以上述方法提取的基因组DNA 为模板,对真菌ITS rDNA 的ITS1-2 区域进行PCR 扩增。第一轮PCR 扩增使用真菌ITS rDNA 通用引物:ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′ 和ITS2R:5′-GCTGCGTTCTTCATCGATGC-3′。PCR反应体系(30 μL):2×Taqmaster Mix 15 μL,F/R 引物(10 μM) 各1 μL,DNA10~20 ng,Nuclease-Free Water 补齐总体积至30 μL;PCR 反应条件:95℃预变性3 min,95℃变性30 s,45℃退火20 s,65℃复性30 s,共5 个循环;94℃变性20 s,55℃退火20 s,72℃复性30 s,共20 个循环,72℃延伸5 min。第二轮PCR 扩增以第一轮PCR扩增产物为DNA 模板,引入Illumina 桥式PCR 兼容引物,反应体系(30 μL):2×Taqmaster Mix 15 μL,F/R 引物(10 μM)各1 μL,第一轮PCR产 物DNA 20 ng,Nuclease-Free Water 补齐总体积至30 μL。PCR 反应条件:95℃预变性3 min;94℃变性20 s,55℃退火20 s,72℃复性30 s,共5 个循环;72℃延伸5 min。用1%琼脂糖凝胶电泳检测PCR 产物,使用磁珠纯化方法对PCR 产物进行纯化。纯化产物委托生工生物工程(上海)股份有限公司完成高通量双末端测序,测序平台为美国Illumina 公司Illumina Miseq ™/Hiseq ™PE300 高通量测序仪。
1.4 测序数据的处理与分析
Miseq 测序获得的paired-end reads 首先根据overlap 关系进行拼接,区分样本后对序列质量进行质控和过滤,对有效数据进行在97%相似度水平下的聚类,获得分类操作单元(operational taxonomic units,OTU),随后进行OTU 聚类分析和物种分类学分析。使用包含Shannon、Simpson 等指标对样品进行Alpha 和Beta 多样性分析,研究真菌菌群组成和差异等。
1.5 可培养菌株抑菌作用测定
待测可培养细菌:解淀粉芽孢杆菌Bacillus amyloliquefaciens、贝莱斯芽孢杆菌Bacillus velezensis、枯草芽孢杆菌Bacillus subtilis和可培养真菌:青霉Penicillium mallochii均为本实验室已有保存的菌种;供试病原菌C.eucalyptorumGXLB 株(ITS1-5.8S-ITS2 序列Genbank 登录号:MW020030)分离自桉树轮斑病病害叶片,保存于本实验室。
可培养细菌对轮斑病菌生长的影响。将待测细菌接种于LB 液体培养基中,37℃ 220 rpm 振荡培养24 h,10 000 rpm 离心10 min,取上清并用0.22 μm 孔径滤器过滤除菌,获得无菌发酵液;将该发酵液与PDA 培养基混匀(发酵液终浓度为10%),制作平板,同时以加入与发酵液等体积的LB 液体培养基(0.22 μm 孔径滤器过滤除菌)的PDA 培养基作为对照;在GXLB 株的菌落中打取直径为6 mm 的菌丝块,接种在上述PDA 平板上,28℃恒温培养96 h,每个处理设3 个重复。
可培养真菌对轮斑病菌生长的影响。在指示菌的菌落中打取直径为6 mm 的菌丝块并接种于PDA 平板中央,同时打取待测真菌的菌丝块(直径6 mm)按照3~4 点接种于平板边缘,距离指示菌25 mm,距离平板边缘不得小于10 mm,同时以仅接种指示菌的平板作为对照,每个处理设3个重复,28℃恒温培养96 h。采用十字交叉法测量指示菌的直径,计算抑菌率。抑菌率=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100%[8]。
1.6 样品中GyrA 基因片段的扩增
以步骤1.2 提取的基因组DNA 为模板,采用通用引物PCR 扩增304JN 和304BN 样品GyrA 基因片段。GyrA-F:5′-CAGTCAGGAAATGCGTACGT CCTT-3′ 和GyrA-R:CAAGGTAATGC TCCAGG CATTGCT。PCR 反应体系(30 μL):2×Taqmaster Mix 15 μL,F/R 引物(10 μM)各1 μL,DNA 10~20 ng,Nuclease-Free Water 补齐总体积至30 μL;PCR 反应条件:94 ℃预变性3 min,94 ℃变性1 min,55℃退火30 s,72℃延伸75 s,共30 个循环,最后72℃延伸10 min。用1%琼脂糖凝胶电泳检测PCR 产物,将PCR 产物交由生工生物工程(上海)股份有限公司测序鉴定。
2 结 果
2.1 OTU 注释及分析
如表1所示,在对健康叶(5 组重复)和轮斑病害桉树叶(5 组重复)的内生真菌测序后获得554 952 条有效序列。根据97%相似度对所有序列进行同源比对,共聚类成2 798 个OTUs,其中304JN 样品为2 037 个OTUs,共注释到2 门、15纲、55 目、139 科、238 属、300 种;304BN 样品为761 个OTUs,共注释到2 门、12 纲、55 目、88 科、130 属、183 种。
2.2 真菌群落的α 多样性分析
真菌群落α多样性检测结果显示(表2),304JN 和304BN 样品物种覆盖率均大于97%,提示样品所构建的真菌文库能有效反映其物种的多样性,且各组样品多样性指数组内偏差较小,数据可靠。304JN 样品中ACE 指数和Chao 指数均显著高于304BN 样品,说明健康叶片内生真菌群落的丰富度明显高于病害叶片。而两组样品的Simpson 指数和Shannon 指数虽然略有波动,但无显著差异,表明叶片染病后内生真菌群落多样性和优势菌种的集中程度均较健康叶片无显著改变,处于相对稳定的状态。
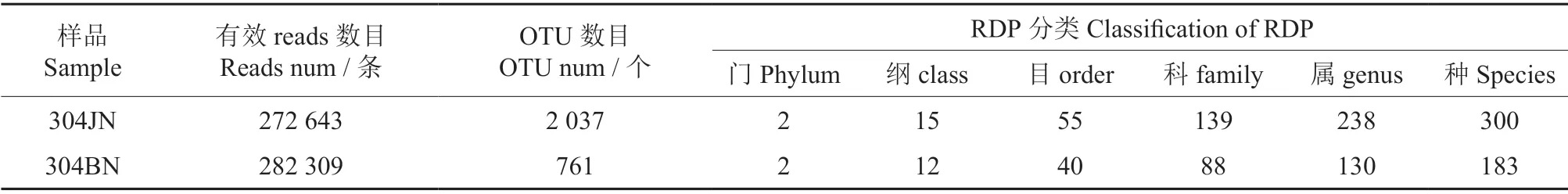
表1 304 JN 和304 BN 样品真菌OTU 聚类及RDP 分类水平统计Table 1 The fungal OTU clustering and RDP classification level statistics of 304JN and 304BN samples
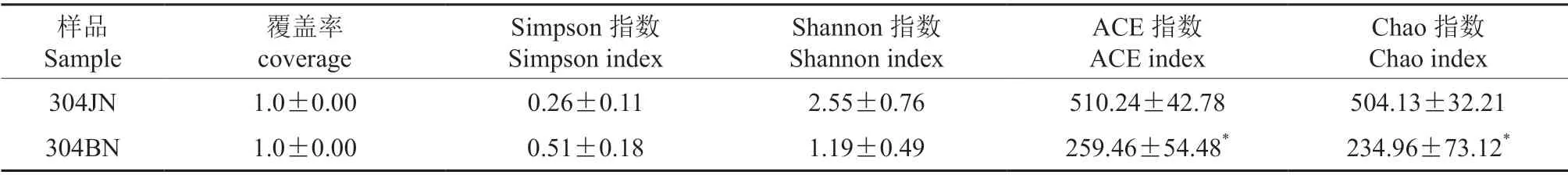
表2 304JN 和304BN 样品真菌α 多样性指数统计†Table 2 The fungal alpha diversity index statistics of 304JN and 304B samples
2.3 真菌群落的主成分分析(Principal Component Analysis,PCA)
从OTU 水平上对304JN 和304BN 样品进行PCA 分析(图1),两组样品的真菌群落大致分布在不同区域,表明304JN 和304BN 样品真菌的组成和结构存在较大差异。其中,304BN 样品中有1 组重复与该组中其他重复间的距离较远,可能是由于该组重复存在较大偏差所致。
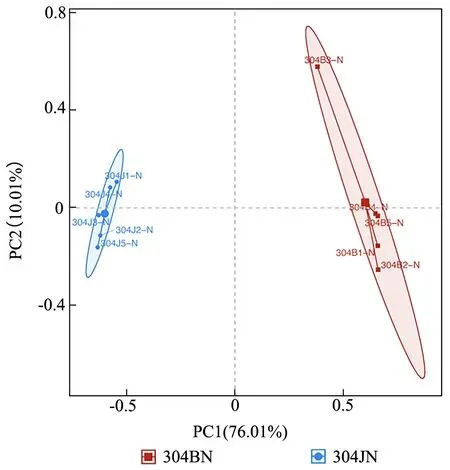
图1 304JN 和304BN 样品PCA 分析Fig.1 PCA analysis of 304JN and 304BN samples
2.4 OTUs Venn 分析
桉树健康和病害叶片样品内生真菌大部分存在交集,又相互独立。从Venn 图来看(图2),304JN 和304BN 样品中微生物的OTUs 交叉较多,共有的OTUs 数量为265 个,304BN 样品中与304JN 样品共有的OTUs 占78.87%。304JN 样品特有的OTUs 数量多于304BN 样品,可能较304BN 样品拥有更多的特有真菌。
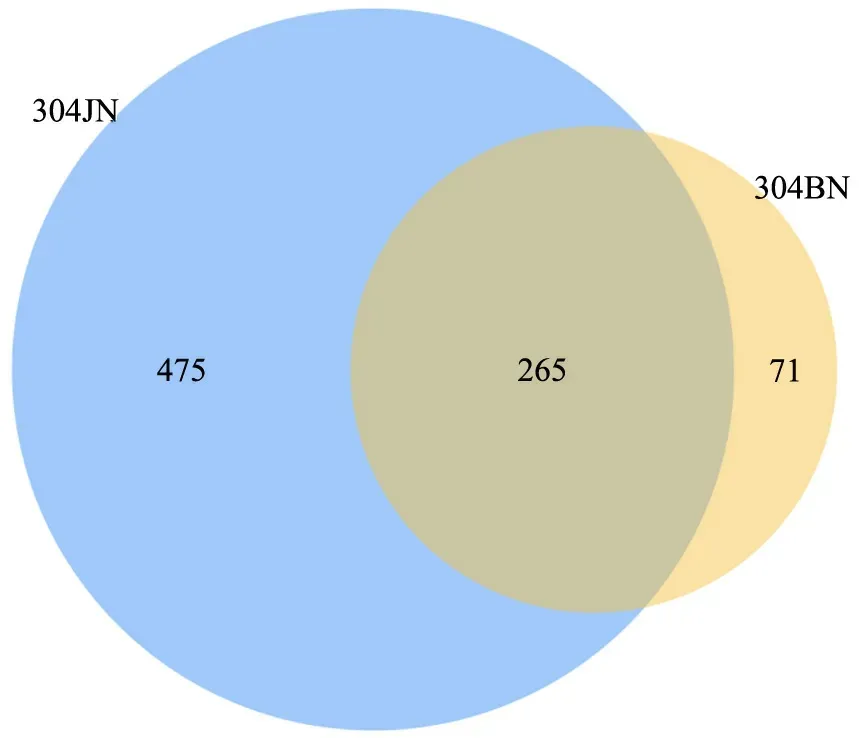
图2 304JN 和304BN 样品OTUs Venn 分析Fig.2 The OTUs Venn analysis of 304JN and 304BN samples
2.5 真菌组成及多样性分析
在种分类阶元水平上(图3),304JN 样品中排名前三的优势菌种为Uwebraunia australiensis(18.17%)、Passalora californica(7.76%)、Pallidocercos poraventilago(3.67%);304BN样品中排名前三的优势菌种为C.eucalyptorum(57.43%)、Talaromyces thailandensis(18.60%)、Teratosphaeria agapanthi(13.09%)。其中,304BN样品中U.australiensis、P.californica、P.ventilago的丰度明显低于304JN 样品(P<0.05),而C.eucalyptorum的丰度则较304JN 样品显著增高(P<0.01);304JN 和304BN 样品中T.thailandensis和T.agapanthi的丰度均无显著差异。此外,在304BN 样品中Fusicladium eucalypticola、Fellomyces horovitziae、Cutaneotrichosporon cyanovorans、Fellomyces mexicanus的丰度明显高于304JN 样品(P<0.05)(表3)。

图3 304JN 和304BN 样品在种水平的组成Fig.3 Composition of bacteria in 304JN and 304BN samples at the level of species
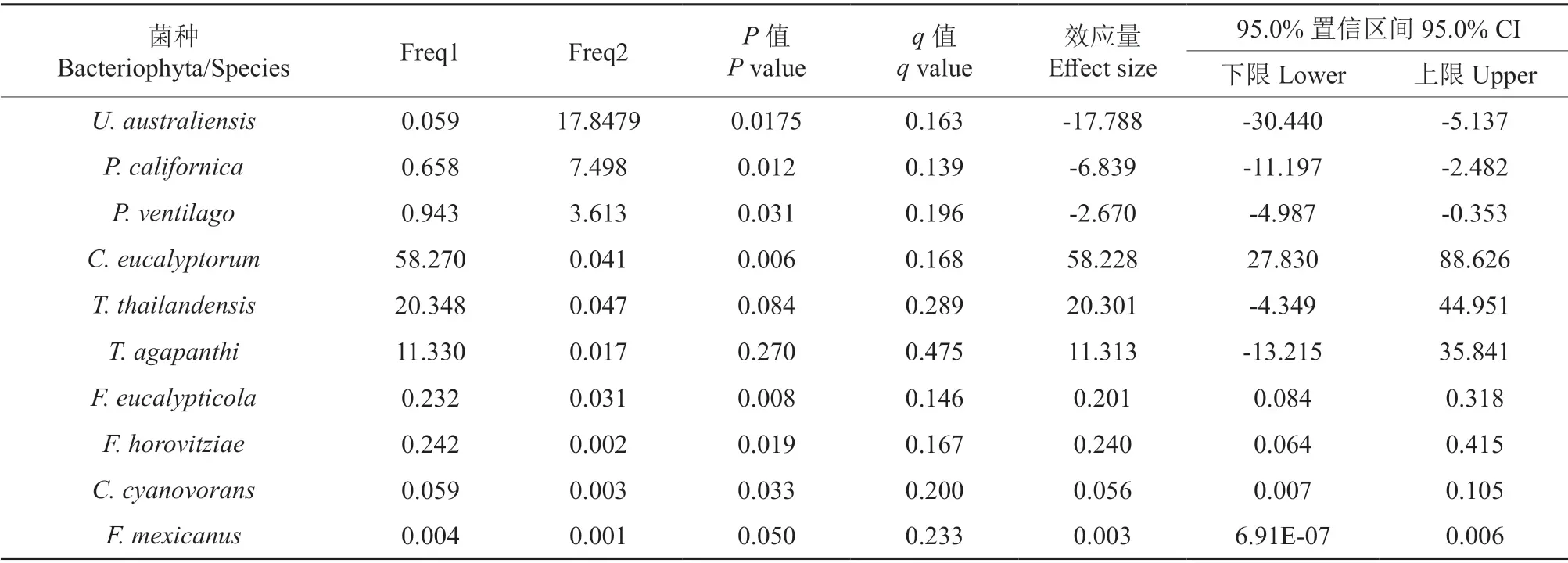
表3 304JN 和304BN 样品中优势真菌菌群丰度差异Welch’s t-test 比较†Table 3 The differences in the abundance of dominant fungal populations in 304JN and 304BN samples by Welch’s t-test
2.6 桉树病害病原真菌丰度差异比较
采用Welch’s t-test 法对种分类水平上304JN和304BN 样品中桉树病害病原真菌丰度进行比较。在样品中共发现有3 种可能的病原真菌,包括桉树轮斑病菌、花斑病病原菌Aureobasidium pullulans和枝枯病病原菌Lasiodiplodia theobromae。结果表明(表4),304BN 样品中桉树轮斑病菌的丰度明显高于304JN 样品(P<0.01)。两组样品中均存在花斑病病原菌和枝枯病病原菌,但上述两种病原菌在样品中的丰度极低,且无显著差异。
2.7 可培养菌株对轮斑病菌生长的影响
结果表明(表5),P.mallochii对C.eucalyptorum的生长无抑制作用,而B.amyloliquefaciens、B.velezensis、B.subtilis均对C.eucalyptorum的生长有不同程度的抑制作用。其中,B.velezensis对C.eucalyptorum的抑制率最高。为了明确桉树健康叶和轮斑病害叶内是否存在B.velezensis,对两组叶片样品中GyrA 基因片段进行PCR 扩增,结果表明在健康桉树叶中可以检测到B.velezensis,而轮斑病害叶中则未能检测到,提示在健康桉树叶内含有B.velezensis,而轮斑病害叶片中不含有或含量很低,这可能是其与轮斑病菌之间存在相互拮抗作用。

表4 304JN 和304BN 样品中桉树病害病原真菌菌群丰度差异Welch’s t-test 比较Table 4 Comparison of abundance differences of Eucalyptus disease pathogenic bacteria in BCN and BS samples by Welch’s t-test
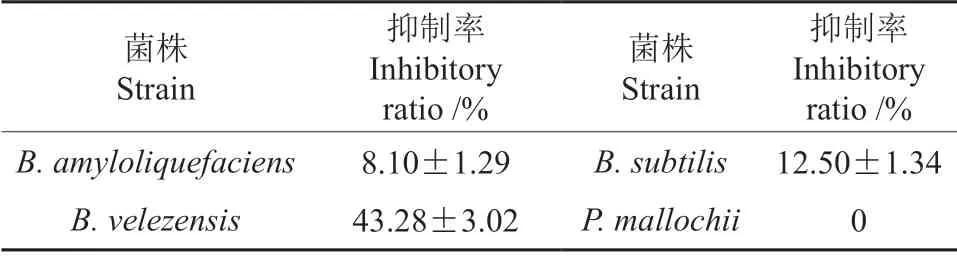
表5 可培养菌株对轮斑病菌的抑制率Table 5 Inhibition rates of cultivable strains to B.velezensis
3 讨 论
本研究采用ITS rDNA 和Illumina Miseq 技术分别对健康桉树叶和轮斑病桉树叶的内生真菌群落组成和结构进行分析,发现两组样品的真菌组成和结构存在较大差异,其中轮斑病害桉树叶内的真菌群落种类和丰富度均明显低于健康叶,表明轮斑病病原菌侵染引起了桉树叶内原有真菌菌群种类和数量的下降。在山茶灰斑病、枣树枣缩果病和漆树溃疡病的研究中也得出了类似的结果,即在病原菌的胁迫下,染病植株叶片的内生菌种类和数量均少于健康植株[9-11]。桉树和上述不同树种的研究结果表明,健康植株组织中的内生菌群具有更好的稳定性,能够抑制病原菌的发展。但在赤松梢枯病、柑橘黄龙病的研究中,染病叶片内生菌的丰富度则大于健康叶片[12-13],推测可能与病原菌侵染的不同阶段对植株内生菌群的影响程度不同有关,而桉树轮斑病菌是否也存在这一现象还需进一步深入研究。除此之外,健康植株在受到病原菌胁迫后,内部菌群的种类和数量上升或降低还与植株本身应对外界压力所表现的应答能力有关[14-16]。
在对健康和轮斑病桉树叶内生真菌组成的分析中,我们发现轮斑病菌C.eucalyptorum在健康叶和病害叶中均有分布,在健康叶中的丰度较低,在病害叶中则占据优势地位,可见轮斑病菌引起病害发生的先决条件是须在桉树叶上定殖并成为优势类群。同时,我们还发现U.australiensis、P.californica和P.ventilago在健康桉树叶中为优势菌,而在病害叶中的丰度明显降低,推测上述真菌可能在维持桉树叶内微环境稳定中发挥重要作用,这些优势菌群的丰度降低可能引起桉树叶部群落性质和微环境改变,最终导致轮斑病害的发生。但目前尚未有U.australiensis、P.californica和P.ventilago对轮班病菌的生长具有抑制作用的报道,因此还需开展相关实验进行验证。此外,染病植株中还可能存在与病原菌伴生的微生物。有报道显示,茶树叶中的茶树轮斑病菌Pestalotiopsis theae与茶树云纹叶枯病菌Guignardi camelliae、山茶叶中的G.camelliae与山茶灰斑病菌Pestalotiopsis guepini之间均存在相互促进,伴生发生的现象[17,9],表明某种病害的发生可能并非单一致病菌参与其中。在本研究中,我们也在轮斑病害桉树叶中检测到了花斑病菌A.pullulans和枝枯病菌L.theobromae的存在,但两者在病害叶中的丰度与健康叶无显著差异,表明A.pullulans、L.theobromae与C.eucalyptorum之间可能并不存在伴生关系。但有意思的是,我们在轮斑病害桉树叶中检测到F.eucalypticola、F.horovitziae、C.cyanovorans、F.mexicanus的丰度较健康叶显著增高,推测可能是由于C.eucalyptorum成为优势菌后引起了桉树叶内微环境的改变,继而为F.eucalypticola、F.horovitziae、C.cyanovorans、F.mexicanus的生长创造了适宜条件,促进了这些真菌的生长,而上述真菌是否与C.eucalyptorum存在伴生关系还有待进一步研究。
在本研究中,我们还发现B.velezensis对轮斑病菌的生长均有较强的抑制作用。B.velezensis对多种植物的病原菌均具有较强的拮抗作用,如马铃薯疮痂病菌Streptomyces scabies、烟草青枯病菌Ralstonia solanacearum、水稻稻瘟病Magnaporthe oryzae等[18-20],具有良好的生防应用价值。我们在健康桉树叶中也检测到了B.velezensisGyrA 基因片段,而在轮斑病害桉树叶中则未能检测到,推测在病害桉树叶内C.eucalyptorum可能抑制了B.velezensis的生长,这也进一步证明B.velezensis与轮斑病菌之间存在相互拮抗作用。但目前对于B.velezensis拮抗病原菌的机制尚不清楚,推测可能与其产生的抗菌物质有关。B.velezensis所属的芽孢杆菌属是一类重要的植物病原菌拮抗菌,易于定向分离,能够产生多种抗菌物质,如多肽类、脂肽类、蛋白类等,是自然界中广泛存在的非致病菌[21-23]。在本研究中,B.velezensis对轮斑病菌显示出了较好的拮抗作用,且该菌作为桉树叶的内生菌,定植能力强,在叶片内增殖后能够更好地与病原菌竞争空间和营养,从而抑制病原菌的生长,最终发挥防治病害的作用,因此有望作为一种新的生物防治手段。但上述结果仅是从菌株在实验室纯培养条件下的拮抗实验中获得,存在一定的局限性,因此下一步还需在桉树苗上进行致病性接种实验,用来验证B.velezensi拮抗C.eucalyptorum的效果。
4 结 论
本研究发现桉树叶部内生真菌的群落结构受到轮斑病菌侵染的影响,导致染病叶内生真菌群落的丰度下降。贝莱斯芽孢杆菌对桉树轮斑病菌的生长具有拮抗作用,但该菌的有效活性成分在室外的稳定性、适应性和生防效果还有待进一步深入探索。目前桉树轮斑病仍以化学防治为主,利用生防制剂防治该病害鲜有报道,因此贝莱斯芽孢杆菌的生防机制值得深入研究。
