肝细胞癌伴胆管癌栓的诊断与外科治疗
2022-05-18黄理铭吴嘉艺严茂林
黄理铭, 吴嘉艺, 严茂林
与门静脉癌栓相比,肝细胞癌(hepatocellular carcinoma,HCC)伴胆管癌栓(bile duct tumor thrombus,BDTT)的发生率更低,为1.2%~12.9%[1]。随着临床医师及影像科医师对该疾病认识的提高,HCC伴BDTT的检出率逐渐上升。HCC伴BDTT患者可表现为梗阻性黄疸,以往被误认为是HCC晚期表现,失去了外科手术机会。外科手术是HCC伴BDTT患者最有效的治疗手段,但目前对HCC伴BDTT的分型、诊断、术前减黄、手术方式、肝移植适应证等仍存在争议。
1 HCC伴BDTT分型
根据癌栓侵入胆管的范围,将HCC伴BDTT分为不同类型。目前HCC伴BDTT的分型主要有以下4种:Ueda 分型[2]、Satoh分型[3]、日本肝癌研究小组分型[4]及程树群教授分型[5-6]。相对于Ueda 分型,Satoh分型简单实用,易于掌握,能更好地指导临床诊治,但未对二级以上胆管的癌栓进行描述。程树群教授分型不仅考虑到BDTT范围,同时也兼顾了胆红素水平。日本肝癌研究小组分型简单明了,符合临床实际情况,又有利于外科手术治疗,是目前较为公认的分型方法。
1.1 Ueda 分型 Ⅰ型:BDTT位于肝内胆管二级分支以上;Ⅱ型:BDTT延伸至左或右肝管;Ⅲa型:BDTT自肝内胆管延伸至肝总管;Ⅲb型:BDTT种植于胆总管壁;Ⅳ型:BDTT漂浮于胆总管内。
1.2 Satoh分型 Ⅰ型:BDTT位于胆管一级分支内,未到达左右肝管汇合处;Ⅱ型:BDTT超过左右肝管汇合处;Ⅲ型:BDTT游离于原发肿瘤,在肝外胆管腔内延伸。
1.3 日本肝癌研究小组分型 B0:未发现BDTT;B1:BDTT位于三级胆管及以上;B2:BDTT位于二级胆管;B3:BDTT位于一级胆管;B4:BDTT位于肝外胆管。详见图1。
1.4 程树群教授分型 肝内型(Ⅰ型):即BDTT局限于肝内,其中Ⅰa型为胆管二级分支及以上癌栓,Ⅰb型为胆管一级分支癌栓。肝外型(Ⅱ型):BDTT位于肝总管/胆总管内,其中Ⅱa型为总胆红素<300 μmol/L,Ⅱb型为总胆红素≥300 μmol/L。
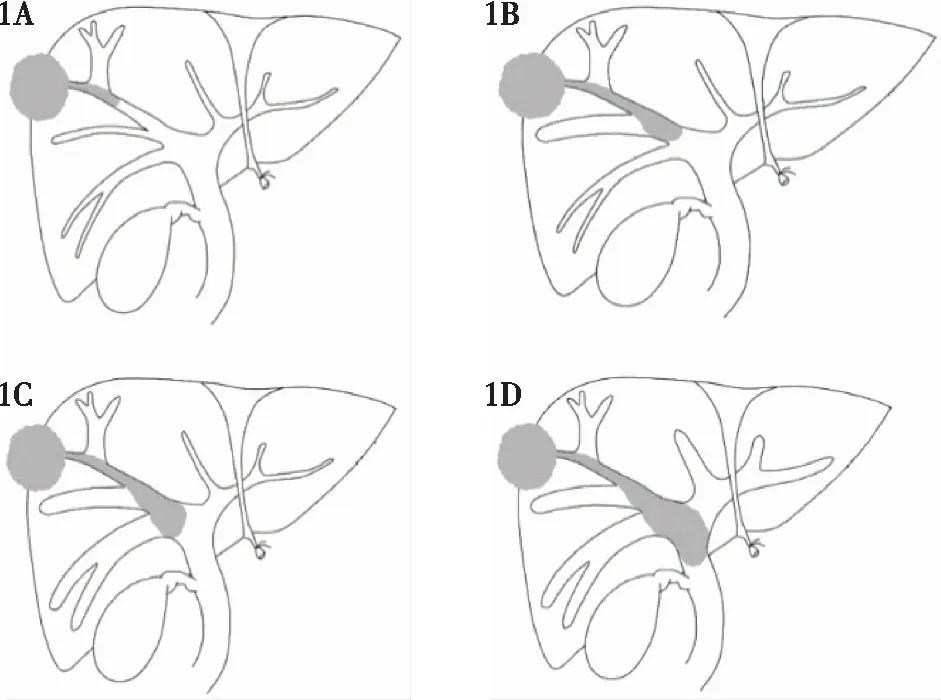
1A:HCC位于S8背侧,BDTT延伸至S8胆管,S8腹侧胆管扩张(B1);1B:BDTT延伸至右肝前叶胆管,S5段胆管扩张(B2);1C:BDTT延伸至右肝胆管,S5和右肝后叶胆管扩张(B3);1D:BDTT延伸至肝总管或胆总管,左肝内胆管和右肝后叶胆管扩张(B4) 图1 日本肝癌研究小组HCC伴BDTT分型
BDTT对HCC的分期是否有影响,我们做了初步探讨。我们的研究证实 BDTT会影响美国肿瘤联合会(America Joint Committee on Cancer,AJCC)Ⅰ~Ⅱ期HCC患者手术疗效,但不会影响AJCC Ⅲ~Ⅳ期患者预后。因此,HCC合并BDTT时,我们推荐AJCC分期系统可以增加一个分期,其总体生存时间和无复发生存时间的预测能力更高[7]。
2 HCC伴BDTT诊断
HCC伴BDTT的术前诊断主要依靠CT或MRI,确诊主要依据术后病理检查。肝占位性病变和肝内胆管扩张是其主要影像学特征[6,8]。笔者建议HCC伴BDTT的影像学诊断方法首选MRI及磁共振胰胆管造影。MRI及磁共振胰胆管造影能较好显示B3和B4型BDTT及其相应的扩张胆管,B1和B2型BDTT较难发现,但可以通过梗阻平面以上胆管扩张来间接判断BDTT的位置[6]。
3 术前胆道引流
1%~13%的HCC伴BDTT会出现梗阻性黄疸[9-10],术前积极胆道引流至关重要。术前胆道引流有利于控制胆道感染、改善肝功能及纠正凝血功能、减少术中术后出血及术后发生肝功能衰竭的可能。虽然胆道引流后的手术时机目前还存在争议,但按高位胆管梗阻来处理的观念趋于一致。有学者认为:总胆红素水平≤50 μmol/L或总胆红素降低水平<50%,且无胆道感染是行大面积肝切除术的先决条件[11]。也有日本学者主张HCC伴BDTT合并黄疸患者术前黄疸指标应先降至正常,有利于大面积肝切除[12]。
HCC伴BDTT术前胆道引流的方法主要有经皮肝胆管穿刺置管引流术(percutaneous transhepatic cholangial drainage,PTCD)、内镜下鼻胆管引流术和支架植入[11]。笔者认为,PTCD应放置于健侧胆管及胆总管内,可以充分引流胆道,又可以避免术后放置T管。超声引导下行PTCD是HCC伴BDTT术前首选的胆道引流方法。内镜下鼻胆管引流术和支架植入也可以作为HCC伴BDTT术前胆道引流方法。
4 B4型BDTT取栓方法
目前文献报道B4型BDTT取栓方法有两种:Pelling off和“q”形胆总管切开取栓[13-14]。Yamamoto等[13]首先报道了Pelling off技术,但这项技术存在取栓方法繁琐且不符合无瘤原则等缺陷。笔者的“q”形胆总管切开取栓方法的优势如下:可一体化切除HCC病灶及癌栓,符合无瘤原则;能很好显露肝外胆管,同时结合术中胆道镜,能最大限度降低肝外胆管癌栓残留[15],详见图2。

2A:肿瘤位于右肝前叶Ⅷ段,癌栓沿右肝前叶胆管延伸至肝总管;2B:解剖右肝蒂,对右肝动脉及门静脉右支予以离断缝扎,循肝中静脉前入路切除右半肝,离断右肝静脉及肝周韧带,仅剩右肝胆管与右半肝相连;2C:沿肝外胆管前壁纵行切开,环行切断右肝胆管,称之为“q”形取栓术,胆管断端送冰冻检查,术中胆道镜;2D:可吸收线连续缝合右肝胆管断端及肝外胆管前壁 图2 “q”形胆总管切开取栓术示意图
5 手术方式的争议
外科手术是治疗HCC伴BDTT患者最有效的手段,其原则是祛除HCC病灶和病变胆管[13,16-17]。外科手术治疗HCC伴BDTT已达共识,但具体的手术方式还存在两大争议:解剖性肝切除还是局部肝切除以及是否切除肝外胆管。
解剖性肝切除不仅切除了肝脏原发肿瘤,同时也切除相应病变的胆管,减少胆管残留肿瘤的可能。笔者回顾性分析了175例接受根治性切除的HCC伴BDTT,分为解剖性肝切除组和非解剖性肝切除组,予以倾向性匹配分析后,两组间无复发生存时间差异有统计学意义,虽然解剖性肝切除组的3年和5年生存率好于非解剖性肝切除组,但差异无统计学意义。根据肿瘤大小进一步分层后,如果肿瘤直径≤5 cm,两组间无复发生存时间和生存时间差异均有统计学意义[18]。因此,笔者提出解剖性肝切除是治疗HCC伴BDTT的首选治疗方式,尤其当肿瘤直径<5 cm时,其预后明显好于非解剖性肝切除患者。
一项韩国多中心研究[19]回顾性报道了73例HCC伴BDTT患者,单因素分析提示肿瘤最大直径、肝外胆管切除和根治性切除是影响其生存时间的危险因素,然而多因素分析并没有证实肝外胆管切除是影响预后的独立危险因素。该研究认为,无论有无肝外胆管切除,只要达到R0切除就能提高HCC伴BDTT患者生存率。韩国和日本多中心研究[20]报道了257例接受外科手术治疗B3和B4型HCC伴BDTT患者,其中213例(82.9%)行半肝以上肝切除,19例(12.6%)B3和49例(46.2%)B4行肝外胆管切除。该研究表明大面积肝切除和肝外胆管切除能明显提高B3和B4型HCC伴BDTT患者R0切除率,从而提高其远期疗效。
目前,B3和B4型HCC伴BDTT患者是否切除肝外胆管还存在争议,但BDTT侵犯肝外胆管或与肝外胆管壁粘连致密是切除肝外胆管的绝对适应证[6]。但有不少学者认为,BDTT在肝外胆管内膨胀性生长,很少累及肝外胆管壁,所以只要切除肝脏原发灶,不需要切除肝外胆管就能达到根治的目的[9]。全部切除肝外胆管的做法无疑会牺牲部分无肝外胆管受侵犯的病例[21],且切除肝外胆管后需要行胆肠吻合,存在手术创伤大、手术时间长、术后并发症增多等问题。
6 肝移植
对于合并肝硬化的HCC患者,肝移植同时能解决肝硬化和HCC的问题,不失为一种有效的治疗手段。特别是HCC伴BDTT合并严重肝硬化患者,无法行常规肝叶切除,此时肝移植是唯一有效的治疗手段[19,22-25]。但肝移植治疗HCC伴BDTT一直存在争议,主要原因是术后复发率高。Ha等[25]报道了14例HCC伴BDTT患者行肝移植,术后1、3、5年总体生存率和复发率分别为92.9%、57.1%、50%和15.4%、46.2%、46.2%。肉眼血管癌栓是影响HCC伴BDTT肝移植预后的危险因素。肉眼BDTT合并肉眼门静脉癌栓可能是肝移植的绝对禁忌证。可见,选择合适的HCC伴BDTT病例行肝移植是减少术后复发的关键因素。
7 总结
综上所述,肝占位性病变和肝内胆管扩张是HCC伴BDTT主要影像学特征,外科手术是其最有效的治疗手段。只要患者肝功能许可,尽可能行解剖性肝切除,既能切除肝内原发病灶,又能减少BDTT残留。是否切除肝外胆管,有待前瞻性临床大样本研究进一步证实。HCC伴BDTT肝移植术后复发率高,选择合适病例行肝移植显得尤为重要。
